乙烯和水杨酸在大豆胞囊线虫与大豆间亲和性反应中的相互作用
2020-09-09胡岩峰潘凤娟
胡岩峰,尤 佳,潘凤娟
(1.中国科学院 东北地理与农业生态研究所,黑龙江 哈尔滨 150081;2.黑龙江省农业科学院 草业研究所,黑龙江 哈尔滨 150086)
0 引 言
大豆胞囊线虫(HeteroderaglycinesIchinohe,soybean cyst nematode,SCN)病是造成大豆减产最严重的植物病害之一。世界范围内,每年仅因SCN病害造成的经济损失可达数十亿美元。调查发现,SCN在我国东北、黄淮海等大豆主产区广泛发生与分布[1],并且近年来逐渐向西北、西南省份蔓延[2-4],严重制约我国大豆安全生产。
合理利用抗病基因,选育稳定、广谱及持久的大豆抗病品种是防治SCN病害最经济有效的手段[5],而最优化的植物病害安全控制途径是充分发挥寄主自身的抗病防御机制。植物抗病性是多个基因协同作用的结果,涉及许多防御信号网络和次生代谢途径的变化。目前,对于寄主大豆与SCN间的互作分子基础涉及哪些重要的信号网络尚缺乏准确、深入和完整的认识。此外,SCN与大豆在长期互作中形成复杂的进化关系,导致SCN小种出现遗传变异的多样性[6-7]。SCN向寄主根细胞分泌效应蛋白逃避或抑制寄主防御,是大豆对SCN抗性丧失的一个主要原因[8]。因而,深入研究大豆应对SCN的防御信号网络,对抗病防治和抗病遗传育种工作具有重要的理论和指导意义。
植物激素在精细调控植物抗病性的信号网络中起着全局性枢纽作用。乙烯(Ethylene,ET)和水杨酸(Salicylic Acid,SA)作为重要的植物生长激素,在植物抗病虫害防御反应中的作用被广泛报道[9]。近年来又发现,ET和SA途径也参与调控寄主植物与植物病原线虫间相互作用[10],尤其在抵御根结线虫的防御反应中发挥正调控作用[11-15],但ET和SA在植物响应胞囊线虫侵染中的功能研究较少。已有研究表明,过表达大豆SA甲基转移酶基因GmSAMT能显著增加大豆对SCN的抗性[16]。另外,在感病大豆中,异源表达拟南芥SA途径的关键基因AtPAD4、AtNPR1、AtTGA2、AtPR-5也能部分提高大豆对SCN的抗性[17-18]。这些证据表明,SA信号转导途径是抗SCN防御反应中重要组成部分。然而,ET途径似乎在植物应对胞囊线虫的抗性互作过程中起负调节作用。例如,拟南芥的乙烯过量产生突变体则对甜菜胞囊线虫(Heteroderaschachtii)变得易感[19-21],SCN也在大豆乙烯不敏感突变体etr1-1和T124N38根中发育迟缓,并且雌虫数减少[22]。此外,SA与ET途径在许多植物抗病防御反应过程中往往存在协同或拮抗作用[23]。由于这些研究尚处在初期,SA和ET在大豆与SCN互作反应中的具体作用机理尚不清楚,两者之间的相互作用关系有待进一步验证。
1 材料与方法
1.1 试验材料
供试大豆(Glycinemax(L.) Merr.)为William 82,由中国科学院大豆分子设计育种重点实验室提供。大豆种子用10%次氯酸钠溶液浸泡10 min后,用自来水冲洗30 min,置于25 ℃下暗处催芽4天后,转移至光照培养箱生长(光照强度95 800 Lux,日照时间13 h昼/11 h夜,温度26 ℃昼/22 ℃夜,湿度65%)。SCN5号生理小种由本实验室提供,接种在感病大豆品种“东生1”上繁殖。
1.2 试验方法
1.2.1 转录组测序分析。大豆在光下生长10天后,每株幼苗接种2 000条J2幼虫,侵染24 h后收集大豆根组织用于RNA提取。制备的RNA样品送至北京百迈克生物科技有限公司进行建库、测序及后期数据分析(包括本研究中MapMan分析)。
1.2.2 乙烯利、水杨酸外源处理。乙烯利(Ethephon,ETH)和SA均购自Sigma公司。ETH在无菌双重水中溶解后配制成0.1 mM、0.2 mM及0.5 mM处理浓度。SA在乙醇中溶解后用双重水配制成0.5 mM、1 mM及2 mM处理浓度。如图1所示,待大豆幼苗第一对真叶完全展开后,用气压喷壶喷施叶片并置于暗处处理24 h,喷施无菌双重水作为对照组。
1.2.3 线虫接种。采用改良淘洗-过筛法从土壤中收集SCN胞囊,经蔗糖梯度密度离心分离饱满胞囊,用组织研磨器破碎胞囊外壳,将收集的卵置于28 ℃恒温培养箱内孵化,4天后收集孵化的J2幼虫用于接种。大豆萌发方法同上,挑选发芽一致大豆移栽至包含沙土(1∶1)的营养钵(直径7.0 cm×高度11.0 cm),每钵1株苗。光下生长10天后,每株幼苗接种400条J2幼虫。接种2天、3天、5天、8天、35天后,收集大豆根系用于RNA提取或线虫检测(图1)。
1.2.4 品红染色[24]。大豆根系置于15%次氯酸钠中浸泡10 min,转移至双重水中清洗约15 min。彻底除去次氯酸钠后,将根系置于35%酸性品红(Sigma)煮沸30 s,冷却至室温。压片后在体式解剖镜下统计根内线虫数目。
1.2.5实时荧光定量PCR(qRT-PCR)分析基因表达。利用Trizol (Invitrogen)提取大豆根组织总RNA,并经DNase I (Invitrogen)37 ℃消化处理45min去除基因组DNA,使用反转录试剂盒PrimeScript RT reagent Kit(Thermo Fisher)合成cDNA第一链。将cDNA模版添加至AceQ®Universal SYBR qPCR Master Mix(Vazyme)混合均匀(反应体系20 ul),在实时荧光定量PCR 仪LightCycler®480上扩增目标基因,反应条件参照AceQ®Universal SYBR试剂说明书进行。利用2-ΔΔCT法分析目标基因表达,内参基因为GmUbiquitin3[25]。所用的引物序列分别为:GmICS1-F:GGCCATTTCGGAGCTGG;GmICS1-R:AGGAGAAGGTGGTTCTGTGAGAGA;GmICS2-F:CATGGCCAT-TTCGGAGCTTA;GmICS2-R:CAGAAGATGGTTCTGCGAATGG;GmEDS1-F:TGATGAGAGGAGAGGTGATTGAG;GmEDS1-R:TCTTGAGGGTCGTTTCTGTTGA;GmACS1-F:CGTGGCGGCTGAGTCTCAG;GmACS1-R:ATTAAAATTGAATTTTATG;Gm-ERF1-F:AACCTTATAAATATCCATC;Gm-ERF1-R: AATTTAATTAACACTACTAACACAA;GmNPR1-F:AATTGACCAAGAGCTTCCGC;GmNPR1-R: CTACAGAAGCATCATTTTCAACATCTT;GmPR1-F:GCATCATGAATTTAGCCAACG;GmPR1-R:TTCCAGGTGACCAAGCAAGT;GmPR2-F:ATGGCTAAGTATCATTCAAGTGG;GmPR2-R:GTGCCTGTATAAGTGATTAGAAGG;GmPR5-F:ACTTCTACGACGTGAGCCTG;GmPR5-R:GTAGCTGCATTTTCCGGAT;Ubiquitin3-F: GTGTAATGTTGGATGTGTTCCC;Ubiquitin3-R: ACACAATTGAGTTCAACACAAACCG。
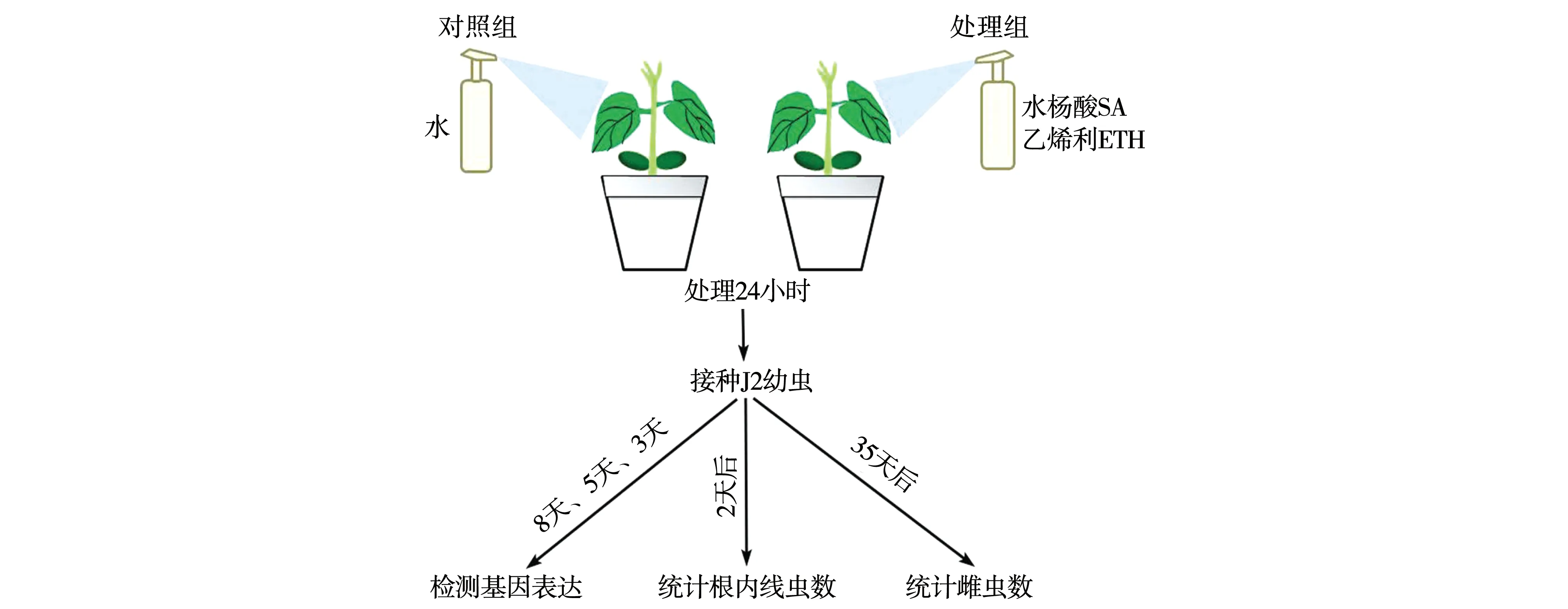
图1 外源激素处理示意图Fig.1 Schematic diagram of exogenous phytohormone treatments
1.3 数据分析
数据应用SPSS软件进行统计学分析,使用Graphpad Prism 6.0进行数据作图,利用Photoshop软件进行图片处理。
2 结果分析
2.1 ET、SA代谢途径对SCN侵染响应的转录组分析
利用MapMan将植物激素代谢通路进行了可视化分析(图2)。SCN早期侵染24 h后,寄主的ET和JA途径变化较为显著,其中14个与乙烯合成相关的基因显著上调表达(Log2FC>1),9个乙烯信号转导有关的基因也显著上调,表达倍数超过1(表1)。相比较而言,SA代谢通路受SCN胁迫影响较小,尤其是与合成途径有关的基因表达增加倍数均低于1。
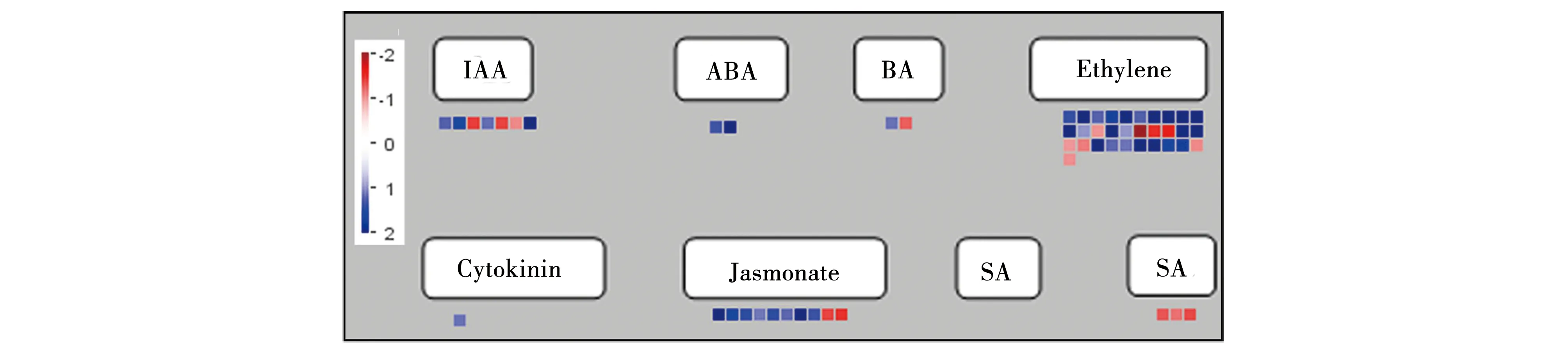
图2 MapMan分析SCN侵染24 h后对寄主激素代谢途径的影响Fig.2 MapMan-derived visualization of expression profiles of phytohormone metabolic pathways in soybean roots infected with nematode for 24 hours
2.2 外源添加ETH和SA对响应基因表达的影响
为了明确叶片外源喷施ETH和SA是否能够将信号从地上部分传递到根部以及有效作用浓度,检测了不同激素浓度下ET、SA响应基因的表达变化。qRT-PCR结果显示,叶片喷施0.5 mM的ETH可显著诱导大豆根内ET响应基因GmERS1上调表达(图3A)。1 mM和2 mM的SA处理24 h后均可增加根部SA受体基因GmNPR1表达水平,尤其是2 mM浓度下GmNPR1表达上调了约3倍(图3B)。因此,在后续试验中选用0.5 mM、2 mM分别作为ETH、SA的有效处理浓度。
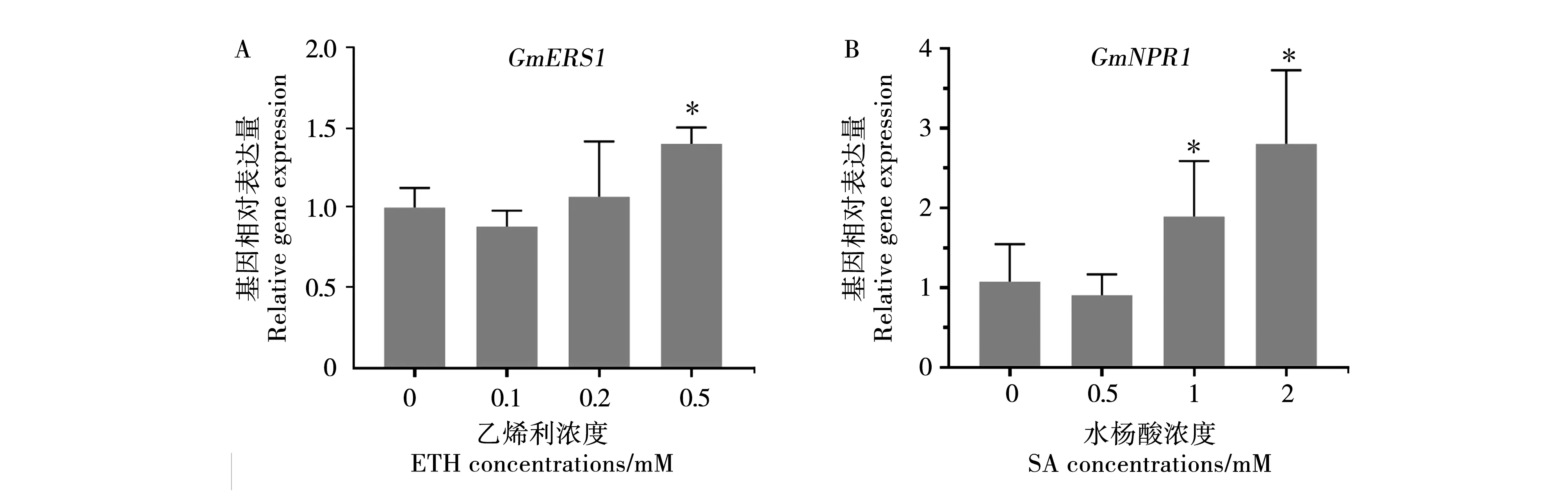
注:数据为试验平均值±标准差(P<0.5)。下同。Note:Data are the mean±SD,P<0.5.The same is as below.图3 qRT-PCR分析外源ETH(A)和SA(B)处理对ET、SA信号途径激活情况Fig.3 Quantitative reverse-transcription polymerase chain reaction (qRT-PCR) data showing the response of the ET,or SA pathways in soybean roots at 24 h after ethephon (ETH) or salicytic acid (SA) treatments at different concentrations

表1 涉及乙烯、水杨酸代谢途径的差异表达基因列表Table 1 Lists of differentially expressed genes involved in ET and SA pathways.
2.3 外源添加ETH和SA对SCN侵染及发育的影响
为了评估大豆根部ET和SA途径激活后是否影响SCN侵染及生长发育,接种线虫2天、35天后,分别统计了根内J2数目和根系上的胞囊数。品红染色后镜检发现,根内线虫总数在ETH处理组和对照组之间没有统计学上的显著性,外源喷施SA也没有显著改变SCN的侵染率(图4A)。与对照相比,ETH处理后SCN的胞囊数显著提高了29.4%,而喷施SA则导致胞囊数显著下降了39.5%(图4B)。以上结果表明,外源ETH处理有利于SCN在寄主根内寄生,而SA外施可提高大豆对SCN抗性。

图4 添加乙烯利(ETH)、水杨酸(SA)对大豆根内线虫数目(A)和胞囊数变化(B)的影响Fig.4 Effects of exogenous ETH and SA treatments on the number of infected J2s (A) and cysts (B) in soybean roots
2.4 ET和SA信号在寄主与SCN间亲和反应中的相互作用
有研究报道,植物应对活体营养性病原侵染时,SA与ET/JA途径存在拮抗作用[9]。为了明确这两者是否在SCN与寄主互作中也存在类似交互作用,我们进行ETH与SA共处理(ETH喷施24 h后进行SA处理)。如图5A所示,ETH可显著抑制SA引起的诱导抗性。与SA单独处理相比,ETH与SA共处理时SCN胞囊数恢复到了对照组水平,暗示两者可能存在拮抗作用。qRT-PCR分析表明,ETH处理24h后,根内SA合成酶基因GmICS2的表达被显著抑制。但是,SA处理后在一定程度上可诱导ET响应基因GmERF1上调表达(图5B)。
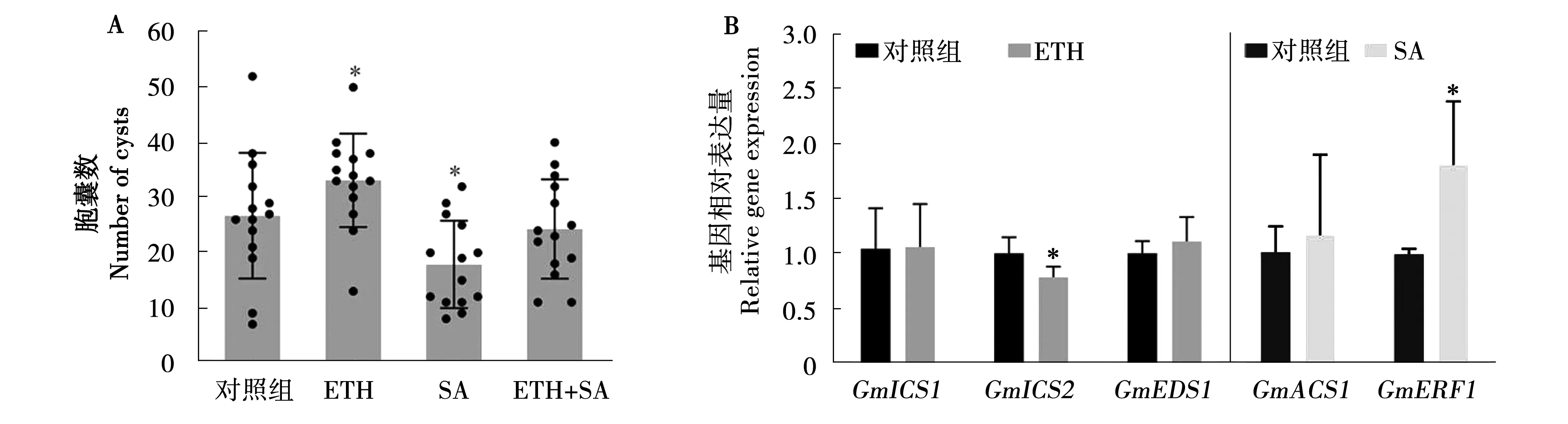
注:A代表外源ETH处理能够抑制SA对SCN的诱导抗性;B代表qRT-PCR分析ETH对SA途径的调控作用,以及SA处理对ET途径的调控作用。Note: A means ET-induced susceptibility to soybean cyst nematodes involved repression of SA-mediated defenses; B means quantitative reverse transcription polymerase chain reaction (qRT-PCR) was performed on RNA from root tissues at 24 h after ETH or SA treatments.图5 ET和SA信号在寄主与SCN间亲和反应中的相互作用Fig.5 Cross-talk between the ABA and JA pathways during soybean-nematode interactions
2.5 外源ETH、SA处理对GmPRs基因表达的影响
PR是植物体内一类非常重要的防御基因,能够被SA显著诱导。在感病大豆与SCN间的亲和性反应中,早期SCN侵染(接种3天)可显著提高GmPR1和GmPR5的转录水平,分别是未侵染组基因表达水平的2和3.5倍。然而,当SCN取食点开始建立时,GmPR1的表达被显著抑制,并且GmPR5也降低到了对照水平(图6),暗示抑制大豆GmPR防御基因表达可能有助于SCN形成营养细胞。
此外,进一步分析了外源添加ETH和SA后GmPRs对SCN寄生的响应模式。和非处理组相比,SCN侵染3天后,ETH外施组的GmPR2表达降低了约50%,GmPR5被显著诱导,而GmPR2和GmPR3在接种5天、8天后均下调表达(图7A)。SA处理后,GmPR1和GmPR2分别在线虫侵染5天和8天后显著上调表达。然而,GmPR2表达在接种5天后比非处理组显著下调了约40%。GmPR5则随着线虫侵染时间的延长呈现下降趋势,其中接种5天、8天后其表达水平分别降低到非处理组的47%和32%(图7B)。
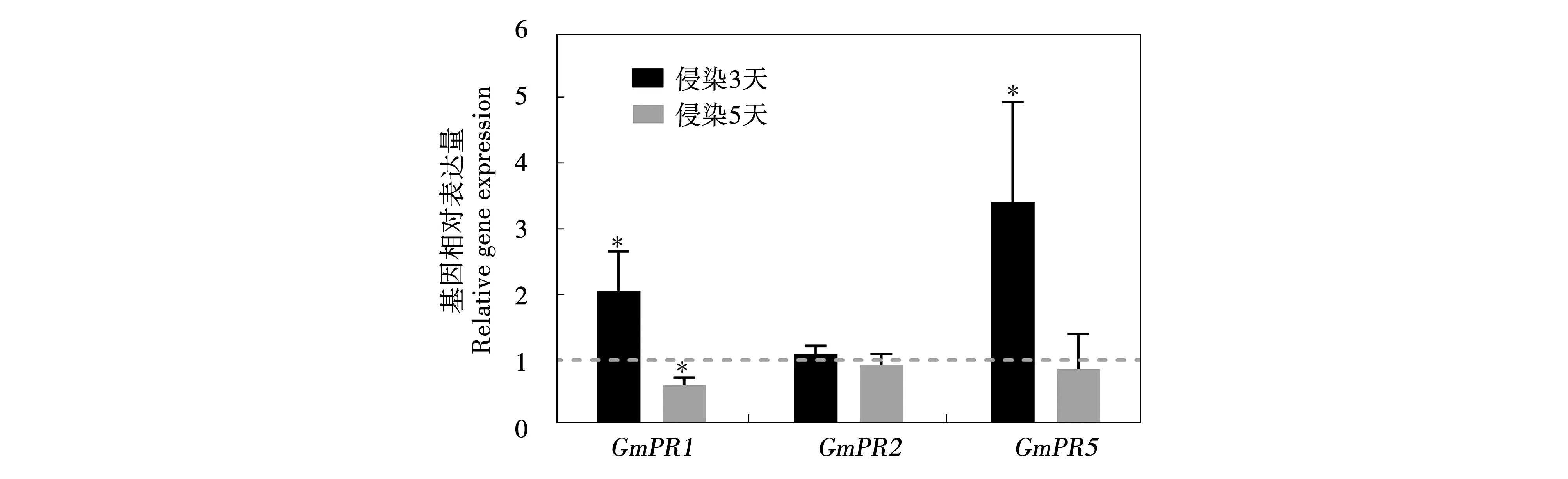
图6 SCN侵染对防御基因PR表达的影响Fig.6 Pathogenesis-related (PR) gene expression by quantitative real-time reverse transcription-polymerase chain reaction (qRT-PCR) in roots of susceptible soybean plants under 3 days and 5 days after inoculation with 400 invasive juveniles (J2s) of soybean cyst nematodes
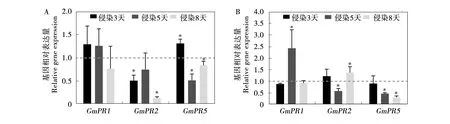
注:基因相对表达量为激素处理组与非处理对照组的比值(虚线表示非处理对照组的表达量设为1)。Note:GmPR transcript levels of roots from ETH or SA-treated plants relative to those from untreated control plants (the value of unity indicates no change).图7 qRT-PCR分析了寄主与SCN间不同亲和性反应时期外源ET(A)和SA(B)处理对防御基因PR表达的影响Fig.7 Time course analysis of pathogenesis-related (PR) gene expression by quantitative real-time reverse transcription-polymerase chain reaction (qRT-PCR) in soybean roots at 1,3,5 and 8 days post-treatment with ETH or SA
3 讨 论
近年来,组学技术的快速发展为植物寄生线虫与寄主互作的研究提供了便利。有多个研究组利用转录学研究了不同抗、感栽培大豆品种、野生大豆资源对SCN侵染的分子响应,数据分析显示寄主与SCN互作过程均涉及到了植物激素代谢途径[26-29]。Zhang等[27]利用RNA-Seq分析了SCN与抗、感野生大豆中基因表达调控网络,在亲和性反应中ET合成酶基因GmACO、GmACS不同程度的上调表达,而在非亲和性反应中GmACS的表达显著下调。本研究也证实,在SCN与大豆感病材料早期(接种24 h)的亲和性反应中,ET合成相关基因GmACS被显著诱导。有试验证据也显示,SCN侵染大豆数小时内,ET合成前体ACC含量显著上升,并且多个GmACS基因表达水平显著升高[30],进一步说明ET途径在SCN早期入侵大豆感病品种具有重要作用。然而,SCN侵染后ET途径基因表达模式似乎与线虫发育时期及寄主的品种有关。例如,尽管在亲和性反应中ET合成途径被激活,然而其信号转导途径相关基因表达则变化不显著[27]。有转录组数据发现,在非亲和性互作中SCN侵染也能激活ET合成途径及下游基因表达[26,28]。这些研究说明ET途径可能在SCN发育的不同阶段具有多重功能。对于SA途径而言,已有的RNA-Seq分析结果表明,绝大多数SA途径相关基因在SCN与寄主亲和性反应中变化较小,而非亲和性反应中被显著活化,暗示了SA途径在SCN抗性反应中的正调控作用[26-28]。
本研究发现,外源EHT处理能显著提升SCN繁殖能力,该结果进一步支持了Bent等[22]研究结论,即抑制乙烯信号传导会造成SCN在大豆中发育滞后,并且ET的合成抑制剂和功能拮抗剂处理均能显著降低SCN雌虫数[30],充分说明激活ET途径有利于SCN发育,这可能是SCN长期进化出的寄生策略。大量研究表明,SA途径是植物抵御植物寄生线虫抗病反应中的重要组分。本研究也发现,外源SA处理可增加大豆对SCN的抗病能力,这与Li等[28]外施SA减少SCN胞囊数的结果一致,并且多个大豆转基因试验也证实了过表达SA途径关键组分可提高感病大豆抗SCN的能力[16,18]。外源EHT和SA共处理后SCN胞囊数较SA单独处理有所提升,表明ET途径的活化可能会部分抵消SA对SCN抗性的诱导作用,并且ET处理后SA合成基因GmICS2被部分抑制,暗示ET与SA在寄主与SCN互作用中可能存在拮抗作用。这也部分的解释了外施ET后,SCN侵染会造成SA响应基因GmPR2和GmPR3的表达出现不同程度下调,这可能与SA依赖GmICS2合成途径被ET间接抑制有关。已有研究表明,GmWRKYs转录因子家族作为SA下游基因与SCN抗性密切相关,过表达GmWRKYs后能显著提高感病大豆对SCN的抗性[31]。本研究提供试验证据,外施SA提高SCN抗性与诱导GmPR1和GmPR2表达密切相关。利用大豆发根过表达GmPR基因可能会进一步证实该结论,这有待于今后深入探讨。
4 结 语
本研究利用转录组初步揭示了感病大豆与SCN间的早期亲和性反应中ET和SA途径的表达变化,明确了SCN进入寄主后J2幼虫移动阶段(侵染24 h)可显著激活ET合成途径,而对SA途径影响较小。利用叶片外源喷施激素进一步证实了ET途径对于SCN寄生起正调节作用,而SA对寄主防御SCN具有正向功能,并且两者可能存在拮抗作用。但是,在大豆与SCN间亲和性反应中,具体是那些功能基因在ET和SA交互中发挥关键作用仍不清楚,需要更多的试验证据去揭示它们之间的作用关系。
