关于糖尿病视网膜病变患者脉络膜血管指数的初步研究
2020-09-08沙艳会王敬敬
沙艳会,李 爽,王 薇,王敬敬,王 康
0引言
糖尿病视网膜病变(diabetic retinopathy,DR)是主要的致盲性眼病之一[1]。研究结果表明,糖尿病患者不但视网膜血管会发生改变,脉络膜毛细血管也可发生管腔变窄及管壁萎缩、变薄等变化[2-5]。有学者认为,脉络膜厚度的变化预示脉络膜血流的改变[6]。然而,目前并未发现糖尿病患者脉络膜中存在这种相关性[7-8],由于脉络膜组织结构复杂,包括血管、基质、细胞外液等组成成分,单纯观察脉络膜厚度的变化并不能反映各组成成分的变化,这就需要一种更加稳定、准确的指标来评估脉络膜的情况。脉络膜血管指数(choroidal vascularity index,CVI)是指血管区占黄斑中心凹下总脉络膜区域(total circumscribed subfoveal choroid area,TCA)的百分比。Sonoda等[9]认为CVI可以全面客观地评价糖尿病患者脉络膜的变化。本研究旨在比较并发DR的2型糖尿病患者与无糖尿病病史人群之间CVI的差异,对DR患者CVI的变化特点进行初步研究。
1对象和方法
1.1对象选取2017-01/12于首都医科大学附属北京友谊医院就诊的2型糖尿病并发DR患者68例作为DR组,其中男38例,女30例;平均年龄60.5±6.1岁。DR组纳入标准[10-11]:符合以下至少一项且已发生DR者:(1)空腹血糖≥7.1mmol/L;(2)糖耐量试验阳性;(3)任意时刻糖化血红蛋白≥6.5%;(4)有多饮、多食、多尿、体质量减轻等症状,同时任意时刻血糖≥11.1mmol/L。同时纳入同期在我院体检的无糖尿病病史的健康人群34例作为对照组,其中男18例,女16例;平均年龄59.6±7.6岁。两组受试者排除标准:(1)光相干断层扫描(OCT)显示有明显黄斑部视网膜色素上皮层萎缩,或合并其他可能影响脉络膜的眼部疾病,如年龄相关性黄斑变性、视网膜静脉阻塞、视网膜动脉阻塞、中心性浆液性脉络膜视网膜病变、葡萄膜炎、青光眼、高度近视、眼缺血综合征、视网膜色素变性及各种原因导致的渗出性视网膜脱离等;(2)近3mo进行过内眼或眼部手术,包括玻璃体腔注药术、白内障摘除手术、玻璃体切除术等,以及任意时间接受全视网膜光凝术(panretinal photocoagulation,PRP)治疗等;(3)存在影响OCT测量的屈光间质混浊或异常,如玻璃体腔硅油填充状态、明显的玻璃体混浊、玻璃体积血、严重的白内障等;(4)等效球镜度数>±2.00D;(5)双眼中任一眼符合前述(1)~(4)项目中的任意一项;(6)存在恶性高血压[12]、高血压控制不理想(检查当日血压大于140/90mmHg)、血脂代谢异常、妊娠[13]等可能影响脉络膜的全身疾病或状态。本研究遵循《赫尔辛基宣言》,通过首都医科大学附属北京友谊医院伦理委员会审核(批文号:2018-P2-205-01),所有受检者均对本研究知情同意并签署知情同意书。
1.2方法两组受检者双眼均进行最佳矫正视力(best corrected visual acuity,BCVA)检测,结果转换为LogMAR视力进行统计分析,并采用非接触眼压计测量眼压,进行裂隙灯显微镜、彩色眼底照相、黄斑OCT检查。OCT检查方法:经黄斑中心凹单线扫描进行OCT检查,扫描模式为EDI-OCT,选用30°镜头,扫描线长度调至最长,每只眼扫描3次,选取图像质量最清晰的图像进行分析,所有操作均由同一名技师完成,由两位眼科专家共同评定图像质量。测量中心视网膜厚度(central retinal thickness,CRT),即黄斑中心凹处视网膜内界膜至视网膜色素上皮层内表面的距离;黄斑中心凹下的脉络膜厚度(subfoveal choroidal thickness,SFCT),即黄斑中心凹下方视网膜色素上皮层外表面至脉络膜与巩膜交界面的距离。应用Image J生物图像分析软件[14]对EDI-OCT图像进行分析,设定比例尺,图像色彩设置为8位,采用Niblack算法对图像进行二值化处理,选择多边形工具截取黄斑中心凹下1500μm范围的脉络膜区域进行分析(即以黄斑中心凹为中心,鼻颞两侧各延伸750μm),见图1。图像二值化后黑色区域为脉络膜血管区,白色区域为脉络膜间质区。再将图像设置为RGB色彩模式进行色彩阈值分析。本研究将黄斑中心凹下1500μm区域的脉络膜总面积定义TCA,其中血管区域面积定义为血管区面积(luminal areas,LA)、脉络膜间质区域面积定义为间质区面积(stromal areas,SA)。通过软件中Analysis下拉列表中ROI Manager工具对TCA、SA、LA进行测算,并计算CVI,CVI=LA/TCA×100%。
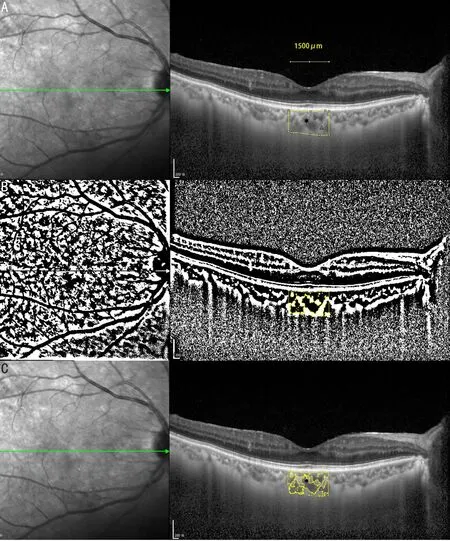
图1 EDI-OCT图像及分析 A:将EDI-OCT图像用Image J软件打开,选择黄斑中心凹下脉络膜1500μm范围,其中黄斑中心凹鼻侧750μm,黄斑中心凹颞侧750μm,将所选区域加入ROI Manager,测定黄斑中心凹下总脉络膜区域(TCA);B:选定Niblack,将前述图像进行二值化处理,将脉络膜图像中的间质区域(SA)调至最亮(白色),血管区域(LA)调至最暗(黑色),将所选区域加入ROI Manager测定LA,SA=TCA-LA;C:将ROI Manager中所选黄斑中心凹下总的脉络膜区域(TCA)Overlay至EDI-OCT图像中。“—”示水平位1500μm标尺;示脉络膜图像中的血管区域;Δ示脉络膜图像中的间质区域。
统计学分析:应用SPSS 16.0软件对数据进行分析处理。计量资料采用均数±标准差描述,采用配对样本t检验分别对DR组患者双眼数据进行比较;采用两独立样本t检验分别对DR组和对照组及DR组中不同亚组的数据进行比较(选取右眼数据进行分析)。CVI的诊断性评价应用Med Calc软件对数据进行分析处理,采用受试者工作特征(receive operating characteristic,ROC)曲线对CVI进行特异度和灵敏度的评价。采用Bland-Altman法评价TCA、LA测算结果的一致性。P<0.05为差异有统计学意义。
2结果
2.1图像分析结果的一致性评价本研究中EDI-OCT图像分析由两位测量人员分别进行,应用Bland-Altman差值法分析两位测量人员对DR患者TCA、LA测量结果的一致性,结果显示,两位测量人员对DR患者的TCA、LA测量结果的差值基本位于95%一致性界限(95% limits of agreement,95%LoA)以内(图2),表明TCA、LA测量结果可重复性好。

图2 两位测量人员分析DR患者TCA和LA的Bland-Altman一致性分析结果 A:TCA;B:LA。
2.2 DR组患者双眼各观察指标的比较DR组患者双眼BCVA、眼压、CRT、SFCT、TCA、SA、LA、CVI及DR分期差异均无统计学意义(P>0.05),见表1。
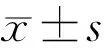
表1 DR组患者双眼各观察指标的比较
2.3 DR组和对照组受检者各观察指标的比较DR组和对照组受检者眼压、SFCT、TCA、LA、SA差异均无统计学意义(P>0.05),BCVA、CRT、CVI差异均有统计学意义(P<0.001),其中DR组患者CVI为64.33%±3.25%(95%CI:63.11%~65.34%),对照组受检者CVI为67.04%±2.46%(95%CI:66.19%~67.90%),见表2。
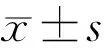
表2 DR组和对照组受检者各观察指标的比较
2.4 DR组患者各观察指标情况根据有无糖尿病性黄斑水肿(diabetic macular edeama,DME)[11]将DR组患者分为DME组和非DME组,根据DR分期[11]将DR组患者分为NPDR(非增殖性糖尿病视网膜病变)组和PDR(增殖性糖尿病视网膜病变)组,根据糖尿病病程将DR组患者分为病程≤10a组和病程>10a组,根据糖化血红蛋白的控制情况将DR组患者分为血糖控制良好组(糖化血红蛋白≤7.0%)和血糖控制不良组(糖化血红蛋白>7.0%),观察DR组各亚组患者各观察指标的情况。DME组和非DME组、病程>10a组和病程≤10a组患者SFCT差异均无统计学意义(P>0.05),CVI差异均有统计学意义(P<0.05),见表3、4。NPDR组和PDR组、血糖控制良好组和血糖控制不良组患者SFCT、CVI差异均无统计学意义(P>0.05),见表5、6。
那次唱歌是她主动提出来的,她忽然觉得胸闷,忽然讨厌起眼前的电脑,忽然想起那片苇湖。她无端地烦燥起来,她“啪”地把电脑关了,然后那只挪开电脑的手抛出一个弧线,她对汪小波说:“我们去唱歌吧!”本来“吧”字的后边是一个问号,冲出喉咙时变成了一种不容置疑。
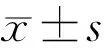
表3 DME组和非DME组患者各观察指标的比较
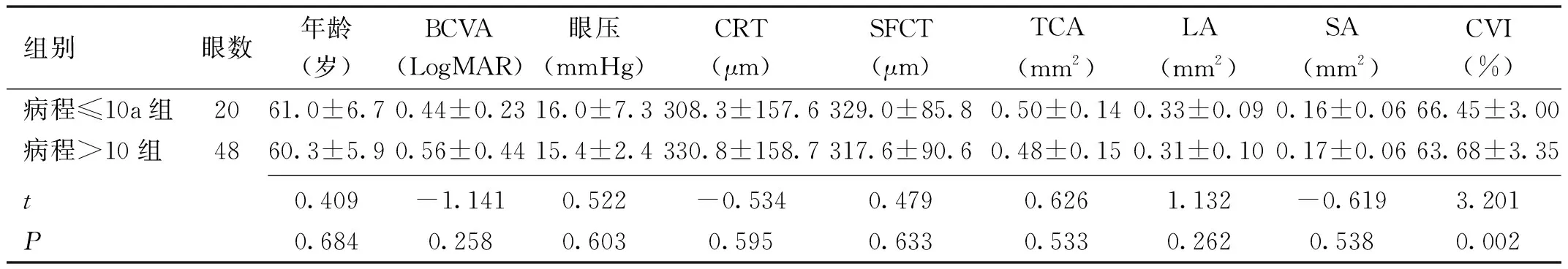
表4 病程≤10a组和病程>10a组患者各观察指标的比较
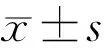
表5 NPDR组和PDR组患者各观察指标的比较
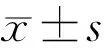
表6 血糖控制良好组和血糖控制不良组患者各观察指标的比较
2.5 CVI的诊断性评价结果将DR组和对照组受检者CVI检测结果应用MedCalc软件分析发现(图3),CVI的ROC曲线下面积(AUC)为0.732(95%CI:0.635~0.815,P<0.001),Youden指数为0.4118,特异度为100.00%,灵敏度为41.18%。DR组与对照组相比,CVI临界值为63.59%。

图3 CVI的ROC曲线分析结果。
3讨论
由于外层视网膜血供来自脉络膜,脉络膜血管的变化可能对DR造成影响[15]。早期通过固定剂固定、血管铸型及电镜扫描[2-5]等手段研究离体脉络膜结构,既往研究发现,糖尿病患者的脉络膜病变表现为脉络膜毛细血管丢失、血管管腔变细及动脉基底膜增厚、动脉硬化、血管细胞过度增殖、微血管瘤等改变[2-4]。超声多普勒血流检查发现,糖尿病患者眼动脉及睫状后动脉的血流减少,这种表现在NPDR患者和DME患者尤其明显[11,16];应用激光多普勒血流测量技术[17]对PDR患者研究发现,其黄斑中心凹下的脉络膜血管容积及血流均明显降低。随着OCT技术的进步,对活体脉络膜的研究不断完善。应用结构平面(en face)OCT[18]检查可以明确看到糖尿病患者黄斑区脉络膜Sattler层和Haller层大、中血管扭曲及减少。相干光层析血管成像术(optical coherence tomography angiography,OCTA)[5]检查发现,糖尿病患者的脉络膜毛细血管血流减少。OCTA和en face OCT技术评价的是脉络膜不同血管层的血流状态,而对脉络膜的全层切面的研究,目前主要依赖EDI-OCT[19]等技术的应用。
脉络膜厚度分析并不能明确糖尿病对脉络膜的影响。近年来,关于糖尿病患者脉络膜厚度的研究不断涌现。但是多数研究结果不一致[7-8,19-22]。研究发现,无论有无DR,糖尿病患者的脉络膜厚度均降低[19]。也有研究认为,在DR早期脉络膜厚度减少,随着病程进展,脉络膜厚度逐渐增加[7]。另有研究发现,糖尿病患者的脉络膜厚度增加,且不与DR分期相关[20]。有研究者对EDI-OCT的脉络膜区域以黄斑中心凹为中心进行鼻侧分区(N1~N5)和颞侧分区(T1~T5),发现在糖尿病患者及合并DME的患者中,黄斑中心凹鼻侧脉络膜厚度较健康人群明显变薄[19]。上述研究结论存在差异,分析可能与病例选择不同有关。本研究中,DR组与对照组受检者SFCT差异无统计学意义(P=0.135);进一步将DR组按照有无DME、DR分期、病程长短及血糖控制情况进行分组,发现各亚组间SFCT差异均无统计学意义(P>0.05)。基于上述情况可以得出,单纯对脉络膜厚度进行研究分析,并不能明确DR对脉络膜产生的影响。
Sonoda等[9]首次提出了对EDI-OCT检查中脉络膜图像的分析方法,并提出脉络膜血管面积比例的概念,即LA/TCA。之后有学者将这种研究方法推广到对健康人群[14,23-24]和糖尿病患者[23]的脉络膜研究中,并将LA/TCA称为CVI。CVI可同时描述脉络膜中血管及间质成分在病变发展过程中的相对变化,能更好地反映局部脉络膜的血流灌注等情况[23]。如果单纯测量SFCT,并不能说明SFCT的改变是由于血管的变化还是间质的变化,甚至是两者同时发生变化导致的[23]。基于健康人群的研究发现,SFCT同时受到年龄、眼内压、眼轴以及LA等因素的影响,而CVI仅与年龄、眼轴等因素相关,即年龄越大CVI数值越小,眼轴越长CVI数值越小,CVI较SFCT更加稳定[14,22-23]。综上,CVI相较于SFCT,可以更准确地描述复杂的脉络膜结构。本研究纳入受检者排除了高度近视、葡萄膜炎、包括年龄相关性黄斑变性在内的退行性视网膜病变、眼缺血综合征、恶性高血压[12]、妊娠[13]等眼部及全身可能影响脉络膜的疾病和状态。另外,关于中国成年人糖尿病的流行病学资料显示,糖尿病患病率随年龄升高,其中50~59岁人群的糖尿病患病率为17.6%,60~69岁人群为22.5%,且50~69岁人群基数庞大,是我国成年人糖尿病的主要患者群[24]。本研究中入选的受检者平均年龄约为60岁,既排除了70岁以上更高龄人群由于年龄影响导致的脉络膜血管改变对CVI的影响,也契合了我国成年人糖尿病的主要患者群[24]。今后应进一步研究不同年龄段糖尿病患者CVI的特点。
Hayreh[25]研究发现,脉络膜呈节段供血的特点,脉络膜的睫状后短动脉末梢不与其他血管发生吻合,而是作为终末动脉为脉络膜提供血供,其末端膨大呈小叶状,即为脉络膜毛细血管。脉络膜中涡静脉也呈节段性分布。而脉络膜毛细血管通常是黄斑中心凹唯一的营养来源[26]。众所周知,黄斑中心凹的解剖范围[26]即为以黄斑中心小凹为中心,直径1500μm的圆形区域。本研究并非参考Agrawal等[14]对EDI-OCT图像的全长脉络膜区域进行测算,而是选取黄斑中心凹下直径1500μm的脉络膜区域(鼻侧与颞侧各750μm),可以更好地反映黄斑中心凹处脉络膜的血供特点,继而与CRT、SFCT等黄斑中心凹相关数据的变化进行关联性研究。Kim等[27]研究发现,糖尿病患者PRP术后黄斑区下方脉络膜区域的血流、SFCT、LA、SA均较术前显著减少,岳静等[28]发现糖尿病患者PRP术后黄斑区及光斑区的脉络膜血流进行了重新分布。即使PRP术后1a的患者CVI较其他糖尿病患者也存在差异[29]。所以对于PRP术后的糖尿病患者,其CVI的变化尚需单独进行分析研究。故在本研究入组的糖尿病患者中并不包括PRP术后患者。本研究中,DR组与对照组相比,CVI的Youden指数为0.4118,其AUC为0.732,特异度为100.00%,灵敏度为41.18%,表明CVI对于研究2型糖尿病并发DR患者的脉络膜病变具有一定的临床应用价值。此外,本研究结果显示,DR组与对照组的CVI临界值为63.59%,这一结果与Tan等[23]和Kim等[27]研究结果相近,表明DR患者CVI的稳定性较高,CVI如果低于63.59%,提示可能已经发生了糖尿病相关的脉络膜病变。
本研究分析不同因素对DR患者CVI的影响发现,DR组患者左右眼之间CVI、眼压、BCVA等数据差异均无统计学意义。另外,应用Bland-Altman法分析两位测量人员对DR患者TCA、LA测量结果的一致性,发现结果具有很好的可重复性和一致性,表明本研究数据具有高度可靠性。本研究中对照组受检者CVI(67.04%±2.46%)与Tan等[23]研究中正常对照组的CVI(67.20%±0.16%)接近,DR组CVI(64.33%±3.25%)与Kara-Anne等研究中的糖尿病组(65.10%±0.20%)[24]相近,显示CVI有较高的稳定性。本研究中DR组CVI(64.33%±3.25%)与对照组(67.04%±2.46%)相比差异有统计学意义(t=3.824,P<0.001),提示DR患者脉络膜血管的血流较对照组有所减少,这与既往研究结果[2-5,23,30]基本一致。单纯测量脉络膜厚度的方法并不能发现糖尿病患者脉络膜的这种改变,表明通过EDI-OCT的无创性检查手段,并经过计算可以动态记录糖尿病患者疾病发展过程中的CVI数据变化,这可能有助于糖尿病脉络膜病变的动态研究。
本研究尚有很多局限与不足:(1)样本量较小,仍需扩大样本量来验证相关结论的正确性,如增加不同年龄人群的样本以比较不同年龄组糖尿病患者CVI的特点;增加未发生DR的早期糖尿病患者以研究早期糖尿病患者的脉络膜血流特点等;也可采用前瞻性研究方法,对糖尿病患者进行跟踪随访,明确其CVI等数据的动态变化特点。(2)本研究中关于EDI-OCT图像的部分数据不可避免地存在手动测算误差,在后面的研究中我们会进一步改进相关测算方法。(3)本研究对CVI的测算局限在黄斑区,可以进一步比较不同脉络膜区域的CVI测算结果的差异及其意义,从而进一步优化CVI的临床应用。此外,关于糖尿病患者CVI的测算还可以和OCTA中脉络膜各血管层的血管密度测算、脉络膜血流的激光多普勒血流测量技术[32]等进行对照研究,以期得到更加真实、准确的结果。
