18F-FDG PET/CT在评估肢体软组织肉瘤预后中的价值
2020-09-08马欢杨春梅周妮娜张岩杨志李囡
马欢,杨春梅,周妮娜,张岩,杨志,李囡*
1.北京大学肿瘤医院暨北京市肿瘤防治研究所核医学科,恶性肿瘤发病机制及转化研究教育部重点实验室,北京 100142;2.北京密云妇幼保健院病理科,北京 101500;*通讯作者 李囡 rainbow6283@sina.com
软组织肉瘤(soft tissue sarcoma,STS)是一类起源于间叶组织的恶性肿瘤,发病率低,约占成人恶性肿瘤的1%,占儿童恶性肿瘤的7%~15%[1]。约60%的STS 发生于四肢[2],称为肢体软组织肉瘤(extremity soft tissue sarcoma,ESTS)。18F-FDG PET/CT 在STS的诊断、局部及远处转移中具有重要的临床价值[3-4],但其在STS 分级及预后中的应用既往研究结论不一。本研究拟分析经病理证实的 ESTS 的18F-FDG PET/CT 影像特征,并进行随访,探讨其在ESTS 病理分级及预后中的价值。
1 资料与方法
1.1 研究对象 回顾性分析2009年12月—2018年12月于北京大学肿瘤医院核医学科行18F-FDG PET/CT 检查的ESTS 患者。纳入标准:①经手术或穿刺病理确诊为ESTS;②行18F-FDG PET/CT 检查前未接受任何治疗。排除标准:①既往有其他恶性肿瘤病史;②伴有活动性、可疑活动性或慢性不可控制的炎症或感染;③伴有心脏、肝脏或肾功能障碍;④伴有不可控的糖尿病;⑤妊娠期或哺乳期女性。
最终纳入52 例ESTS,中位年龄52(30,66)岁,依据FNCCLE 组织学分级[4],即根据肿瘤分化程度、有丝分裂象和坏死情况评分:2~3 分为G1(高分化),4~5 分为G2(中分化),6~8 分为G3(高分化),将纳入患者分为中低级别ESTS(G1 和G2)14 例、高级别ESTS(G3)38 例。根据WHO 2013 版软组织肿瘤分类[5],包括多形性未分化肉瘤9 例,恶性外周神经鞘瘤1 例,骨外骨肉瘤1 例,横纹肌肉瘤2 例,滑膜肉瘤5 例,肌成纤维细胞瘤1 例,间叶性软骨肉瘤1 例,平滑肌肉瘤2 例,上皮样肉瘤1 例,黏液性纤维肉瘤5 例,腺泡状软组织肉瘤4 例,尤文肉瘤5 例,脂肪肉瘤11 例,软组织透明细胞肉瘤1 例,归类不明软组织肉瘤3 例。
1.2 仪器与方法 采用Philips GeminiTF16 PET/CT 扫描仪,18F-FDG 由GE 公司回旋加速器生产,由自动化模块合成,放化纯度>95%。所有患者检查前均空腹6 h 以上,注射18F-FDG 前空腹血糖水平<10 mmol/L。患者静脉注射18F-FDG 3.0~3.7 MBq/kg,平静休息约60 min,排空膀胱后,行颅脑及躯干部18F-FDG PET/CT 图像采集,当下肢有或疑似有肿瘤时扫描范围扩大至足底。躯干部PET 采集9 个或10 个床位,1 min/床位;双下肢PET 采集8~11 个床位,30 s/床位;头部PET 采集1 个床位,7~10 min。采用有序子集最大迭代法重建PET 图像。投射扫描CT 配置参数:管电压120 kV,管电流100 mAs,层厚3 mm。利用CT 数据对PET 图像进行衰减校正。
1.3 图像分析 由2 名核医学主治以上医师共同阅片。采用EBW 工作站软件,利用平扫CT 进行解剖定位,分析PET 图像上18F-FDG 的分布及病灶浓聚情况,选择摄取最显著的层面,勾画感兴趣区,记录最大标准化摄取值(SUVmax)。观察病变部位、深度、平均径、密度、有无坏死、有无钙化、有无周围侵犯、有无淋巴结和(或)远处转移、SUVmax、SUVmax/病变平均径。其中病变深度分为浅层和深部,浅层指肿瘤位于深筋膜浅层且未侵犯深筋膜层;深部指肿瘤位于深筋膜深层、肿瘤位于深筋膜浅层但已侵犯深筋膜或肿瘤同时位于深筋膜浅层及深层。
1.4 预后评价指标 以无疾病进展生存(progression free survival,PFS)和总体生存(overall survival,OS)作为评价指标。PFS 定义为从疾病诊断到首次发现进展、复发或随访截止的时间。OS 定义为从疾病诊断到疾病相关死亡或随访截止的时间。对所有患者通过电话或复查进行随访。
1.5 统计学方法 采用SPSS 20.0 软件,病变部位、深度、密度、有无坏死、有无钙化、有无周围侵犯、有无淋巴结和(或)远处转移与病理分级的关系采用双变量相关分析。SUVmax、平均径、SUVmax/病变平均径与病理分级的关系采用独立样本t检验。对上述差异有统计学意义的指标进行受试者工作特征(ROC)曲线分析,比较其区分中低级别与高级别ESTS 的诊断准确性。采用Kaplan-Meier 法对相关预后因素进行单因素分析并绘制生存曲线。多因素分析采用Cox 比例风险回归模型。单因素分析时P<0.1 为差异有统计学意义,其余统计分析时P<0.05 为差异有统计学意义。
2 结果
2.1 临床特征 52 例ESTS 患者中,6 例发生周围侵犯,12 例发生淋巴结和(或)远处转移,其中6 例合并周围侵犯。在发生转移的患者中,转移至淋巴结7 例,转移至肺、骨、肝及肾上腺各4、5、1、2 例。ESTS 的典型PET/CT 图像见图1~3。
2.2 影响ESTS 病理分级的因素 中低级别与高级别ESTS 在病变密度、平均径、有无液化坏死、有无淋巴结和(或)远处转移方面差异有统计学意义(P<0.05),但在性别、年龄、病变部位、深度、有无钙化、有无周围侵犯、SUVmax、SUVmax/平均径方面差异均无统计学意义(P>0.05,表1、2)。
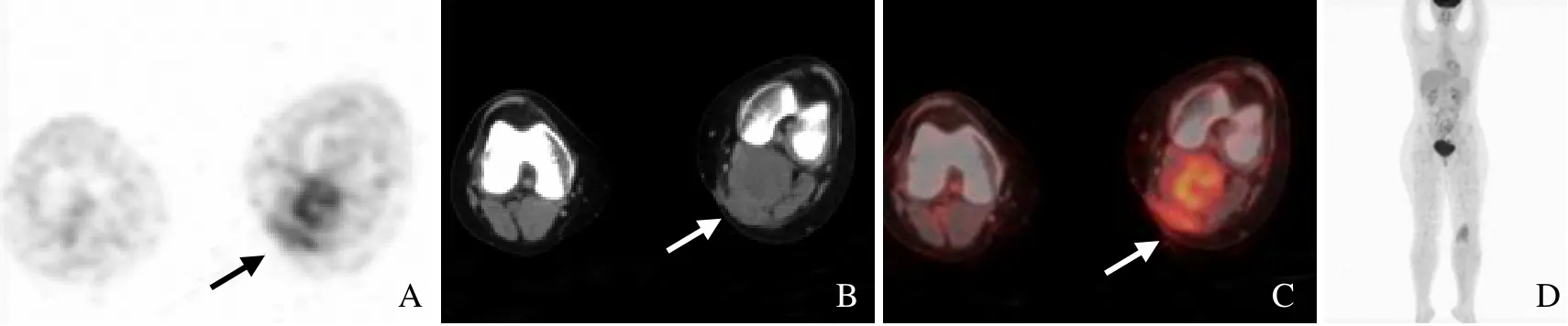
图1 女,17 岁,左腘窝肌成纤维细胞瘤G1。PET 示左腘窝FDG 摄取增高,SUVmax 4.38(箭,A);CT 示左侧腓肠肌内侧头明显增粗,其后方见软组织影,两者分界不清(箭,B);融合图像示左腘窝肌肉FDG 摄取增高(箭,C);最小密度投影示无淋巴结及远处转移(D)
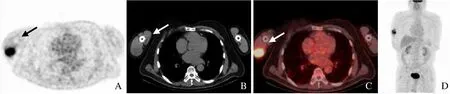
图2 男,68 岁,右上臂黏液性纤维肉瘤G2。PET 示右上臂FDG 摄取增高,SUVmax 17.75(箭,A);CT 示右上臂肱三头肌内梭形低密度影(箭,B);融合图像示右上臂肌肉FDG 摄取增高(箭,C);最小密度投影示无淋巴结及远处转移(D)
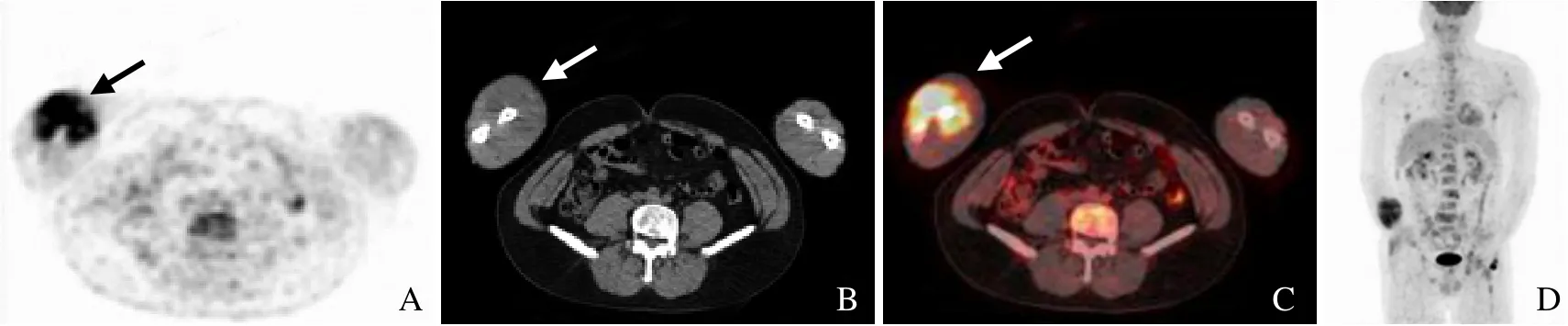
图3 男,47 岁,右前臂尤文肉瘤G3。PET 示右前臂FDG 摄取增高,SUVmax 11.7(箭,A);CT 示右前臂肌肉内稍低密度软组织肿块(箭,B);融合图像示右前臂肌肉FDG 摄取增高(箭,C);最小密度投影示右腋窝淋巴结转移,多发骨、肝及肺转移

表1 影响ESTS 病理分级的因素(例)
表2 不同级别ESTS 病变平均径及代谢参数比较(±s)

表2 不同级别ESTS 病变平均径及代谢参数比较(±s)
注:ESTS 为肢体软组织肉瘤,SUVmax 为最大标准化摄取值
分组例SUVmax 病变平均SUVmax/病数径(cm)变平均径中低级别组 14 8.71±10.86 10.28±3.82 1.05±1.38 1.89±1.54 t 值 -0.241 3.342 -1.802高级别组38 9.26±5.60 6.48±3.57 P 值>0.05<0.05>0.05
2.3 判断ESTS 分级的准确性 对上述差异具有统计学意义的指标病变密度、平均径、有无液化坏死、有无淋巴结和(或)远处转移进行ROC 曲线分析,发现诊断准确性最高的指标是病变平均径,ROC 曲线下面积为0.791,临界值是5.73 cm,敏感度为100.0%,特异度为53.6%;其次是有无液化坏死、有无淋巴结和(或)远处转移、病变密度,ROC 曲线下面积分别为0.714、0.658、0.648,敏感度分别为92.9%、100.0%和42.9%,特异度分别为50.0%、31.6%和86.8%(图4)。
2.4 影响患者OS 及PFS 的因素分析 52 例患者随访至2019年12月4日,11 例失访,其余41 例患者年龄56.0(36.5,66.5)岁,病变平均径(7.26±0.65)cm,SUVmax 为7.47(4.44,11.27),随访时间20(14,41)个月。9 例患者远处转移后死亡,32 例存活,其中11 例进展(1 例局部复发、10 例远处转移)。随访的41 例患者治疗情况:单纯手术8 例,单纯化疗3 例,手术+化疗和(或)放疗28 例,放弃治疗2 例。

图4 不同指标判断ESTS 病理分级准确性的ROC 曲线
单因素分析结果显示,SUVmax、有无淋巴结和(或)远处转移与OS 相关(P<0.1),其他指标与OS均无相关性(P>0.1);SUVmax、深度与PFS 相关(P<0.1),其他指标与PFS 均无相关性(P>0.1),见表3。
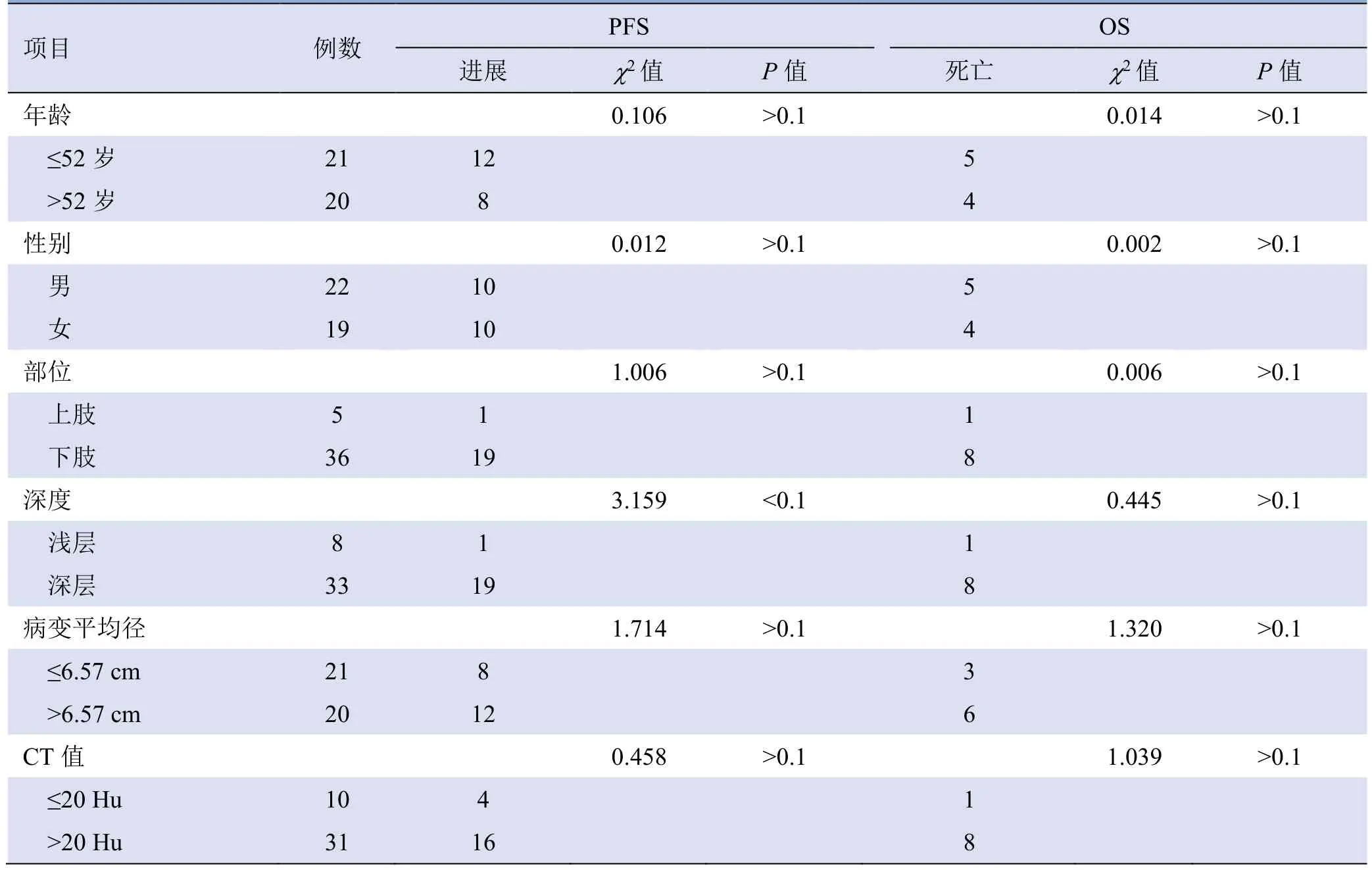
表3 ESTS 患者PFS 及OS 单因素分析结果(例)
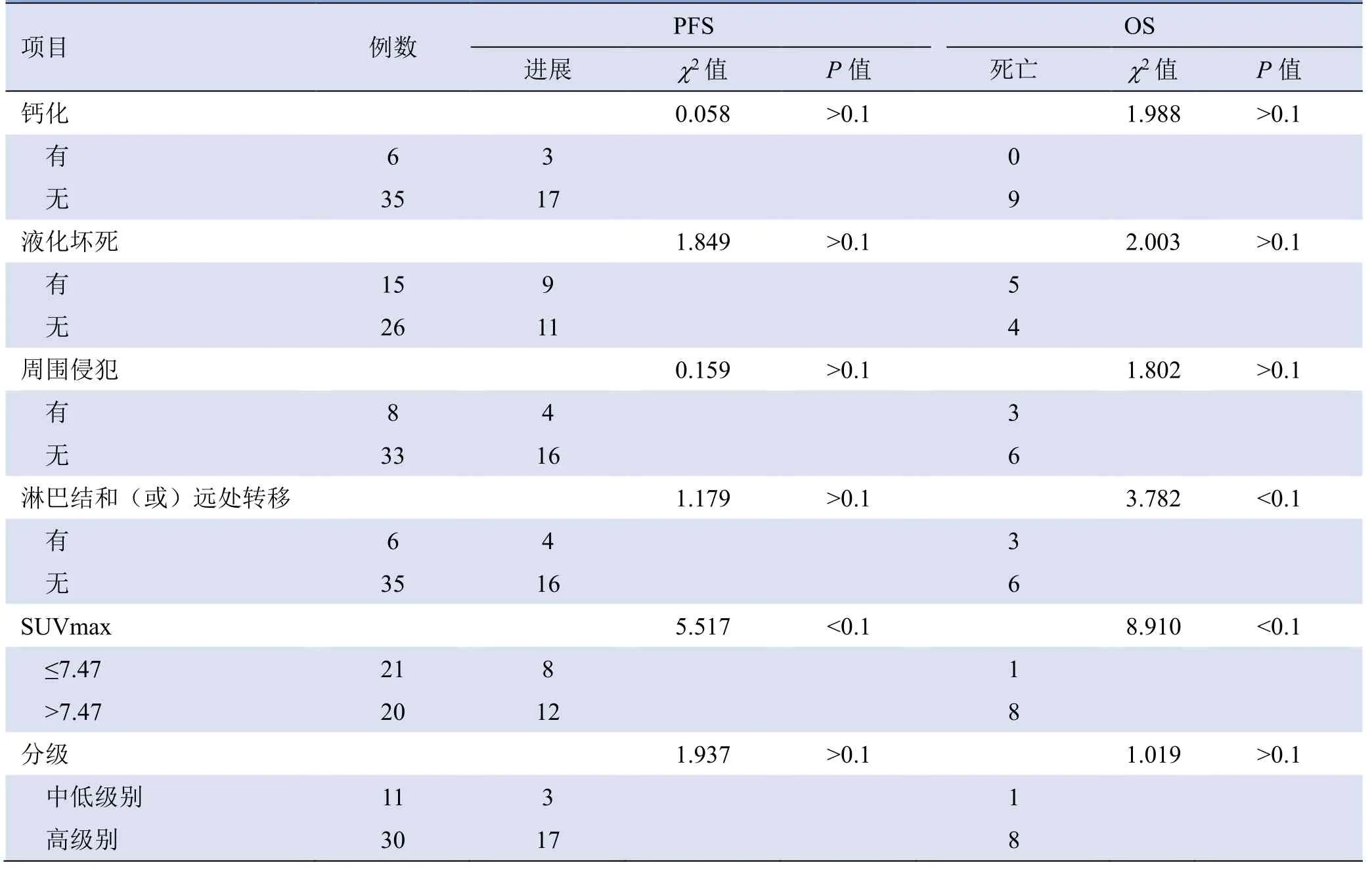
续表3
将SUVmax、深度、有无淋巴结和(或)远处转移进行多因素Cox 回归分析,结果显示仅SUVmax 是影响患者OS 及PFS 的独立危险因素(P均<0.05),SUVmax>7.47 的患者疾病进展、死亡风险均高于SUVmax≤7.47 者,HR 分别为3.05(95%CI1.15~8.11)、12.39(95%CI1.52~100.65)(图5)。

图5 ESTS 患者原发灶SUVmax>7.47 与SUVmax≤7.47 患者PFS(A)和OS(B)的Kaplan-Meier 生存曲线
3 讨论
不同级别的STS 临床治疗方案不同,而病理学诊断是分级的“金标准”。目前手术前的病理学分级主要通过活检获得,但其结果受取材部位及组织成分影响,无法做到评估准确全面,具有局限性,而手术切除后所得病理结果难以指导术前治疗。因此,寻找术前准确判断STS 分级的方法具有重要意义。
目前关于18F-FDG PET/CT 影像特征判断STS 分级的报道大多集中于SUVmax 方面,且结果不一,多数研究报道SUVmax 在STS 分级中无特殊作用[6-7],但也有研究显示SUVmax 可以区分组织学分级[8]。本研究中,高级别组与中低级别组ESTS 患者平均SUVmax 分别为9.26±5.60、8.71±10.86,两者差异无统计学意义,故不能仅凭病变SUVmax 高低区分STS的组织学分级,仅可作为组织学分级的补充。SUVmax对分级判断研究结果不一的原因可能与地域、人种差异及病理学分级中存在一定的人为因素等有关。
本研究对ESTS 患者18F-FDG PET/CT 中解剖成像(CT 图像)的各指标与分级的关系进行研究发现,对区分中低级别与高级别肉瘤具有诊断意义的指标为病变平均径、有无液化坏死、有无淋巴结和(或)远处转移、密度,病变平均径相对小、密度较实、伴液化坏死及淋巴结和(或)远处转移的肉瘤,其组织学级别较高。因为小病灶即伴液化坏死、淋巴结和(或)远处转移,提示病变的生物学行为差,恶性程度高。而病变平均径相对较大、以脂肪或囊性成分为主,不伴坏死且病变局限的肉瘤,其生物学行为较好,恶性程度低。本研究中肿瘤病变部位、深度、平均径、有无钙化、有无周围侵犯等指标对分级无明确指导意义,既往鲜有相关报道。
上述有诊断意义的4 项指标病变平均径、有无液化坏死、有无淋巴结和(或)远处转移、密度的ROC曲线下面积分别为0.791、0.714、0.658 和0.648,并未达到理想的诊断水准。MRI 具有良好的软组织分辨力,是STS 的首选影像学检查方法,能提供包括肿瘤边界、瘤内出血及瘤周水肿等信息[9],随着PET/MRI的应用,不同序列的MRI 与代谢的融合显像,相信可以为ESTS 的临床治疗提供更多有价值的信息。
在ESTS 预后评估方面,目前尚无公认、重复性高的评估系统。一般认为年龄、病变深度、大小、分级、病变亚型、治疗前有远处转移是预后影响因素[10-12]。但也有少数研究并不支持[13-14],关于性别与预后的关系,研究结果不一[15-16]。张路等[15]分析了105 例Ⅱ~Ⅲ期ESTS 术后患者,发现年龄、性别、肿瘤部位、复发性肿瘤、组织学亚型、分期、单纯化疗、单纯放疗与预后无关,而肿瘤大小和组织学分级是影响预后的独立因素。冯震等[17]分析了70 例ESTS 患者,发现局部复发和远处转移与病理分级及分期相关,而与年龄、性别、肿瘤大小、肿瘤部位及深度无关。钙化与预后的相关性目前鲜有报道。
关于18F-FDG PET/CT 评估预后的研究主要集中于SUVmax,一致认为SUVmax 是预后影响因子[18-19],Sambri 等[18]纳入50 例成人ESTS,以SUVmax 10.3为界值, SUVmax<10.3 者预后明显好于SUVmax>10.3 者。本研究诸多指标中,SUVmax、深度、有无淋巴结和(或)远处转移与PFS 和(或)OS相关(P<0.1),但经多因素分析仅SUVmax 是影响患者预后的独立因素,SUVmax>7.47 者疾病进展、死亡风险高于SUVmax≤7.47 者,与既往研究结果相符,进一步证实SUVmax 是反映肿瘤活性的可靠指标,可帮助临床评估患者的预后。
本研究中,性别、年龄、病变部位、深度、平均径、密度、有无液化坏死、有无周围侵犯、有无淋巴结和(或)远处转移等均不是预后的独立影响因素,与既往研究不完全相同,可能与以下原因有关:①本研究样本量较小,治疗个体化差异大,且本研究纳入病例以成人为主,缺乏儿童病例;②纳入标准不一,既往大部分报道的研究对象是特定分期或特定病理级别或特定治疗模式的患者,而由于本研究样本量小,未行进一步分组研究;③中位随访时间较短(20 个月),影响了总生存期相关预后因素的分析。
STS 发病率低,可发生于各年龄段,包括70 多种病理亚型,且各亚型均有各自的临床特点[20],由于患者临床个体化差异大,缺少治疗的详实信息,在今后的工作中需进一步扩大样本量,延长随访时间,并分析各病理亚型、治疗模式与分级及预后的关系,以期获得更有说服力的结果。
