丹参酮ⅡA联合三氧化二砷对人白血病细胞株NB4体外凋亡、自噬的影响及其机制
2020-09-07王叨张永卓陈娇游红亮丁艳杰魏林林徐岩刘玉峰
王叨,张永卓,陈娇,游红亮,丁艳杰,魏林林,徐岩,刘玉峰
(1.郑州大学第一附属医院 儿内科,河南 郑州 450052;2.濮阳市人民医院 儿内科,河南 濮阳 457000)
丹参酮ⅡA(tanshinone ⅡA,Tan ⅡA)是从丹参中分离出的二萜醌类化合物,临床主要用来治疗心血管疾病和缺血性脑卒中。近年来研究发现,Tan ⅡA不仅对多种肿瘤细胞有抗增殖活性,还可协同增强多种化疗药物的抗肿瘤活性[1-4],但其作用的具体分子机制尚不十分清楚。本研究以人急性早幼粒细胞白血病细胞株NB4为研究对象,拟从细胞凋亡和自噬角度,探讨Tan ⅡA联合三氧化二砷(arsenic trioxide,ATO)体外对白血病细胞增殖的影响及其可能的分子机制,为临床采用Tan ⅡA辅助治疗白血病提供基础实验依据。
1 材料与方法
1.1 材料所用NB4细胞来自郑州大学第一附属医院细胞室,Tan ⅡA来自中国药品生物制品检定所,流式细胞仪来自美国Becton Dickinson公司,1 g·L-1亚砷酸注射液来自哈尔滨伊达制药厂,CCK-8试剂盒来自日本Dojindo公司,Annexin V-FITC/PI Apoptosis Detection Kit来自南京凯基生物科技有限公司,单丹磺酰尸胺(monodansylcadaverin,MDC)来自美国Sigma公司,兔抗人Beclin 1抗体、兔抗人微管相关蛋白1轻链3(LC3)-Ⅱ抗体、鼠抗人actin抗体、小鼠抗人半胱天冬酶-3(Caspase-3)抗体均来自美国Sigma公司,BCA蛋白检测试剂盒来自上海碧云天生物技术有限公司。本研究经郑州大学第一附属医院医学伦理委员会审批通过。
1.2 实验方法
1.2.1细胞培养及分组 NB4细胞接种于含体积分数10%的胎牛血清、105U·L-1青霉素、100 mg·L-1链霉素的RPMI 1640培养基常规传代培养。取对数生长期细胞进行实验,共分6组:4、8、16 mg·L-1Tan ⅡA组,0.5 mg·L-1ATO组,8 mg·L-1Tan ⅡA+0.5 mg·L-1ATO组,对照组加入9 g·L-1生理盐水。
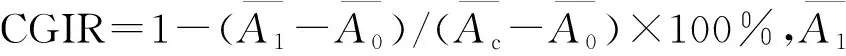
1.2.3流式细胞术(flow cytometry,FCM)检测细胞凋亡率 收集药物处理48 h后的细胞1×106个,磷酸缓冲盐溶液(phosphate buffer saline,PBS)洗涤后,重悬于500 L缓冲液,分别加入5 L Annexin-V-FITC、5 L碘化丙啶(propidium iodide,PI),混匀,室温避光15 min,PBS洗涤后上机检测。
1.2.4FCM法检测细胞自噬小体率 收集药物处理48 h后的细胞1×106个,PBS洗涤后,重悬于500 L缓冲液,加入0.05 mmol·L-1的MDC染液100 L,混匀,室温避光15 min,PBS洗后上机检测。
1.2.5蛋白质印迹法检测Caspase-3、Beclin-1、LC3-Ⅱ 收集药物处理48 h后的各组细胞,加入细胞裂解液,混匀后冰上裂解40 min,离心收集上清液,BCA法检测蛋白浓度。以50 g总蛋白进行SDS-PAGE后转膜至PVDF膜,50 g·L-1脱脂牛奶室温封闭2 h,一抗4 ℃孵育过夜,次日洗涤后加入相应二抗孵育2 h,洗涤后进行X线胶片显影。

2 结果
2.1 细胞增殖活力MTT法检测结果显示,随着Tan ⅡA作用时间的延长和质量浓度的增加,NB4细胞增殖抑制率呈上升趋势,差异有统计学意义(F=65.093,P=0.023),说明Tan ⅡA对NB4细胞增殖有抑制作用,且呈一定的剂量和时间依赖性。在同一时间点上,联合用药组细胞的增殖抑制率大于同剂量单药组(均P<0.05)。见表1。
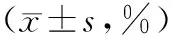
表1 MTT法检测各组NB4细胞增殖抑制率
2.2 NB4细胞凋亡率药物作用48 h后,8 mg·L-1Tan ⅡA组、0.5 mg·L-1ATO组细胞凋亡率分别为(11.28±3.32)%、(32.69±5.60)%,均高于对照组的(2.81±0.93)%,差异有统计学意义(t1=4.253,P1=0.025;t2=9.110,P2=0.001)。联合组(8 mg·L-1Tan ⅡA+0.5 mg·L-1ATO)细胞凋亡率为(44.02±6.47)%,高于单药组(t1=8.235,P1=0.027;t2=13.790,P2=0.005)。见图1。
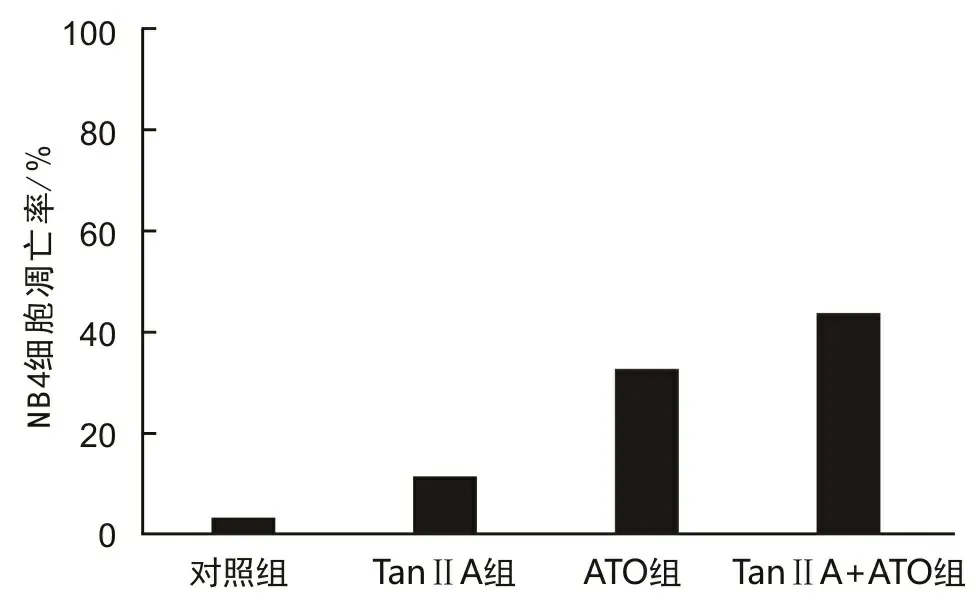
图1 Tan ⅡA、ATO对NB4细胞凋亡的影响
2.3 NB4细胞自噬小体率药物作用48 h后,8 mg·L-1Tan ⅡA组、0.5 mg·L-1ATO组细胞的自噬小体率分别为(18.42±7.63)%、(34.36±7.60)%,均高于对照组的(5.07±1.62)%,差异有统计学意义(t1=7.953,P1=0.006;t2=6.773,P2=0.004)。联合组(8 mg·L-1Tan ⅡA+0.5 mg·L-1ATO)细胞自噬小体率为(53.26±7.39)%,高于单药组(t1=6.367,P1=0.001;t2=9.471,P2=0.037)。见图2。
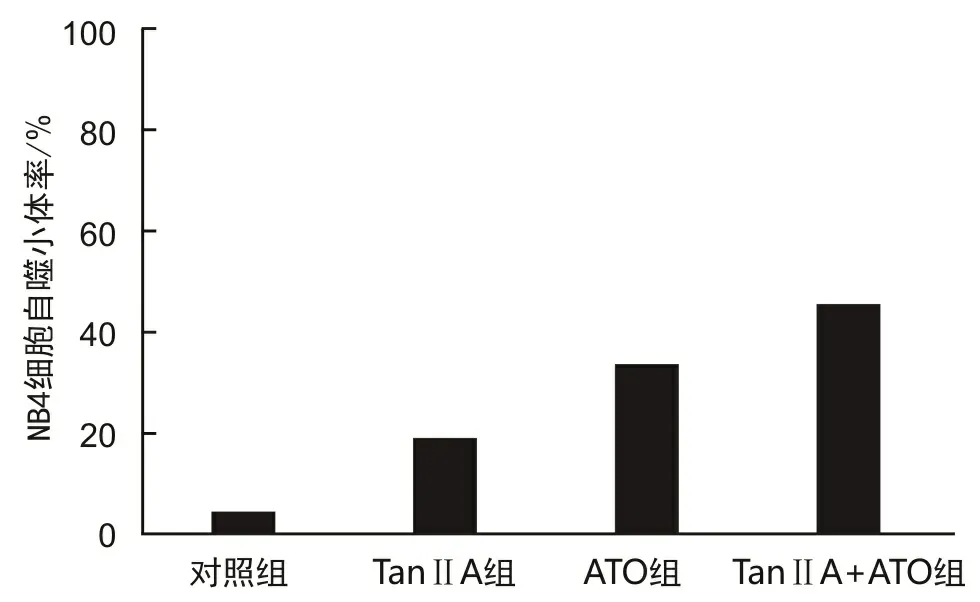
图2 Tan ⅡA、ATO对NB4细胞自噬的影响
2.4 凋亡特异蛋白Caspase-3表达水平蛋白质印迹法检测结果显示,药物处理48 h后,8 mg·L-1Tan ⅡA组、0.5 mg·L-1ATO组的NB4细胞内Caspase-3相对表达量较对照组高(t1=8.030,P1=0.003;t2=12.246,P2=0.002)。两药联合组(8 mg·L-1Tan ⅡA+0.5 mg·L-1ATO)细胞内Caspase-3相对表达量高于8 mg·L-1Tan ⅡA组和0.5 mg·L-1ATO组(t1=19.575,P1=0.005;t2=4.067,P2=0.036)。见图3。
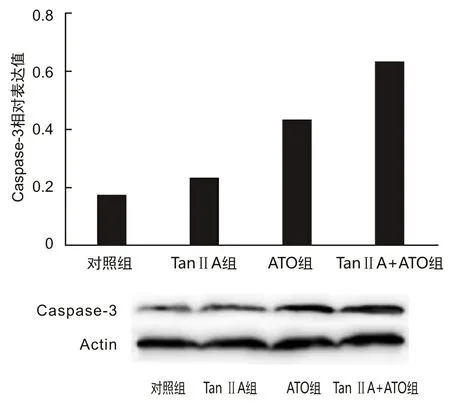
图3 Tan ⅡA、ATO对NB4细胞内Caspase-3表达的影响
2.5 自噬相关蛋白Beclin-1、LC3-Ⅱ表达水平蛋白质印迹法检测结果显示,药物处理48 h后,8 mg·L-1Tan ⅡA组、0.5 mg·L-1ATO组NB4细胞内蛋白Beclin-1和LC3-Ⅱ的相对表达量均高于对照组(t1=3.761,P1=0.039;t2=6.840,P2=0.001)。两药联合组NB4细胞内Beclin-1和LC3-Ⅱ的相对表达量高于8 mg·L-1Tan ⅡA组、0.5 mg·L-1ATO组(t1=9.423,P1=0.003;t2=7.568,P2=0.013)。见图4。
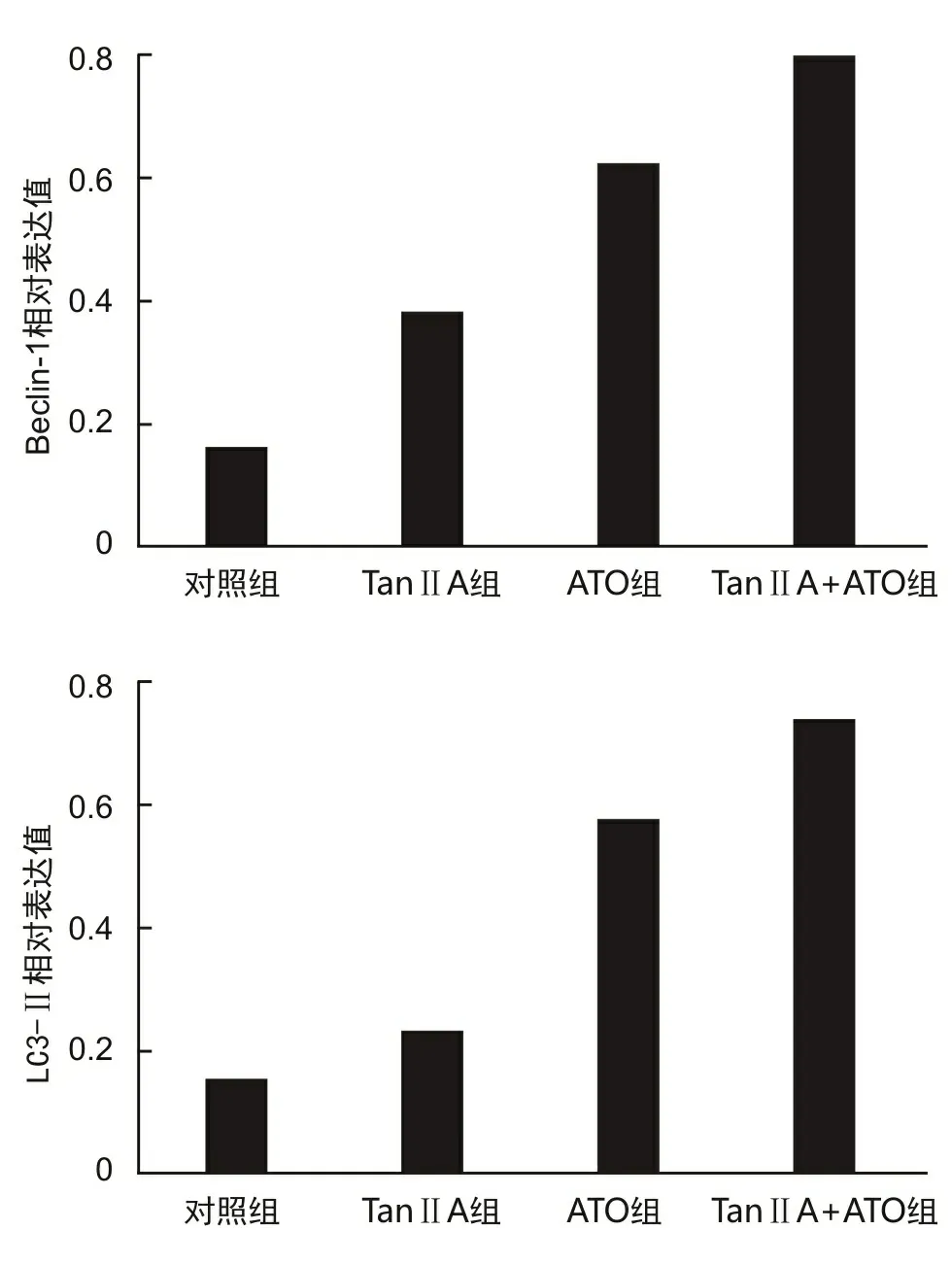
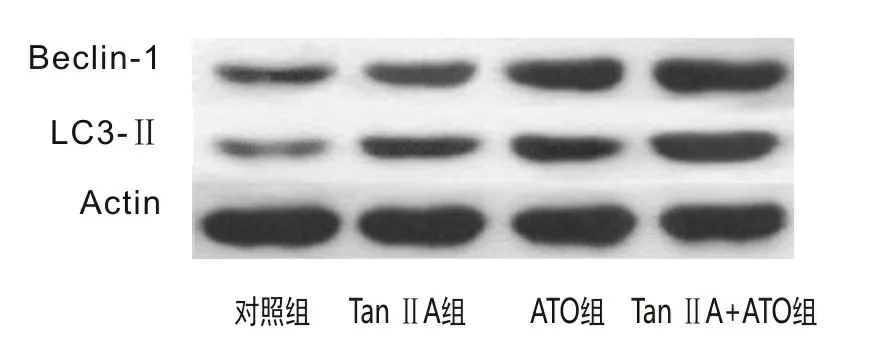
图4 NB4细胞内自噬特异性蛋白Beclin-1、LC3-Ⅱ的相对表达量
3 讨论
本实验以3种不同质量浓度的Tan ⅡA与急性早幼粒白血病NB4细胞共同培养, MTT检测结果显示,随着药物质量浓度的提高和作用时间的延长,NB4细胞活力呈下降趋势,表明本实验质量浓度范围内的Tan ⅡA对NB4细胞增殖有抑制作用,且呈一定的时间和剂量相关性。Tan ⅡA联合ATO组NB4细胞的增殖抑制率大于单药组,与部分文献报道[5-7]一致,表明Tan ⅡA可协同增强ATO的抗白血病细胞增殖活性,提示Tan ⅡA可作为增强ATO化疗效果的辅助药物,但其具体分子作用机制和作用靶点尚不完全清楚。
自噬和凋亡是两种主要的细胞程序性死亡方式,虽然生化代谢途径及形态学存在差异,但功能密切联系,共同调控细胞生存和死亡[8],因而成为多种抗肿瘤药物的作用靶点。本研究团队推测Tan ⅡA对ATO抗白血病化疗的增敏作用机制可能与凋亡和自噬有关。
Tan ⅡA和ATO处理NB4细胞48 h后,经FCM检测发现,Tan ⅡA、ATO单药均可诱导NB4细胞凋亡,两药联合组细胞凋亡率大于单药组,提示促进细胞凋亡是Tan ⅡA协同ATO抗白血病的作用机制之一。Caspase-3是Caspase家族蛋白中凋亡效应蛋白酶,是凋亡的终末执行器[9]。本研究蛋白质印迹法检测结果显示,Tan ⅡA和ATO联合用药组细胞Caspase-3表达量高于单药组和对照组,提示上调Caspase-3表达是Tan ⅡA协同ATO诱导NB4细胞凋亡的分子机制之一。
自噬是细胞利用溶酶体降解自身受损的细胞器和大分子物质的过程,对细胞的存活和死亡起着举足轻重的作用。自噬既可以作为一种防御机制清除细胞质内受损的细胞器和大分子物质,保护受损的细胞,同时还可作为一种Ⅱ型程序性死亡方式诱导细胞主动性死亡[10-11],即自噬性细胞死亡。在自噬过程中,自噬溶酶小体的形成是关键[12]。本研究经FCM检测发现,Tan ⅡA可协同增强ATO诱发的细胞自噬活性。因此,本研究团队认为Tan ⅡA协同ATO抗白血病化疗增敏机制也与增强NB4细胞自噬活性、诱发细胞自噬性死亡有关。
自噬是一个受基因严格调控的程序性过程,涉及一系列自噬相关蛋白,其中的核心自噬特异蛋白包括Beclin-1、LC3。Beclin-1可与Barkor/Atg14(L)、hVps15、Class Ⅲ PI3K/hVps34相互结合组成一个特异性PI3K复合物[13-15],调控自噬前体和自噬体的形成和成熟。自噬启动后,LC3被裂解为LC3-Ⅱ,后者与自噬泡膜表面的磷脂酰乙醇胺(phosphatidyl ethanolamine,PE)共价结合形成脂化的LC3-Ⅱ-PE复合物[14],参与自噬泡和自噬小体内外膜的延伸,其水平的高低可反映细胞自噬水平。本研究通过蛋白质印迹法检测发现,Tan ⅡA和ATO联合用药组NB4细胞内的自噬特异蛋白Beclin-1和LC3-Ⅱ的相对表达量高于单药组和对照组,说明Tan ⅡA协同ATO增强NB4细胞自噬活性的机制与其促进自噬特异蛋白Beclin-1、LC3-Ⅱ高表达有关。有研究报道Tan ⅡA可诱导人口腔鳞状细胞癌SCC-9细胞自噬性死亡并伴有Beclin-1、LC3-Ⅱ蛋白的高表达[16]。结合文献报道,本研究团队认为Tan ⅡA可协同ATO促进Beclin-1、LC3-Ⅱ高表达,增强NB4细胞自噬活性,诱导自噬性死亡,从而发挥化疗增敏效果。
本实验证实,Tan ⅡA在体外有抑制人急性早幼粒白血病NB4细胞株增殖的作用,并对ATO有化疗增敏作用,其机制可能与上调自噬特异性蛋白Beclin-1、LC3-Ⅱ及凋亡特异性蛋白Caspase-3的表达有关,通过诱导自噬性死亡和凋亡共同促进细胞死亡,但具体的分子机制和调控机制仍有待进一步研究阐明。Tan ⅡA有望成为一种有前途的、高效低毒的抗肿瘤增敏药物,为白血病的治疗提供新的策略。
