罕见遗传代谢病乙基丙二酸脑病1例及文献复习
2020-09-07郝会民卫海燕
郝会民,卫海燕
[郑州大学附属儿童医院(河南省儿童医院,郑州儿童医院) 内分泌遗传代谢科,河南 郑州 450000]
乙基丙二酸脑病是一种罕见的遗传代谢病,为常染色体隐性遗传,于1991 年BURLINA 等[1]首次对其进行了描述,直到2004 年TIRANTI 等[2]确定了相关基因ETHE1。我国则于2008 年首次报道1 例伴有听神经损害的儿童乙基丙二酸尿症[3],于2009 年该基因功能得以验证,该病除少数例外,多发生在地中海或阿拉伯地区[4],截至目前为止仅 100 余例报道[5]。
乙基丙二酸脑病临床表现较相似,典型临床表现主要为顽固性腹泻、运动发育迟滞、智力落后、皮肤瘀点瘀斑、直立性手足发绀及大脑损害等症状,发病晚期则为严重的精神运动迟缓伴痉挛性四肢瘫痪,并可伴有并发疾病的昏迷发作,罕见的中枢神经系统畸形,关节过度松弛、屈曲性视网膜血管扩张和肾小球肾炎急性坏死。生化特征为乙基丙二酸升高,丁酰肉碱、异戊酰肉碱增高,头颅MRI:双侧基底节对称性异常信号,脑干坏死性病变类似于线粒体脑病。该病病死率极高,多于1 岁以内甚至半岁以内发病,然后临床进行性恶化,2 岁以内多因代谢紊乱死亡,据统计死亡年龄一般在1 岁半至3 岁之间[6]。由于本病无特效治疗方法,到目前为止,国内甚至国外报道病例少有存活,本研究通过报道1 例筛查为乙基丙二酸脑病患儿因延误诊治在病程中逐步出现的不同临床表现,从而让临床医生能更加深入认识该病,同时查阅国内外相关文献,了解目前国外针对乙基丙二酸脑病诊治现状,以期提高对该病的诊治水平。本研究经伦理审查委员会审查批准,患儿父母签署知情同意书。
1 临床资料
患儿,男,行新生儿筛查提示乙基丙二酸尿症,建议复查,家长未予重视。出生后1 个月出现顽固性腹泻,7~8 次/日,为稀糊或稀水样便,体重增长缓慢,并伴有运动智力发育落后。出生后4 个月时复查血氨基酸和酰基肉碱谱显示丁酰肉碱、异戊酰肉碱增高;尿气相色谱质谱有机酸示乙基丙二酸-2 增高;头颅CT 示两侧小脑白质对称性密度减低,两侧大脑脑白质密度略低。进一步行基因检查示ETHE1 基因c.295C>T 位点纯合突变,确诊为乙基丙二酸脑病。建议予以免乳糖饮食,同时口服左卡尼汀口服液0.5 g/d、维生素B1片30 mg/d、维生素B12 片10 mg/d、辅酶Q10 20 mg、叶酸片5 mg/d 进行治疗,但家长未给予免乳糖饮食,仅口服药物1 个月,在腹泻症状好转、智力运动发育较之前有所好转后自行停药。出生后6 个月患儿面部开始出现散在出血点,逐渐全身出现大量出血点、大片瘀斑,腹泻加重,智力运动发育倒退,建议择期行肝移植手术,实际未予进行。
患儿本次因呕吐、腹泻4 d,发热、嗜睡3 d入院就诊,年龄为1 岁4 个月。患儿为第一胎第一产,足月剖宫产,孕38 周,出生体重2.7 kg,生后母乳喂养,6 月添加辅食,6 月会抬头;现不会独坐,不会爬,不会独站,不会走,不会说话,现运动、智力发育落后于同龄儿。患儿父母均身体健康,无遗传或先天性疾病史。患儿入院时体温 36.7℃,脉搏 135 次/min,呼吸 33 次/min,血压 119/82 mmHg (1 mmHg=0.133 kPa),血氧饱和度(SPO2) 90%,体重 9 kg,头围 44 cm,身长76.5 cm,神志清醒。全身皮肤苍白,可见大量“ 米粒样” 瘀点, 左上肢可见大片瘀斑, 约10 cm×10 cm,颈软,呼吸稍促,双肺呼吸音粗,心音有力,腹软,肝右肋下2 cm,质软,脾肋下未触及。四肢肌力正常,肌张力低,四肢末梢凉,毛细血管充盈时间3 s。实验室检查:血气分析示酸碱度7.38,碱剩余-15.3 mmol/L (正常值为-3~3 mmol/L), 乳酸 3.1 mmol/L (正常值为 0.5~2.2 mmol/L),电解质:钾2.65 mmol/L (正常值为3.5~5.5 mmol/L);血尿常规大致正常,凝血时间正常,免疫球蛋白、淋巴细胞亚群正常,乙肝六项、感染四项均为阴性,呼吸道病原学示柯萨奇病毒抗体-IgM 阳性(+),细菌毒素、淀粉酶正常;粪便轮状病毒阳性(+);甲状腺激素正常,腹部彩超、心脏彩超未见明显异常。复查血氨基酸和酰基肉碱谱示丁酰肉碱1.79 μmol/L (正常值为0.05~0.60 μmol/L) 升高,尿气相色谱质谱有机酸结果分析示:①乙基丙二酸47.8 μmol/L (正常值为0.0~7.0 μmol/L),②乳酸,2-羟基丁酸,3-羟基丙酸、丙酮酸、3-羟基丁酸、3-羟基异丁酸增高,提示酮尿。入院后给予无乳糖饮食,补充中链脂肪酸的特殊配方奶粉(小百肽),补充高糖液体、静脉滴注左卡尼汀注射液100 mg/(kg·d)及口服甲钴胺片0.5 mg,1 次/d,维生素 B1 片 10 mg,3 次/d,维生素 B2 片 10 mg,1 次/d,辅酶 Q10 10 mg,2 次/d,叶酸片 5 mg,1 次/d,维生素 AD 2 000IU,1 次/d,N-乙酰半胱氨酸300 mg,2 次/d。治疗后患儿精神好转,腹泻好转,皮肤瘀点瘀斑较治疗前有所消退。见图1-2。
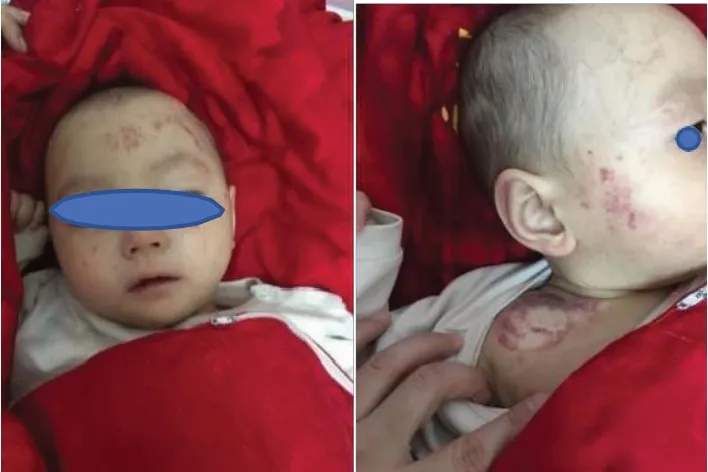
图1 治疗前
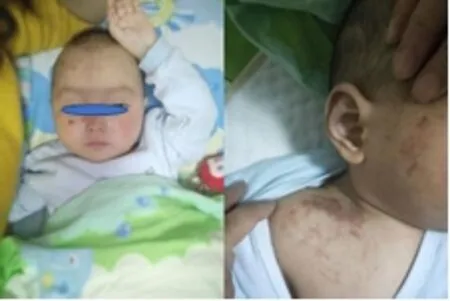
图2 治疗后
患儿病情稳定2 d 后突然出现叹气样呼吸,面部及四肢末端发绀。查体:体温36.5℃,脉搏152 次/min,呼吸 40 次/min,血压 111/75 mmHg,复苏囊加压给氧下SPO280%,浅昏迷,反应差,全身皮肤苍白,再次出现大量散在瘀点及瘀斑且部分融合成片,以面部、右上肢、右下肢上部较为明显,面色苍黄,双侧瞳孔对光反射迟钝,口唇干裂,口周发绀,颈软,呼吸促,呼吸节律不规则,叹气样呼吸,双肺呼吸音粗,心音尚有力,腹软,肝右肋下2 cm,质软,脾肋下未触及。肠鸣音存在,四肢肌力、肌张力低,布氏征阴性,双侧巴氏征、克氏征阴性,四肢末梢凉,有发绀,毛细血管充盈时间大于3 s,遂转入儿科重症监护病房(PICU)进一步抢救治疗。行机械通气,呼吸模式:压力控制;呼吸参数:呼吸频率35 次/min,吸气末正压23 cmH2O,呼气末正压5 cmH2O,吸气上升时间0.61 s,吸入氧浓度40%。同时复测血气分析示酸碱度7.10,碳酸氢根4.8 mmol/L,实际碱 剩 余 -22.7 mmol/L, 糖 22.1 mmol/L, 乳 酸8.7 mmol/L,钠131 mmol/L,给予补碱纠酸、补充高糖液体等对症支持治疗,效果较差,患儿出现顽固性代谢酸中毒且逐渐加重,乳酸持续升高。复查血气分析示酸碱度6.95,碳酸氢根7.6 mmol/L,实际碱剩余-22.1 mmol/L,乳酸21 mmol/L,末梢循环差,心率、血压逐渐下降,持续血管活性药物应用,血压、心率不能维持,无咳嗽反射,无自主呼吸,最终家长放弃治疗。
2 讨论
乙基丙二酸脑病是由ETHE1 基因突变引起的,该基因位于19q13.31,由7 个外显子组成,目前人类基因突变数据库(Human Gene Mutation Database, HGMD) 收录了 34 个 ETHE1 突变,大部分为错义突变,绝大部分突变集中于第1、2、4外显子[7]。目前基因型与表型的相关性尚不明确,PIGEON 等[8]的报道显示,即使在双胞胎中,也是异质性的,表型也不尽相同,可以是典型的,也可以是非典型的,更有早期死亡的严重型。该基因编码硫化物解毒线粒体蛋白,又称为线粒体硫双加氧酶,它催化谷胱甘肽过硫化物(GSSH)的氧化,生成谷胱甘肽和过亚硫酸盐,ETHE1 基因突变将引起线粒体硫双加氧酶缺陷,而线粒体硫双加氧酶对硫化氢(H2S) 的解毒至关重要,其缺陷将导致体内出现高水平的H2S,目前被认为是该病的发病机制[9]。
H2S 是一种微量的无色、水溶性的气体介质,不稳定且难于测定,参与血管张力的调节。当H2S浓度较高时,毒性极高,可直接损伤细胞膜,包括血管内皮细胞和大肠粘膜细胞。其对体内多种酶有毒性作用,能够抑制细胞色素C 氧化酶,阻止线粒体呼吸和增加乳酸,抑制环氧化酶及短链酰基辅酶A 脱氢酶,从而导致丙二酸乙酯和丁酰肉碱、异戊酰肉碱升高;也被证明会损害其他酰基辅酶A 脱氢酶,异丁基辅酶A 脱氢酶、2-甲基丁酰辅酶A 脱氢酶和异戊基辅酶A 脱氢酶,这些酶的缺少会导致丁酰肉碱、异戊酰肉碱进一步增加,异丁基辅酶A 和异戊基甘氨酸升高[2]。因此这也解释了乙基丙二酸脑病的发病机制主要是由H2S 介导的,结合本研究患儿疾病初期出现的顽固性腹泻、皮肤大量出血点、瘀斑,后期四肢末梢发绀、浅昏迷、肌张力低下、顽固性乳酸酸中毒,可能就是由于代谢产物H2S 在大脑与全身肌肉中大量积聚导致。
乙基丙二酸脑病发病率较低,目前尚无统计学数据,但可能比预期要高,因为该病与其他疾病存在许多重叠的临床和实验室发现,应注意与以下疾病相鉴别:肠道过敏性疾病、血液系统疾病、脑膜炎球菌感染、感染性休克、结缔组织病等;乙基丙二酸尿症应与短链酰基辅酶A 脱氢酶缺乏症、戊二酸血症Ⅱ型、牙买加呕吐病、多态性短链酰基辅酶A 脱氢酶,基因和线粒体呼吸链功能障碍区分,诊断该病应依据临床特点和生化特征[10]。尿液乙基丙二酸升高可见于线粒体脂肪酸代谢疾病,血液丁酰肉碱、异戊酰肉碱浓度升高是乙基丙二酸脑病的常见生化表现之一,但并非特异性表现[7]。
随着对乙基丙二酸脑病基因功能及致病性的不断认识,发现对本病的治疗应着重于降低患儿体内H2S 的含量,提高H2S 的清除速率和去毒性水平。目前国外已有多篇文献报道,对于确诊为乙基丙二酸脑病的患儿给予早期积极治疗后的随访中发现患儿体重、腹泻、皮肤表现和神经学结果均有改善。因此,早期给予积极治疗可能对疾病的表现及预后会产生更大的影响。
对于新生儿筛查中发现的乙基丙二酸脑病患者中,饮食中应限制含硫氨基酸,除了可以治疗本病以外,还能够进一步改善临床结果和生化指标[4]。婴幼儿患者早期应给予无乳糖饮食,之后逐渐开始添加辅食:水果泥、山药泥、土豆泥以及各种菜泥,7~8 月时可逐渐加米粉、米粥、蛋黄, 9~10 月加全蛋、 鱼、 虾、 肉泥。 BOYER等[11]报道了一种新的饮食疗法:低蛋氨酸和半胱氨酸饮食,该疗法在新生儿筛查发现的乙基丙二酸脑病患者在8 个月时开始使用,期间为改善口感也可加用水果泥、蔬菜泥,长期随访证实了临床和生化改善。McGOWAN 等[12]也报道了饮食限制蛋氨酸水平可降低乙基丙二酸水平,但由于患者在实施治疗后不久死亡,不能进行长期随访。因此,对于饮食控制,建议早期给予干预,并定期监测血浆氨基酸水平,以便根据需要修改营养成份,预防蛋氨酸缺乏。
除传统的饮食治疗以外,YOON 等[13]报道了对患儿进行核黄素试验性治疗,临床表现及生化指标略有改善。还有文献报道[14]在一项动物试验中,抗坏血酸可降低H2S 对细胞色素C 氧化酶活性的抑制作用, 以提高硫化物氧化的速率。BOYER 等[11]也报道了 1 例患儿于 6 个月后加用了抗坏血酸100 mg,2 次/d,治疗后临床表现及生化指标均有改善。国外目前可用于减少患者H2S积累的药物有甲硝唑和N-乙酰半胱氨酸,哺乳动物H2S 主要来源是大肠的厌氧菌群,甲硝唑是一种对厌氧菌有效的抗生素,其可通过降低肠道厌氧菌数目,抑制H2S 的生成来降低体内H2S 的含量,用法用量为静脉滴注,30 mg/(kg·d),长期治疗可引起白细胞降低、周围神经性病变、假膜性结肠炎等相关并发症;为预防相关并发症可应用新霉素,50 mg/(kg·d),每 2 周交替应用;N-乙酰半胱氨酸是谷胱甘肽的细胞渗透前体,它能从H2S中吸收硫原子,形成无毒的谷胱甘肽过硫化物,从而中和有毒的H2S,100 mg/(kg·d),可应用于昏迷的患者;对于新生儿筛查发现的乙基丙二酸脑病,给予甲硝唑和N-乙酰半胱氨酸联合治疗后,临床表现及生化较前好转,但目前缺乏对该治疗反应的长期随访,应扩大新生儿筛查,在临床症状出现之前识别出乙基丙二酸脑病患者,并尽早开始治疗,以最小化H2S 的毒性,改善患者预后[12,15-16]。国内目前暂无应用甲硝唑及N-乙酰半胱氨酸治疗报道,本研究为国内报道的首例应用乙酰半胱氨酸治疗乙基丙二酸脑病,但由于应用时间短,患儿感染后体内严重代谢紊乱,家长放弃治疗,不能长期追踪治疗效果。
针对急性发作的乙基丙二酸脑病患者,目前治疗策略有限,HERNANDEZ 等[17]报道了在急性代谢紊乱期使用持续肾脏透析替代疗法(CRRT),成功地使一例19 岁非典型患者在24 h 内临床表现及生化改善。CRRT 主要降低体内硫代硫酸盐水平,但值得注意的是由于硫代硫酸盐的体积较小,这些阴离子很容易通过血液滤过的对流或透析扩散而被去除,且CRRT 能够去除N-乙酰半胱氨酸,但对甲硝唑没有明显去除影响,建议透析过程中,静脉注射N-乙酰半胱氨酸的剂量应增加一倍[18-19]。综上,CRRT 能有助于在长期接受甲硝唑和N-乙酰半胱氨酸治疗后出现急性代谢紊乱时恢复代谢平衡。
虽然报道饮食和药物治疗可使乙基丙二酸脑病情况改善。最近,肝移植已被报道称为一种被伦理委员会批准的新的治疗策略。文献[5,19]报道了肝移植术后患儿的精神运动发育方面的显著改善,以及生化指标显著逆转,脑MRI 显示基底神经节病变没有进一步增加。但肝移植存在局限性:①器官的可获得性;②患儿在移植之前可能就出现早期临床和MRI 表现;③肝移植的最佳年龄和体重标准的选择。肝移植的术后并发症包括巨细胞病毒感染及腺病毒感染菌血症,脑MRI 无显著变化等。
除此之外,建议将乙基丙二酸脑病视为国家规定的新生儿筛查的候选疾病,特别是在致病等位基因频率相对较高的人群中,此外还需要进一步的工作开确定丁酰基肉碱(C4)、异戊酰肉碱(C5) 升高在已证实的乙基丙二酸脑病中的频谱[5],目前国外的一些学者也提出,建议加大阳性标本做出实验室切值(cutoff 值) 才能在血尿质谱检测中准确鉴别。同时对于新生儿筛查阳性患儿,应进一步复查同时行基因检测明确诊断,尽早治疗,可能会有效地改变病程,改善临床结果。对于父母携带有EHTH1 致病基因者,应孕期行产前诊断。
综上所述,遗传代谢病起病症状不典型,应注意与其他疾病鉴别,对于新生儿筛查有异常的应给予足够重视,以免延误治疗时机。血尿遗传代谢筛查有助于诊断,基因分析可予以确诊,对于确诊患儿,应尽早给予饮食指导,同时可尝试应用甲硝唑和N-乙酰半胱氨酸联合治疗,必要时进行肝移植手术。
