朱顶红花器官离体培养诱导再生植株研究
2020-09-06刘宝勇


摘要在添加 NAA或2,4 -D和 6 -BA 的MS 基本培养基中,以朱顶红品种“柠檬冰糕”(Hippeastrum hybridum ‘lemon sorbet)的花器官为外植体进行体外培养,分别从子房壁、花瓣、胚珠的培養中诱导出无菌植株,并对再生植株后期的生长表现进行几年的持续观察,认为花器官培养是最有效的朱顶红快速繁殖方式。
关键词朱顶红;花器官;离体培养;再生植株
中图分类号S682.2+5文献标识码A
文章编号0517-6611(2020)15-0133-03
doi:10.3969/j.issn.0517-6611.2020.15.037
开放科学(资源服务)标识码(OSID):
Study on Plant Regeneration Induced by in vitro Culture of Flower Organs of Hippeastrum hybridum
LIU Baoyong
(Wuhan Landscape Research Institute, Wuhan, Hubei 430081)
AbstractIn the MS medium supplemented with NAA or 2,4D and 6-BA, the floral organs of Hippeastrum hybridum ‘lemon sorbet were cultured in vitro, and sterile plants were induced from ovary wall, petal and ovule culture, respectively.The growth performance of the regenerated plants was observed for several years, and it was considered that floral organ culture was the most effective way for rapid propagation of Hippeastrum hybridum.
Key wordsHippeastrum hybridum;Floral organs;In vitro culture;Regenerated plant
基金项目武汉市园林局科研基金项目(武园发〔2015〕9 号)。
作者简介刘宝勇(1962—),男,湖北随州人,高级工程师,从事球根宿根类花卉和香味花卉研究。
收稿日期2019-12-17;修回日期2020-03-20
朱顶红原产于南美,20世纪初引入我国,至20世纪末,欧洲朱顶红育种工作取得长足发展,已培育出了大量的杂交园艺新品种,同时,大量新品种开始进入我国,在我国这些年也得到较快的发展。经过几年对杂交朱顶红(Hippeastrum hybridum)的引种栽培观察,证明朱顶红在武汉地区的适应性十分良好,进行露地栽培,炎热的夏天休眠不明显,寒冷的冬季只需稍加处理,就可以安全度过,不需要特别的精细管理。观赏期很长,4—6月和9—11月各有一次盛花期,4—12月每月都陆续可以见到花开,且无花时观叶效果也十分优良。但是,目前种球主要还是靠进口,价格仍然比较昂贵,大量的园林应用受到很大的限制,另外一些珍稀品种,供给数量往往很少,常规繁殖效率低下,如何快速有效地进行大量繁殖,降低应用成本,是目前应当解决的一个重要问题。组织培养是一种行之有效的解决方法,目前,朱顶红组织培养已有多年研究[1],有采用种子下胚轴进行培养的[2],有选择花梗、子房培养的[3],也有采用幼嫩蒴果进行培养的[4]。报道较多的是采用鳞茎鳞片进行培养繁殖[5-10],这种方法由于要消耗种球,代价较高,而且污染及褐化都比较严重,分化率低,分化较慢。
该试验以朱顶红品种“柠檬冰糕”(Hippeastrum hybridum ‘lemon sorbet)的花器官为外植体进行培养,分别从子房壁、花瓣、胚珠的培养中获得不同来源的无菌植株,并对组培苗后期的生长进行几年的持续观察, 以获得有效的朱顶红快速繁殖方式。
1材料与方法
1.1材料
试验材料为荷兰产朱顶红品种“柠檬冰糕”花器官,开花期间,现采集使用。试验采集一个花枝,共包含花及花蕾4个,其中
第一朵(花1)花已开过,花瓣已萎蔫,取用子房;第二朵(花2)为当天初开的花朵,已完全开放,取用子房和花瓣;第三朵(花3)为大花蕾,蕾长8 cm,已经开始显色,取用子房、花瓣及花药;第四朵(花4)为小花蕾,蕾长5 cm,取用子房、花瓣及花药。花药分别进行单独接种和与花瓣混合接种。
1.2方法
1.2.1取材接种及无菌苗诱导。
完整切取朱顶红的花及花蕾,已经萎蔫及盛开的花朵,将花瓣上部切去舍弃,用洗洁剂小心洗净,流水充分冲洗干净后,为了便于后面的灭菌,将大的花蕾上半部分也用干净的刀片切去一些,一起放入玻璃培养瓶中;用75%乙醇冲洗30~60 s,然后以10%的次氯酸钠溶液灭菌10 min,无菌水冲洗3遍以上。子房纵向剖切为3瓣,连同胚珠一起接种,花瓣切取0.5 cm,根据大小纵剖为4~8瓣,花药直接接种或者横切一下溢出花粉粒,分别接种到不同的培养集中进行培养。接种日期为2014年12月24日。
培养温度为25 ℃,三色生物照明灯照明,光照强度1 500~2 500 lx,光照时长12 h/d。
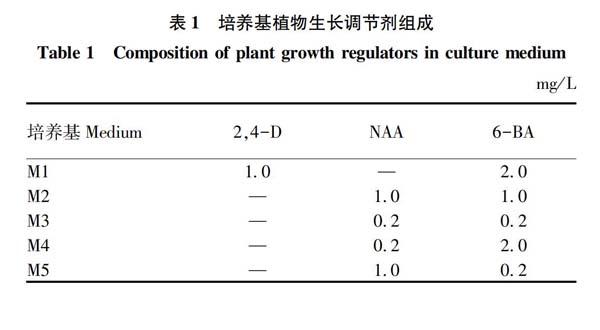
1.2.2培养基选用。基本培养基选用MS培养基,添加30 g/L蔗糖,琼脂粉6~7 g/L,添加不同浓度和种类的植物生长调节剂,此次试验所使用的培养基生长调节剂添加情况见表1。
1.2.3继代培养与增殖。外植体分化出芽长叶,在基部形成小鳞茎,且逐步长大后,取出新长出的较大鳞茎,进行纵向切割,根据球的大小切分为2~8瓣,小球则直接转接,继代培养基仍选用原MS培养基,增殖选用M4号培养基,蔗糖、琼脂粉含量不變,培养温度、光照条件不变。
1.2.4生根。
叶片长出形成小鳞茎后,在诱导培养基和增殖培养基上都能够直接生长出根,未另外进行生根培养,待球茎长至0.5~1.0 cm即可出瓶上盆种植。另外,已经形成健壮小鳞茎的植株,即使没有根,种植后也能成活。
1.2.5出瓶上盆种植。
小苗生根以后即可出瓶上盆,出瓶种植之前未进行开瓶炼苗。将培养苗从瓶中取出,把培养基清除洗净,分开小种球,种植在事先准备好的栽培基质中,基质组成配比为泥炭∶蚯蚓土(1∶1),种植容器为直径13 cm的红黑双色塑料盆钵,每盆一苗,种植时间为2016年3月30日。1年后换入直径为18 cm红黑双色塑料盆中。
1.2.6后期管理。后期按朱顶红常规栽培方法种植,未作其他特殊处理。
2结果与分析
2.1无菌苗诱导情况不同外植体和培养基组合的培养情况见表2。
从表2可以看出,在M1培养基中由花2的子房壁诱导出了无菌苗;在M2培养基中由花3的花瓣诱导出了无菌苗,还由花4的胚珠诱导出了大量的无菌苗;在M3培养基中由花3的花瓣诱导出了无菌苗,由花4的子房壁诱导出了无菌苗;在M4、M5培养基中未诱导出无菌苗,花1未诱导出苗。
2.1.1灭菌效果。
该试验共使用花朵花蕾4个,接种21瓶,其中,已经萎蔫的花朵一个接种2瓶全部污染,初开的花朵和小花蕾接种的材料中各有1瓶污染,污染全部为子房材料,花瓣的污染率为0,表明除萎蔫的花朵容易污染外,初开的花朵以及花蕾灭菌效果均良好。
2.1.2花朵不同部位作为外植体的诱导效果。
2.1.2.1子房。分别由子房壁和胚珠诱导出无菌苗。
由子房壁诱导出无菌苗较慢,接种30 d左右,可见子房明显长大,脂肪壁表面逐渐变得凹凸不平,形成愈伤组织,然后部分愈伤组织再分化出苗,该试验中3朵花均产生了愈伤组织,但生长较慢,在切口处容易变成褐色,但对子房壁的进一步生长影响不大,其中2朵花的子房壁愈伤组织再分化,生长出苗(图1)。
在最小一个花蕾的子房培养中,子房壁逐渐变褐色,但大量胚珠慢慢生长变绿,并且进一步生长出小芽,获得到大量无菌苗(图2)。
2.1.2.2花瓣。在2个未开的花蕾花瓣上均诱导出无菌苗。接种后14 d左右,可见花瓣组织有明显增大现象,30 d左右,出绿色小点,小点逐渐长大,形成许多小芽,60 d左右小芽叶片可以长到3 cm以上,将这些小芽分开,继续分别进行继代培养,随着叶片长大,在基部形成小鳞茎,且逐步长大(图3)。将培育出的小种球再进行纵向切割,转入增殖培养基进一步进行增殖培养,可以快速增加个体数量。已经完全盛开的花朵没有诱导出苗,花蕾花瓣的上半部较薄部分也没有诱导出苗。
2.1.2.3花药。所有的花药,不论是单独接种,还是和花瓣一起接种,均未分化获得到无菌苗。
2.2组培苗后期表现
朱顶红上盆成活率高,上盆前未进行炼苗处理,成活率仍然达100%。2016年3月30日出瓶上盆,上盆后一年,植株于2017年4月5日初次开花,首次开出的第一朵花为畸形花,花瓣呈叶片状,全绿色;当年4月12日第2朵花开放,颜色接近正常的黄色,个别花瓣仍有畸形现象;5月23日第3次开放,整个花都已经正常。以后所开之花大部分为正常花。
由组培苗获得的植株,侧芽增殖旺盛,萌芽多。对来源于组培苗、分株苗及原进口商品球苗的萌芽情况进行统计,结果如下:
单株的萌芽数量(含主芽)为6.2、2.4、4.8。
其中组培苗为出瓶上盆种植3年的植株,分株苗为2015年分株上盆种植4年的植株,原球苗为荷兰原产进口商品球,露地栽培5年。品种均为“柠檬冰糕”,均为连续取样10株。组培苗栽培3年后,其萌芽数量最高为12个,最少也有2个,平均为6个以上,远高于分株苗的萌芽数量,而且明显比商品球在地面种植5年以后产生的萌芽还要多。与此同时,花枝也多,图4显示一盆组培苗在2019年同时开花4枝。
3结论与讨论
采用花器官为外植体进行组织培养是朱顶红快速繁殖的一种非常有效的方法,与其他繁殖方法相比,具有十分明显的优点。
(1)材料来源充足,成本低廉,切取叶片对植物的光合作用会有影响,切取鳞片更是会破坏种球,影响植株的生长,而切取花枝对植物生长没有任何影响,为了使种球增大,往往还需要切去花枝,可以利用这些材料作为充足的外植体来源,几乎不需要什么成本。
(2)简化了灭菌操作,灭菌效果好,污染率低。也曾采用小子球切割培养,因为球根在土中生长,大多是带菌体,菌丝侵入组织内部,处理较为麻烦,灭菌效果不佳,培养种材料很容易带菌,污染率高。而花器官培养,仅使用最普通的次氯酸钠溶液进行灭菌,就能达到很好的灭菌效果,污染率极低。
(3)无菌苗诱导容易,诱导效率高。该试验中对培养基并没有进行复杂的正交试验,培养基也没有添加过多复杂成分,仅仅设计了几种比较简单的培养基,即成功获得多瓶不同来源的无菌苗。在其后不同品种试验中,从花总梗、花柄中也都成功诱导出了无菌苗,表明用花作为外植体进行组织培养中,诱导无菌苗,简单而且高效。花梗、花柄以及子房壁的培养中,经常出现褐化现象,大多数采用活性炭或者维生素C进行处理[3],该试验不加任何添加物也能顺利获得无菌苗。
(4)用花瓣作为外植体进行培养,不需要经过脱分化产生大量愈伤组织然后进行再分化出苗的过程,直接从培养物表面出芽,出苗快,生长也快。
(5)通过未受精胚株培养,也可以直接获得大量的胚珠苗,而且,从中有可能得到单倍体植株,通过加倍可以快速获得纯合个体,这对于朱顶红的新品种培育具有十分重要的价值。
(6)与分球以及播种相比,组培苗生长快速,开花周期短,最快只有1年时间就可以开花,2年即可成为商品苗。而通过分球繁殖的植株,同样大小的子球至少需要培育2年才能够开花,通过播种繁殖的小苗,必须满3年才能开花。
(7)通过花器官组织培养获得的植株萌芽较多,种球增殖力强,配合分株繁殖,可以获得更多的子球,繁殖效率得到进一步提高。
(8)通过组织培养培育出的种苗,可以稳定继承其母本的特征,表现稳定,植株健壮,着花多而整齐,株型也好。
综上所述,通过花器官进行培养是获得朱顶红无菌苗,进行朱顶红快速繁殖的有效途径。
参考文献
[1]
沈苗苗,于晓南.朱顶红组织培養研究进展[J].黑龙江农业科学,2011(10):135-138.
[2] 纪春艳.朱顶红种子下胚轴离体培养与植株再生的研究[J].北方园艺,2008(6):190-191.
[3] 王宇,江黎.朱顶红花梗与子房组织培养技术研究[J].上海农业科技,2017(2):79-81.
[4] 姜明兰,钟文田.朱顶红愈伤组织的诱导和植株再生[J].植物生理学通讯,1984(1):37-38.
[5] 刘铎,梁树乐.朱顶红快繁无菌体系建立的研究[J].现代园艺,2018(3):23-25.
[6] 张松,达克东,曹辰兴,等.朱顶红离体培养快速繁殖体系及胚状体发生[J].园艺学报,2002,29(3):285-287.
[7] 娄晓鸣,周玉珍,孔贤,等.杂交朱顶红鳞茎不定芽诱导研究[J].安徽农业科学,2009,37(34):16769-16770.
[8] 龚雪琴,由翠荣,曲复宁,等.朱顶红体细胞胚胎发生及植株再生研究[J].园艺学报,2012,39(2):381-386.
[9] 邵素娟.朱顶红快繁技术研究[D].上海:上海交通大学,2008:33-43.
[10] 吴永朋,原雅玲,李淑娟,等.朱顶红鳞茎扦插研究[J].陕西农业科学,2016,62(4):45-48.
