含铁含钙食品环境中胭脂虫红酸呈色的改善研究
2020-09-06刘倩何志勇曾茂茂秦昉王召君陈洁
刘倩 何志勇 曾茂茂 秦昉 王召君 陈洁

摘要胭脂蟲红酸是从仙人掌上的胭脂虫体内提取的一种天然色素,但在含铁含钙环境中呈色易受影响,限制了其在食品中的应用。研究了Al3+、Zn2+、氨基酸、肽、乳清分离蛋白(WPI)和乙二胺四乙酸(EDTA)对含铁含钙胭脂虫红酸溶液呈色的影响,以期改善其应用效果。结果表明,在Fe3+和Ca2+浓度分别为0.001~0.010 mol/L、0.01~0.10 mol/L时,添加0.1 mol/L Al3+后,在pH 6.0和pH 8.0缓冲液中胭脂虫红酸呈红色;0.1 mol/L Zn2+对胭脂虫红酸呈色无改善。谷氨酸、甘氨酸、谷胱甘肽、酪蛋白磷酸肽和WPI对含0.001~0.010 mol/L Fe3+的胭脂虫红酸溶液颜色无明显影响。谷氨酸和谷胱甘肽使含0.1 mol/L Ca2+的胭脂虫红酸水溶液均呈橘黄色,不再生成棕色絮状物。甘氨酸、酪蛋白磷酸肽和WPI使含0.01~0.10 mol/L Ca2+的胭脂虫红酸水溶液呈灰绿色。EDTA的螯合作用使胭脂虫红酸呈色稳定,其在水溶液及pH 6.0缓冲液中呈橘黄色,在pH 8.0缓冲液中呈绛紫色,不受0.01 mol/L Fe3+及0.01~0.10 mol/L Ca2+的影响。该研究为改善胭脂虫红酸在含铁含钙食品体系中的呈色效果提供了一定的参考依据。
关键词胭脂虫红酸;两性化合物;金属螯合剂;金属离子;颜色
中图分类号TS202.3文献标识码A
文章编号0517-6611(2020)15-0183-06
doi:10.3969/j.issn.0517-6611.2020.15.053
开放科学(资源服务)标识码(OSID):
Study on the Improvement of the Color of Carminic Acid in Ironcontaining and Calciumcontaining Food Environment
LIU Qian,HE Zhiyong,ZENG Maomao et al
(State Key Laboratory of Food Science and Technology,Jiangnan University,Wuxi,Jiangsu 214122)
AbstractCarminic acid is a natural colorant extracted from the cochineal body on the cactus,but its color is susceptible in ironcontaining and calciumcontaining environment,limiting its application in food.In order to improve its application effect,the effects of Al3+,Zn2+,amino acids,peptides,whey protein isolate (WPI) and ethylenediaminetetraacetic acid (EDTA) on the color of ironcontaining and calciumcontaining carminic acid solution were investigated in this paper.When the concentrations of Fe3+ and Ca2+ were 0.001-0.010 mol/L and 0.01-0.10 mol/L,respectively,after adding 0.1 mol/L Al3+,carminic acid was red in pH 6.0 and pH 8.0 buffers; the addition of 0.1 mol/L Zn2+ did not improve the color of carminic acid.Glutamic acid,glycine,glutathione,casein phosphopeptide and WPI had no significant effect on the color of carminic acid solution containing 0.001-0.010 mol/L Fe3+.The addition of glutamic acid and glutathione made carminic acid solution containing 0.1 mol/L Ca2+ appear orange and no longer produced brown floc.Glycine,casein phosphopeptide and WPI made the carminic acid solution containing 0.01-0.10 mol/L Ca2+ appear graygreen.Due to the chelation of EDTA,the color of carminic acid was stable.It was orange in aqueous solution and pH 6.0 buffer and ocherpurple in pH 8.0 buffer,and was not affected by 0.01 mol/L Fe3+and 0.01-0.10 mol/L Ca2+.This research provided a reference for improving the coloration of carminic acid in food system containing iron and calcium.
Key wordsCarminic acid;Amphoteric compounds;Metal chelators;Metal ions;Color
基金项目国家自然科学基金项目(31771978);江苏省六大人才高峰项目(NY-095);食品科学与工程国家一流学科建设项目(JUFSTR20180201);上海统益生物科技有限公司研发基金项目(190612)。
作者简介刘倩(1995—),女,河北衡水人,硕士研究生,研究方向:食品加工与组分变化。*通信作者,何志勇,教授,博士,从事食品加工与组分变化研究;陈洁,教授,博士,从事食品加工与组分变化研究。
收稿日期2020-02-19
胭脂虫红酸是从胭脂虫中提取的天然蒽醌类色素[1],常用于对食品、药品及化妆品染色。由于色素的颜色取决于染料分子中共轭不饱和体系的存在[2],任何可使该体系发生改变的物质均可对色素颜色产生影响。研究表明,當溶液中存在Fe3+或Ca2+时,胭脂虫红酸溶液可变为灰褐色[3]。然而,铁和钙在食品中普遍存在,如铁在猪、牛、羊等动物肝脏中含量较高,钙在牛奶、海带、虾皮以及豆制品中也存在较高含量。因此,胭脂虫红酸在含铁含钙环境中颜色的不稳定性限制了其在食品中的应用。
胭脂虫红铝色淀是通过将胭脂虫红酸沉淀于氢氧化铝基质上制备所得。其中,铝原子通过5-位的羟基和邻位的羰基氧与两分子的胭脂虫红酸进行螯合[4-5],使得其化学结构较为稳定,不易受外界环境的影响。胭脂虫红铝色淀的呈色较稳定,经常被应用于食品、药品、化妆品及绘画产品中进行染色。传统观念认为铝元素非常安全,但随着研究的不断深入,发现食品中铝元素的暴露对于人体健康存在一定的危害[6-8],使得胭脂虫红铝色淀在食品中的应用受到质疑。
氢氧化铝是一种两性化合物,既可与酸发生反应,也可与强碱发生反应,同样具有两性的无机物还包括氢氧化锌、氢氧化铜等。金属螯合物可与Fe3+、Ca2+等金属离子进行配位形成络合物。食品中常见的金属螯合物包括乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)、柠檬酸等[9]。而氨基酸、肽和蛋白质由于同时含有羧基和氨基,可作为两性化合物[10],同时还是天然的金属螯合物[11]。笔者研究了Al3+、Zn2+、氨基酸、肽、乳清分离蛋白(whey protein isolate,WPI)以及EDTA对含铁含钙胭脂虫红酸溶液呈色的影响,以期改善胭脂虫红酸在含铁含钙食品体系中的呈色效果。
1材料与方法
1.1材料与设备
1.1.1材料。
胭脂虫红酸(纯度85%),购于上海统益生物科技有限公司;十二水合磷酸氢二钠(AR)、柠檬酸(AR)、六水合三氯化铝(AR)、氯化锌(AR)、甘氨酸(AR)、L-谷氨酸(BR)、还原型谷胱甘肽(AR)、乙二胺四乙酸(AR),购于上海国药集团化学试剂有限公司;酪蛋白磷酸肽,购于上海承佑实业有限公司;乳清分离蛋白(WPI)(纯度92%),购于美国戴维斯柯(Davisco)食品国际公司;去离子水用于制备所有试剂和样品。
1.1.2设备。
PL2002 型电子天平、AX205 型分析天平、Seven Easy pH计(上海梅特勒-托利多仪器有限公司);RO-10 power 型磁力搅拌器、Vortex Genius 3 型旋涡振荡器(德国IKA公司);HH-W420 型三用恒温水箱(江苏盛蓝仪器制造有限公司);Spectramax 190 型全波长酶标仪(美国Molecular Devices公司)。
1.2方法
1.2.1含铁含钙胭脂虫红酸溶液的配制。
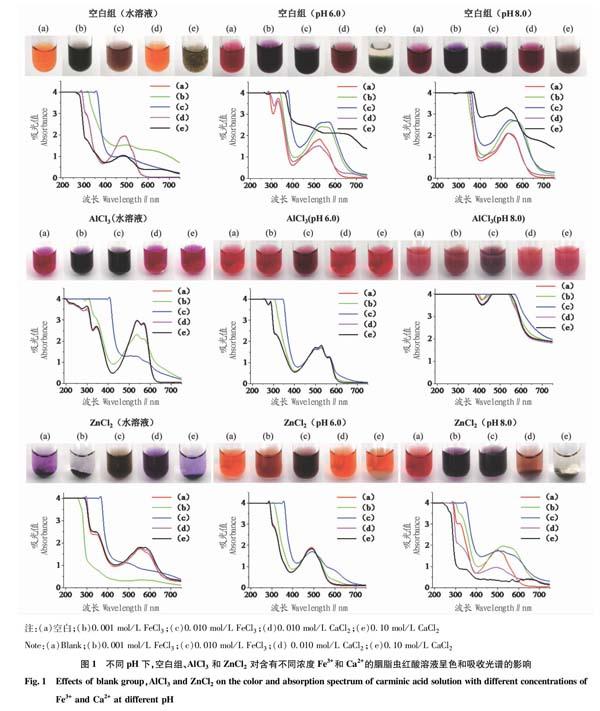
将0.2 mol/L磷酸氢二钠和0.1 mol/L柠檬酸混合,配制成pH分别为6.0和8.0的缓冲溶液。胭脂虫红酸分别加入到水、pH 6.0和pH 8.0的缓冲液中配制成1∶5 000(w/w)的色素溶液。将每个pH下的色素溶液平均分成5份,加入金属离子的量分别为0、0.001、0.010 mol/L FeCl3,0.01、0.10 mol/L CaCl2。
1.2.2Al3+和Zn2+对含铁含钙胭脂虫红酸溶液呈色的影响。
将0.1 mol/L AlCl3、0.1 mol/L ZnCl2分别加入上述不同pH的1∶5 000(w/w)色素溶液中,根据上述金属离子的量添加FeCl3和CaCl2,不加Al3+和Zn2+的对应色素溶液为空白组。用相机拍摄记录所有样品的颜色变化,利用pH计测量所有样品的pH。利用酶标仪对所有样品进行全波长扫描,记录其吸收光谱,扫描范围为190~750 nm,步长为10 nm。每组试验重复3次。
1.2.3氨基酸对含铁含钙胭脂虫红酸溶液呈色的影响。
将1%(w/w)甘氨酸加入“1.2.1”所配制的不同pH的1∶5 000(w/w)色素溶液中。将1%(w/w)谷氨酸加入“1.2.1”所配制的不同pH的1∶5 000(w/w)色素溶液中,90 ℃加热15 min,使其完全溶解后冷却至室温。根据“1.2.1”所述金属离子的量添加FeCl3和CaCl2。并同“1.2.2”方法一样,测定所有样品的吸收光谱、pH以及记录颜色变化。每组试验重复3次。
1.2.4肽对含铁含钙胭脂虫红酸溶液呈色的影响。
将1%(w/w)谷胱甘肽、1%(w/w)酪蛋白磷酸肽分别加入“1.2.1”所配制的不同pH的1∶5 000(w/w)色素溶液中,根据“1.2.1”所述金属离子的量添加FeCl3和CaCl2。并同“12.2”方法一样,测定所有样品的吸收光谱、pH以及记录颜色变化。每组试验重复3次。
1.2.5WPI对含铁含钙胭脂虫红酸溶液呈色的影响。
将1%(w/w)WPI加入“1.2.1”所配制的不同pH的1∶5 000(w/w)色素溶液中,根据“1.2.1”所述金属离子的量添加FeCl3和CaCl2。并同“1.2.2”方法一样,测定所有样品的吸收光谱、pH以及记录颜色变化。每组试验重复3次。
1.2.6EDTA对含铁含钙胭脂虫红酸溶液呈色的影响。
将1%(w/w)EDTA加入“1.2.1”所配制的不同pH的1∶5 000(w/w)色素溶液中,在90 ℃加热15 min,促进其溶解。待溶液冷却至室温,根据“1.2.1”所述金属离子的量添加FeCl3和CaCl2。并同“1.2.2”方法一样,测定所有样品的吸收光谱、pH以及记录颜色变化。每组试验重复3次。
2结果与分析
2.1Al3+和Zn2+对含铁含钙胭脂虫红酸溶液呈色的影响
Al3+和Zn2+在碱性条件下可分别形成Al(OH)3和Zn(OH)2,二者均是常见的无机两性化合物。
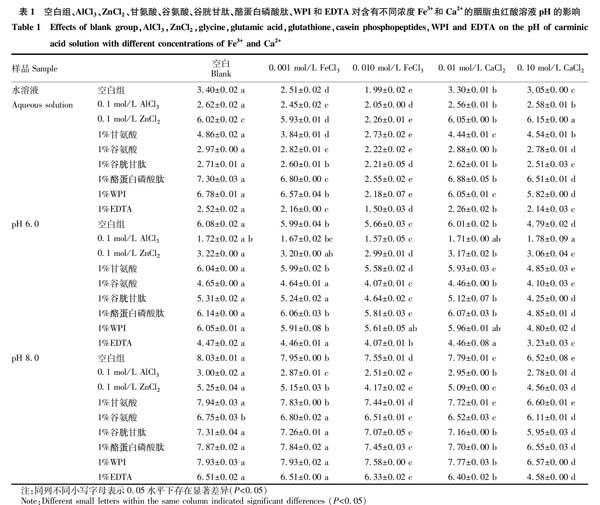
从图1可以看出,Al3+使得含0.001~0.010 mol/L Fe3+的胭脂蟲红酸水溶液的颜色变为紫色,在540 nm处存在吸收峰,Fe3+浓度为0.010 mol/L时吸光值明显减小。Ca2+浓度为0.10 mol/L时,Al3+使得胭脂虫红酸水溶液呈紫红色,不再生成棕色絮状物,吸收光谱与不含Ca2+的溶液一致,在540、570 nm处存在2个吸收峰。说明Al3+对于胭脂虫红酸的螯合作用强于Ca2+,在含Ca2+情况下对胭脂虫红酸呈色有一定的保护作用。对于含0.001~0.010 mol/L Fe3+和0.01~0.10 mol/L Ca2+的pH 6.0缓冲液,加入Al3+后,胭脂虫红酸颜色均为红色,吸收光谱基本一致,均在500、530和560 nm处存在3个吸收峰;对于pH 8.0缓冲液,加入Al3+后,溶液中均生成红色沉淀。这可能是由于Al3+与胭脂虫红酸的螯合以及缓冲液中的柠檬酸对Fe3+和Ca2+的螯合作用所致。根据表1,除含有0.010 mol/L Fe3+的溶液pH较低外,其他条件下添加有Al3+的胭脂虫红酸溶液的pH都较为稳定,不受0.001 mol/L Fe3+和0.01~0.10 mol/L Ca2+的影响。胭脂虫红酸水溶液遇Zn2+呈紫色,Zn2+对含铁含钙的胭脂虫红酸水溶液以及pH 8.0缓冲液颜色均无改善作用。在含0.01~0.10 mol/L Ca2+的pH 6.0缓冲液中,添加Zn2+,胭脂虫红酸溶液呈橘黄色,吸收光谱均在490 nm处存在吸收峰,溶液中出现白色沉淀,溶液pH为3.17。这可能是由于溶液中生成Zn(OH)2沉淀,使得上清液呈酸性所致。由以上结果可知,Al3+存在下,胭脂虫红酸呈色稳定,而Zn2+对于胭脂虫红酸呈色基本无改善作用。
2.2氨基酸对含铁含钙胭脂虫红酸溶液呈色的影响
氨基酸含有-NH2、-OH等,其对正质子有强大吸引力,可与金属元素形成稳定的螯合物[12-13]。研究表明,甘氨酸对于Fe2+具有一定的螯合作用[14]。谷氨酸既对Ca2+具有螯合作用,还具有一定的酸性[15]。从图2可以看出,甘氨酸对含有0.001~0.010 mol/L Fe3+的胭脂虫红酸溶液颜色无明显影响,说明甘氨酸对于Fe3+的螯合作用不足以改善含铁胭脂虫红酸溶液的呈色情况。而添加甘氨酸后的含有0.01~0.10 mol/L Ca2+的胭脂虫红酸水溶液呈灰绿色。谷氨酸对含有0.001~0.010 mol/L Fe3+的胭脂虫红酸溶液颜色无改善作用。Ca2+浓度为0.10 mol/L时,谷氨酸使得胭脂虫红酸水溶液呈橘黄色,不再生成棕色絮状物,溶液pH为2.78,其吸收光谱与空白一致,最大吸收波长为490 nm。这一方面可能是由于谷氨酸对于Ca2+有一定的螯合作用,另一个方面可能是由于谷氨酸的加入使溶液呈酸性导致的。以上结果说明,甘氨酸对于含钙含铁的胭脂虫红酸溶液颜色无改善作用,谷氨酸可明显改善胭脂虫红酸在0.10 mol/L Ca2+水溶液中的呈色效果。
2.3肽对含铁含钙胭脂虫红酸溶液呈色的影响
谷胱甘肽是由谷氨酸、半胱氨酸和甘氨酸缩合而成的含有巯基的三肽[16],其可与Mg2+、Ca2+、Al3+、Fe2+等金属离子结合,形成复合物[17-18]。酪蛋白磷酸肽是将酪蛋白经蛋白酶水解后所得的具有生物活性的多肽[19],其分子内所含氮原子、氧原子可通过离子键和配位键与金属离子形成环状螯合物[20]。
从图3可以看出,谷胱甘肽使含0.001~0.010 mol/L Fe3+的胭脂虫红酸水溶液颜色有所改善;添加谷胱甘肽后,胭脂虫红酸水溶液遇0.10 mol/L Ca2+仍呈橘黄色,不再生成棕色絮状物,溶液pH为2.51,其均在490 nm处存在吸收峰。这一方面可能是由于谷胱甘肽分子中的氧原子、氮原子和硫原子与Ca2+和Fe3+结合所致,另一方面可能是由于谷胱甘肽分子内的羧基使得胭脂虫红酸溶液保持酸性。酪蛋白磷酸肽对含0.001~0.010 mol/L Fe3+的胭脂虫红酸溶液的颜色无影响,说明胭脂虫红酸与Fe3+的螯合作用较强,酪蛋白磷酸肽并不能对其产生影响。添加酪蛋白磷酸肽后,胭脂虫红酸水溶液颜色均呈灰绿色。在pH 6.0和pH 8.0缓冲液中添加酪蛋白磷酸肽,胭脂虫红酸溶液中产生白色沉淀,而溶液颜色并未发生变化。说明缓冲液对于胭脂虫红酸的呈色有一定的保护作用,酪蛋白磷酸肽的添加并未对其颜色产生影响。
以上结果说明,谷胱甘肽对于含有0.001~0.010 mol/L Fe3+和0.01~0.10 mol/L Ca2+的胭脂虫红酸水溶液颜色有一定的改善,而酪蛋白磷酸肽对于含钙含铁的胭脂虫红酸溶液颜色无改善作用。
2.4WPI对含铁含钙胭脂虫红酸溶液呈色的影响
WPI是β-乳球蛋白、牛血清蛋白和α-乳白蛋白等蛋白的混合物[21]。其中,α-乳白蛋白至少含有2个配体结合位点,其可与Na2+、Ca2+、Mg2+、Zn2+等金属离子结合[22-23]。从图4可以看出,添加WPI后,胭脂虫红酸水溶液颜色由橘黄色变为红色,溶液pH为6.78,这可能是由于蛋白质的氨基使溶液pH发生改变,在此环境中蛋白质中质子化的氨基与带有负电荷的胭脂虫红酸通过静电相互作用生成复合物[24]。WPI的加入对于含有0.001~0.010 mol/L Fe3+的胭脂虫红酸溶液颜色无影响,且pH未发生明显变化。添加WPI后,含有0.01~0.10 mol/L Ca2+的胭脂虫红酸水溶液中生成灰绿色沉淀。
2.5EDTA对含铁含钙胭脂虫红酸溶液呈色的影响
EDTA是由2个氨基和4个羧基组成的多元酸,可满足大多数金属离子的配位数,并与其形成稳定的螯合物[25]。从图5可以看出,添加EDTA后,含有0.001 mol/L Fe3+及0.01~0.10 mol/L Ca2+的胭脂虫红酸水溶液均呈橘黄色,溶液pH约为2.16,吸收光谱一致,最大吸收波长均为490 nm;含有0010 mol/L Fe3+的胭脂虫红酸水溶液呈棕黄色,吸光值明显减小。说明Fe3+和Ca2+与EDTA的螯合作用强于胭脂虫红酸,而0.010 mol/L Fe3+超出了溶液中所添加的EDTA的螯合能力。在pH 6.0缓冲液中,添加EDTA后,分别含有0.001~0.010 mol/L Fe3+和0.01 mol/L Ca2+的胭脂虫红酸均呈橘黄色,溶液pH约为4.46,吸收光谱一致,均在490 nm处存在吸收峰。在pH 8.0缓冲液中,添加EDTA后,分别含有0.001 mol/L Fe3+和0.01 mol/L Ca2+的胭脂蟲红酸均呈绛紫色,溶液pH约为6.51,吸收光谱一致,均在530 nm处存在吸收峰。这可能是由于EDTA与柠檬酸均对Fe3+和Ca2+有螯合作用,并且EDTA中的羧基使得溶液酸性加强所致。然而0.10 mol/L Ca2+超出了EDTA和柠檬酸的螯合能力,使得添加有胭脂虫红酸的pH 6.0和pH 8.0缓冲液中分别生成棕色絮状物和灰绿色沉淀。
3讨论
Al3+和EDTA的添加使得胭脂虫红酸呈色稳定,在0.001~0.010 mol/L Fe3+和0.01~0.10 mol/L Ca2+的范围内,溶液颜色基本一致,不受Fe3+和Ca2+的影响。谷氨酸和谷胱甘肽使得含有0.10 mol/L Ca2+的胭脂虫红酸水溶液颜色有所改善,溶液均呈橘黄色,不再生成棕色絮状物。甘氨酸、酪蛋白磷酸肽和WPI对于胭脂虫红酸的呈色无明显改善作用。
参考文献
[1]
BORGES M E,TEJERA R L,DAZ L,et al.Natural dyes extraction from cochineal (Dactylopius coccus).New extraction methods[J].Food chemistry,2012,132(4):1855-1860.
[2] SCOTTER M J,CASTLE L.Chemical interactions between additives in foodstuffs:A review[J].Food additives and contaminants,2004,21(2):93-124.
[3] 张弘,郑华,陈军,等.胭脂虫红色素稳定性研究[J].食品科学,2008,29(11):59-64.
[4] FAVARO G,MILIANI C,ROMANI A,et al.Role of protolytic interactions in photoaging processes of carminic acid and carminic lake in solution and painted layers[J].Journal of the chemical society,2002,2:192-197.
[5] HARRIS M,STEIN B K,TYMAN J H P,et al.The structure of the colourant/pigment,carmine derived from carminic acid[J].Journal of chemical research,2009 (7):407-409.
[6] YOKEL R A.Bloodbrain barrier flux of aluminum,manganese,iron and other metals suspected to contribute to metalinduced neurodegeneration[J].Journal of alzheimers disease,2006,10(2/3):223-253.
[7] ZHU Y Z,XU J F,SUN H,et al.Effects of aluminum exposure on the allergic responses and humoral immune function in rats[J].Biometals,2011,24(5):973-977.
[8] DING Y X,TANG J L,YOU X,et al.Study on the mechanism underlying Alinduced hepatotoxicity based on the identification of the Albinding proteins in liver[J].Metallomics,2019,11:1353-1362.
[9] 宋永胜,段洪东.螯合剂及其在食品中的应用[J].广州食品工业科技,2004,20(2):147-150.
[10] 陈立伦.谈谈中学化学课中两性化合物的教学[J].中学化学教学参考,1983(6):9-10.
[11] 谭会泽,冯定远.蛋白质氨基酸金属螯合物在动物营养中的应用研究进展[J].广东饲料,2001,10(6):29-32.
[12] ERICSON C,ASHMEAD D H.Enhancing solubility of iron amino acid chelates and iron proteinates:United States 6716814B2[P].2004-04-06.
[13] ALLEN L H.Advantages and limitations of iron amino acid chelates as iron fortificants[J].Nutrition reviews,2002,60(S7):18-21.
[14] 丁保淼.甘氨酸螯合铁及其纳米脂质体研究[D].无锡:江南大学,2010.
[15] SAJADI S A A.Metal ionbinding properties of Lglutamic acid and Laspartic acid,a comparative investigation[J].Natural science,2010,2(2):85-90.
[16] ZHANG T,WEN S H,TAN T W.Optimization of the medium for glutathione production in Saccharomyces cerevisiae[J].Process biochemistry,2007,42(3):454-458.
[17] 劉建华.谷胱甘肽及衍生物与金属离子相互作用理论研究[D].无锡:江南大学,2012.
[18] LIU J H,XIA X L,LI Y,et al.Theoretical study on the interaction of glutathione with group IA (Li+,Na+,K+),IIA (Be2+,Mg2+,Ca2+),and IIIA (Al3+) metal cations[J].Structural chemistry,2013,24(1):251-261.
[19] 王玉莹,陈锡威,冯凤琴,等.酪蛋白磷酸肽的研究进展[J].食品工业,2014,35(5):204-208.
[20] 高然,陈俊德,易瑞灶,等.酪蛋白磷酸肽金属矿物质螯合物的研究进展[J].中国食品添加剂,2015(12):167-171.
[21] MORR C V,HA E Y W.Whey protein concentrates and isolates:Processing and functional properties[J].Critical reviews in food science and nutrition,1993,33(6):431-476.
[22] NOYELLE K,VAN DAEL H.Kinetics of conformational changes induced by the binding of various metal ions to bovine αlactalbumin[J].Journal of inorganic biochemistry,2002,88(1):69-76.
[23] PERMYAKOV E A,SHNYROV V L,KALINICHENKO L P,et al.Binding of Zn(II) ions to αlactalbumin[J].Journal of protein chemistry,1991,10(6):577-584.
[24] SUN W,HAN Y Y,JIAO K.Voltammetric albumin quantification based on its interaction with carminic acid[J].Journal of the serbian chemical society,2006,71(4):385-396.
[25] 李沅知.活性炭粒子电极改性及其三维电极反应器处理EDTA废水的研究[D].长沙:中南大学,2014.
