Radezolid与Linezolid抑制粪肠球菌浮游菌和生物膜的效果评估
2020-09-06邓名贵周红梅张培燕江洁雅陈俊文余治健李多云
邓名贵 周红梅 张培燕 江洁雅 陈俊文 余治健 李多云

摘要:目的 探讨新型噁唑烷酮类抗菌药物Radezolid和Linezolid对粪肠球菌浮游菌和生物膜形成的影响。方法 收集临床分离的202株粪肠球菌,用琼脂稀释法测定Radezolid和Linezolid的最低抑菌浓度(MIC),PCR扩增23S rRNA 结构域V区突变位点、核酸体蛋白基因rplC和rplD,cfr,cfr(B)以及optrA耐药基因的携带情况,结晶紫染色半定量方法检测药物抑制菌株成熟生物膜形成的能力。结果 Radezolid(0.25、0.5 mg/L)对202株粪肠球菌的MIC50/MIC90比Linezolid(2、4 mg/L)低8倍;对于Linezolid非敏感的粪肠球菌,Radezolid体现更好的抑菌活性,Radezolid在1/4×MIC和1/8×MIC濃度下能更好地抑制粪肠球菌生物膜的形成。结论 Radezolid比Linezolid更有效地对抗浮游菌,并在亚抑菌浓度下能更好地抑制粪肠球菌成熟生物膜的形成。
关键词:粪肠球菌;Radezolid;Linezolid;生物膜形成
中图分类号:R96 文献标识码:A DOI:10.3969/j.issn.1006-1959.2020.15.025
文章编号:1006-1959(2020)15-0080-05
Abstract:Objective To investigate the effects of new oxazolidinone antibacterial drugs Radezolid and Linezolid on enterococcus faecalis planktonic bacteria and biofilm formation.Methods 202 clinically isolated Enterococcus faecalis were collected, and the minimum inhibitory concentration (MIC) of Radezolid and Linezolid was determined by agar dilution method, PCR amplification of 23S rRNA domain V region mutation sites, nucleic acid protein genes rplC and rplD, cfr, cfr(B) and optrA drug resistance gene carrying status, semi-quantitative method of crystal violet staining to detect the formation of mature biofilms of drug-inhibited strains ability.Results The MIC50/MIC90 of Radezolid (0.25, 0.5 mg/L) against 202 strains of Enterococcus faecalis is 8 times lower than that of Linezolid (2, 4 mg/L); Radezolid shows better antibacterial activity against Linezolid non-sensitive Enterococcus faecalis,Radezolid can better inhibit the formation of Enterococcus faecalis biofilm at 1/4×MIC and 1/8×MIC concentrations.Conclusion Radezolid is more effective against planktonic bacteria than Linezolid, and it can better inhibit the formation of mature biofilm of Enterococcus faecalis at sub-inhibitory concentrations.
Key words:Enterococcus faecalis;Radezolid;Linezolid;Biofilm formation
粪肠球菌是重要的革兰阳性球菌,是阳性菌医院获得性感染的第二位病原体,其迅速进化对许多抗菌药物均具有耐药性。除了对多种抗菌药物的内在和获得性耐药性之外,多重耐药肠球菌,特别是耐万古霉素的肠球菌(VRE)的传播进一步缩小了抗感染药物的选择。以Linezolid为代表的噁唑烷酮类药物是治疗VRE感染的主要药物之一[1]。然而,随着Linezolid的广泛应用,耐Linezolid的分离株已在世界范围被发现[2]。对噁唑烷酮药物的开发和优化改造促使新的抗菌药物的产生,如Radezolid(RX-1741)[3]。研究显示,Radezolid对多种革兰氏阳性细菌(如葡萄球菌等)的抗菌活性约为Linezolid的11倍[4]。根据目前Radezolid完成的2项Ⅱ期试验结果显示,不同剂量的Radezolid在非复杂性皮肤软组织感染和轻中度CAP中显示出相当的疗效,然而,其安全性尚未明确,且相对于Linezolid的优势尚不清楚。既往研究表明,Linezolid耐药性与23S rRNA V结构域和核糖体蛋白(L3和L4)、cfr、cfr(B)和optrA介导的耐药性的基因突变有关[5]。作为Linezolid的新一代类似物,Radezolid在粪肠球菌的抗菌活性和耐药机制是否与Linezolid相似还有待研究。此外,既往报导Linezolid对粪肠球菌的生物膜有抑制作用[6],但尚不清楚Radezolid对粪肠球菌的生物膜是否更有效。本研究拟比较Radezolid和Linezolid对屎肠球菌浮游细胞和生物膜的不同作用。
1材料与方法
1.1菌株和材料 收集华中科技大学协和深圳医院2011~2016年临床非重复粪肠球菌菌株202株,抗菌药物Linezolid和Radezolid购于上海MCE公司,MHB、TSB和Agar琼脂购自OXOID公司,DNA提取液和PCR试剂和 DNA Maker 为TakaRa公司产品,PCR扩增仪器和酶标仪均为BioRad公司产品。
1.2方法
1.2.1药物敏感试验 菌株经血平板过夜复苏,挑选单克隆,使用质谱仪进行鉴定(IVD MALDI Biotyper,Germany),采用琼脂稀释法,依据美国临床实验室标准化协会(CLSI)2017年规定的标准判定耐药(R)、中介(I)和敏感(S),檢测Linezolid、Radezolid对粪肠球菌的MIC值,质控菌为粪肠球菌ATCC29212,购自广东省临床检验中心。
1.2.2粪肠球菌耐药基因扩增和测序 分离菌株接种血平板复苏后,挑取单克隆菌落加入盛有 50 μl DNA 裂解液(lysis buffer for microorganism to direct pcr)的 EP 管中,按照说明书裂解和提取DNA,取上清进行PCR检测,参考文献[7]方法设计相应的引物,采用PCR分别扩增各菌株的4个拷贝23S rRNA V区基因、rplC和rplD基因、cfr,cfr(B)以及optrA基因,扩增产物经1%琼脂糖凝胶电泳分离后纯化,送生工生物工程(公司)测序,测序结果使用DNAMAN.full.version.v5.2.2标记变异的碱基位点、核糖体蛋白基因核苷酸及氨基酸位点,同时了解菌株cfr,cfr(B)以及optrA基因的携带情况,各基因扩增引物序列见表1。
1.2.3抗菌药物对浮游菌的生长的影响 选择临床粪肠球菌16C106和16C350菌株进行复苏,接种至5 ml TSB培养基,37 ℃,220 rpm振荡培养过夜,将上述菌液用TSB培养基稀释到OD=0.1,分别加入不同的亚抑菌浓度的Radezolid和Linezolid(1/32~1/2× MIC),各300 μl加入自动力生长曲线仪器(美国Bioscreen C公司)配套孔内,各三复孔,设置参数(每30 min读取OD600值,共监测24 h),绘制生长曲线。
1.2.4生物膜半定量分析 参照课题组前期建立的方法[8],通过体外96孔板法构建生物膜感染模型,采用结晶紫半定量染色法检测生物膜形成的量。选择8株生物膜阳性的临床粪肠球菌(16C1、16C35、16C106、16C124、16C138、16C152、16C166和16C350),检测不同亚抑菌浓度下(1/32~1/4×MIC)Radezolid和Linezolid抑制菌株成熟(24 h)生物膜形成的能力。生物膜阴性对照菌株为ATCC29212,为避免实验误差,临床株和对照株均使用三复孔,实验重复3次取平均值。操作步骤简要如下:将菌株复苏,接种至5 ml TSB培养基,37 ℃,220 rpm振荡培养过夜,置于37 ℃摇床振荡培养至对数生长期,取生长期菌液1 ml于1.5 ml EP管中离心,菌体经0.9%生理盐水稀释调节浊度至0.5麦氏浊度(即相当于1.0×108 cfu/ml),再用TSBG培养基(TSB培养基+0.25%葡萄糖)将菌液1:200稀释,菌液的最终浓度为5×105 cfu/ml,将上述菌液加入96孔板,100 μl/孔,同时加入不同浓度的抗菌药物100 μl到上述96孔板内,37 ℃静置培养24 h,弃去菌液,用无菌0.9%生理盐水洗去黏附细菌,重复洗涤3次,室温下干燥后加入甲醇固定15 min(200 ul/孔),弃去甲醇室温下干燥后每孔加入1%结晶紫染液100 μl,室温下染色20 min,清水下轻柔洗脱结晶紫染液直至流水无色,室温下干燥后在酶标仪上读取OD570值并拍照。
1.3统计学分析 应用SPSS 19.0软件进行统计分析,计量资料以(x±s)表示,行t检验,P<0.05为差异有统计学意义。
2结果
2.1 Linezolid和Radezolid对粪肠球菌的MIC分布 由于目前CLSI标准中并没有Radezolid的耐药、中介及敏感的标准,且其在质控菌ATCC29212的质控范围为0.06~0.5 mg/L,根据检测到的MIC值,将Radezolid的MIC分为≤0.125、0.25、0.5和≥1 mg/L,将Linezolid的MIC分为≤1、2、4和≥8 mg/L,计算其MIC50和MIC90了解菌株的MIC值分布。在202株菌株中,Radezolid的MIC50和MIC90比Linezolid下降约8倍(0.25/0.5 mg/L vs 2/4 mg/L),对于32株Linezolid非敏感株(MIC≥4 mg/L),Radezolid同样具有良好的抑菌活性, Radezolid比Linezolid具有更强的体外抑菌活性。
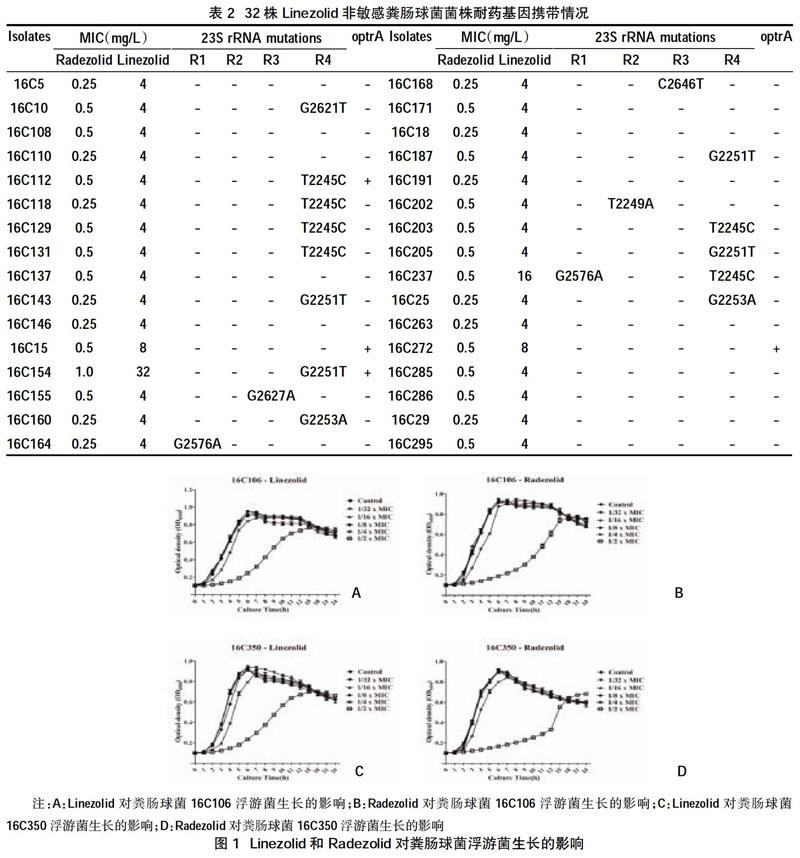
2.2粪肠球菌菌株的耐药突变位点和耐药基因分布 在32株Linezolid非敏感的菌株中,有17株菌株存在至少1个拷贝以上的23S rRNA V区的位点突变,其变异位点包括G2621T、T2245C、G2251T、G2627A、G2253A、G2576A、C2646T、T2249A;4株菌株携带了optrA基因,所有菌株均未检测到核糖体蛋白基因的变异位点,均未携带cfr和cfr(B)基因,见表2。
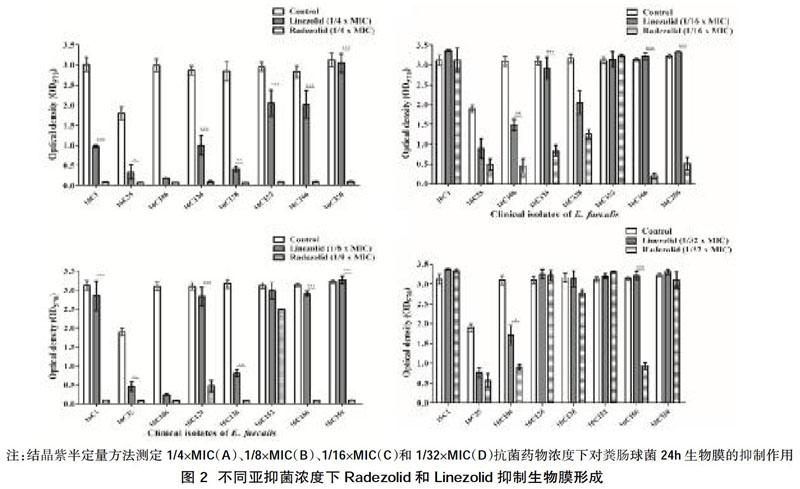
2.3 Radezolid和Linezolid对粪肠球菌浮游菌和生物膜的作用 生长曲线显示,除了1/2×MIC浓度外,其他亚抑菌浓度下,两种抗菌药物均不影响浮游菌的生长,见图1;进一步检测两种药物在1/4× MIC、1/8× MIC、1/16× MIC和1/32× MIC条件对粪肠球菌24 h生物膜形成的抑制作用,结果显示在1/4× MIC和1/8× MIC条件下,Radezolid更有效地抑制粪肠球菌生物膜的形成,见图2。
3討论
做为新一代的噁唑烷酮类药物,Radezolid对常用的多重耐药阳性菌如耐甲氧西林金黄色葡萄球菌(MRSA)和耐Linezolid葡萄球菌均表现有较强的活性[9]。Radezolid与Linezolid的不同之处在于存在一个联芳基和一个杂芳基侧链,这在一定程度增加了Radezolid在生理pH下的电离性和亲水性,并赋予它二元的特性,而且Radezolid具有良好的水溶性,可口服或静注且耐受性较好。在本研究中,无论是Linezolid敏感菌,还是Linezolid非敏感菌,Radezolid的MIC50/MIC90比Linezolid (2/4 mg/L)低8倍。既往研究发现,在Linezolid耐药的金黄色葡萄球菌中(MIC值在8~32 mg/L),Radezolid对菌株的抗性是Linezolid的2~8倍(1~4 mg/L)[9]。在本次研究中也同样出现这一现象,在32株Linezolid非敏感的粪肠球菌(4~32 mg/L)中,Radezolid浓度(0.25~1 mg/L)比Linezolid浓度低8~32倍。与此同时,23S rRNA V区的变异是目前已知是Linezolid耐药的主要机制之一,Locke JB等[9]发现Radezolid对存在G2447T、G2576T 和 G2576T/T2571C位点突变的菌株也有良好的抑菌活性;Fulle S等[10]也通过分子动力学模拟和自由能计算发现G2032A-C2499A双位点突变也导致了Linezolid的耐药。本研究结果显示,Linezolid非敏感菌株存在G2621T、T2245C、G2251T、G2627A、G2253A、G2576A、C2646T和T2249A的位点突变可能与Radezolid耐药相关,提示一些菌株可能出现了Radezolid和Linezolid的交叉耐药,需引起临床足够的重视,同时有研究发现U2504和C2452位点是与Linezolid作用最直接的结合位点[10],这对后续对噁唑烷酮类药物的开发也提供了参考依据。
既往研究表明,Linezolid单独或联合其他常见抗菌药物(如利福平、庆大霉素)有抑制粪肠球菌生物膜形成的作用[11-13]。本研究显示,Radezolid对粪肠杆菌浮游细胞的作用强于Linezolid,在1/4×MIC和1/8×MIC的浓度下,Radezolid能更有效地抑制粪肠球菌生物膜的形成,提示在粪肠球菌生物膜感染中,Radezolid或许可以做为新的选择,但需要更多的体内体外实验进一步验证。
本研究从粪肠球菌研究入手,比较Radezolid与Linezolid的抗菌活性和抗生物膜形成的活性,发现了Radezolid在抑制生物膜形成的优势,但也存在一定的局限性,比如只采用了半定量生物膜分析的方法且菌株数量较少,后续在增加样本的基础上,使用生物膜活菌计数以及激光共聚焦显微镜等方法进一步研究Radezolid对生物膜内细菌的杀灭作用,为针对生物膜的治疗策略提供数据参考。
综上所述,Radezolid比Linezolid更有效地对抗浮游菌,并在亚抑菌浓度下能更好地抑制粪肠球菌成熟生物膜的形成。
参考文献:
[1]Zhao M,Liang L,Ji L,et al.Similar efficacy and safety of daptomycin versus linezolid for treatment of vancomycin-resistant enterococcal bloodstream infections:a meta-analysis[J].Int J Antimicrob Agents,2016,48(3):231-238.
[2]Bi R,Qin T,Fan W,et al.The emerging problem of linezolid-resistant enterococci[J].J Glob Antimicrob Resist,2018(13):11-19.
[3]Bassetti M,Righi E.Safety profiles of old and new antimicrobials for the treatment of MRSA infections[J].Expert Opin Drug Saf,2016,15(4):467-481.
[4]Liapikou A,Cilloniz C,Torres A.Investigational drugs in phase I and phase II clinical trials for the treatment of community-acquired pneumonia[J].Expert Opin Investig Drugs,2017,26(11):1239-1248.
[5]Sadowy E.Linezolid resistance genes and genetic elements enhancing their dissemination in enterococci and streptococci[J].Plasmid,2018(99):89-98.
[6]Taneja S,Kumar P,Malhotra K,et al.Antimicrobial effect of an oxazolidinone, lantibiotic and calcium hydroxide against Enterococcus faecalis biofilm:An in vitro study[J].Indian J Dent,2015,6(4):190-194.
[7]Deshpande LM,Ashcraft DS,Kahn HP,et al.Detection of a New cfr-Like Gene, cfr(B),in Enterococcus faecium Isolates Recovered from Human Specimens in the United States as Part of the SENTRY Antimicrobial Surveillance Program[J].Antimicrob Agents Chemother,2015,59(10):6256-6261.
[8]Zheng JX,Sun X,Lin ZW,et al.In vitro activities of daptomycin combined with fosfomycin or rifampin on planktonic and adherent linezolid-resistant isolates of Enterococcus faecalis[J].J Med Microbiol,2019,68(3):493-502.
[9]Locke JB,Finn J,Hilgers M,et al.Structure-activity relationships of diverse oxazolidinones for linezolid-resistant Staphylococcus aureus strains possessing the cfr methyltransferase gene or ribosomal mutations[J].Antimicrob Agents Chemother,2010,54(12):5337-5343.
[10]Fulle S,Saini JS,Homeyer N,et al.Complex long-distance effects of mutations that confer linezolid resistance in the large ribosomal subunit[J].Nucleic Acids Res,2015,43(16):7731-7743.
[11]Bayston R,Ullas G,Ashraf W.Action of linezolid or vancomycin on biofilms in ventriculoperitoneal shunts in vitro[J].Antimicrob Agents Chemother,2012,56(6):2842-2845.
[12]Luther MK,Arvanitis M,Mylonakis E,et al.Activity of daptomycin or linezolid in combination with rifampin or gentamicin against biofilm-forming Enterococcus faecalis or E.faecium in an in vitro pharmacodynamic model using simulated endocardial vegetations and an in vivo survival assay using Galleria mellonella larvae[J].Antimicrob Agents Chemother,2014,58(8):4612-4620.
[13]Holmberg A,Morgelin M,Rasmussen M.Effectiveness of ciprofloxacin or linezolid in combination with rifampicin against Enterococcus faecalis in biofilms[J].J Antimicrob Chemother,2012,67(2):433-439.
收稿日期:2020-07-02;修回日期:2020-07-13
編辑/成森
