转基因敲除TRA1/TRPV1离子通道表达在慢性胰腺炎疼痛中的调控作用
2020-09-06毕凌波尹翠张奉明顾佳慧李捷祁小术张笑婷吴丹宗亚玲
毕凌波 尹翠 张奉明 顾佳慧 李捷 祁小术 张笑婷 吴丹 宗亚玲
摘要:目的 觀察TRPA1/TRPV1通道对慢性胰腺炎疼痛的调控作用。方法 选取C57野生型小鼠14只,采用随机数字表法分为空白对照组(WT-Vehicle组)和慢性胰腺炎模型组(WT-DBTC组),每组7只。另选实验室培育繁殖的C57转基因小鼠,根据基因鉴定结果,选取TRPA1基因敲除组(TRPA1-KO-DBTC组)7只和TRPV1基因敲除组(TRPV1-KO-DBTC组)10只,未造模时测定四组小鼠腹部机械痛阈和热痛阈基础值,分别在第1、7、14天经口灌胃方式对WT-DBTC组、TRPA1-KO-DBTC组和TRPV1-KO-DBTC组按体重给予8 mg/kg二丁基二氯化锡(DBTC)进行造模,每日监控体重变化。造模结束后第7天再次测定四组小鼠腹部机械痛阈和热痛阈,比较造模前和造模后各组小鼠机械痛阈和热痛阈。结果 造模结束7天后,WT-DBTC组小鼠的腹部机械痛阈和热痛阈低于WT-Vehicle组(P<0.05);而TRPA1-KO-DBTC组和TRPV1-KO-DBTC组小鼠的腹部机械痛阈和热痛阈高于WT-DBTC组小鼠(P<0.05)。结论 全身敲除TRPA1和TRPV1通道可以抑制慢性胰腺炎诱发的机械痛敏和热痛敏,TRPA1和TRPV1通道在慢性胰腺炎疼痛中发挥着重要作用。
关键词:TRPA1;TRPV1;慢性胰腺炎;疼痛
中图分类号:R657.5+1 文献标识码:A DOI:10.3969/j.issn.1006-1959.2020.15.021
文章编号:1006-1959(2020)15-0065-04
Abstract:Objective To observe the regulation effect of TRPA1/TRPV1 channel on chronic pancreatitis pain.Methods Fourteen C57 wild-type mice were selected and divided into a blank control group (WT-Vehicle group) and a chronic pancreatitis model group (WT-DBTC group) using a random number table method, with 7 mice in each group. Another selected laboratory to breed C57 transgenic mice, according to the results of gene identification, select 7 TRPA1 knockout group (TRPA1-KO-DBTC group) and 10 TRPV1 knockout group (TRPV1-KO-DBTC group). The basic values of abdominal mechanical pain threshold and thermal pain threshold were measured in four groups without modeling. On day 1,7 and 14, WT-DBTC group, TRPA1-KO-DBTC group and TRPV1-KO-DBTC group were given 8 mg/kg dibutyltin dichloride (DBTC) according to body weight to monitor body weight changes daily. On the 7th day after modeling, the mechanical pain threshold and thermal pain threshold of the four groups of mice were measured again, and the mechanical pain threshold and thermal pain threshold of each group were compared before and after modeling. Results 7 days after modeling, the abdominal mechanical pain threshold and thermal pain threshold of the WT-DBTC group were lower than those of the WT-Vehicle group (P<0.05); while the TRPA1-KO-DBTC group and TRPV1-KO-DBTC group mice the abdominal mechanical pain threshold and thermal pain threshold were higher than those in the WT-DBTC group (P<0.05).Conclusion Systemic knockout of TRPA1 and TRPV1 channels can inhibit the mechanical and thermal hyperalgesia induced by chronic pancreatitis. TRPA1 and TRPV1 channels play an important role in chronic pancreatitis pain.
Key words:TRPA1;TRPV1;Chronic pancreatitis;Pain
慢性胰腺炎(CP)是一种慢性炎症性疾病,胰腺组织和功能受各种病因影响形成不可逆改变,其病理特征表现为胰腺实质慢性炎症损害和间质纤维化、胰腺实质钙化、胰管扩张及胰管结石等改变[1]。CP的发病机制可能与多种免疫细胞和炎症因子相关[2],炎症造成的长期慢性疼痛往往极大的影响患者的生活质量。瞬时受体电位(TRP)通道是一类通道蛋白,广泛分布于外周和中枢神经系统[3]。TRP通道均是六次跨膜蛋白,其N末端和C末端在细胞内部,第五和第六个跨膜结构域共同形成非选择性阳离子孔道[4],其中疼痛感受方面的动物实验显示,TRPA1和TRPV1通道参与炎性反应,并在炎性疼痛中发挥重要作用[5]。虽然急性胰腺炎疼痛的机制已经被深入研究[6],但在CP疼痛模型中,TRPA1和TRPV1通道的作用还未被证实。本实验通过检测敲除编码TRPA1和TRPV1通道蛋白基因的小鼠与正常小鼠造模前后腹部机械痛阈和热痛阈的变化,旨在为CP引起的疼痛提供新的治疗方向。
1材料和方法
1.1主要试剂及设备 琼脂(Biofroxx 公司),三羟甲基氨基甲烷、乙二胺四乙酸二钠、蔗糖(分析纯)、磷酸二氢钾(分析纯)、氯化钠(分析纯)(上海生工),95%乙醇溶液、甘油、Taq 酶(Novoprotein 公司),引物(上海生工),二丁基二氯化锡(DBTC),Von Frey纤维丝(Von Frey hair,Stoelting,Wood Dale,美国)细丝,热辐射刺激仪、显微照相系统 (日本 Olympus 公司)、PCR 仪 (Bio-Rad 公司)、分析天平(上海精天电子仪器有限公司),微量加样枪(Eppendorf 公司),GelDocXR 凝胶成像仪(Bio-Rad 公司)。
1.2实验动物及分组 健康成年清洁级C57小鼠14只,体重24~28 g,由徐州医科大学实验动物中心提供;采用随机数字表法分为空白对照组(WT-Vehicle组)和CP模型组(WT-DBTC组),每组7只。另选实验室培育繁殖的C57转基因小鼠,自由进食饮水,昼夜节律根据基因鉴定结果,选取TRPA1基因敲除组(TRPA1-KO-DBTC组)7只和TRPV1基因敲除组(TRPV1-KO-DBTC组)10只,体重24~28 g。所有动物饲养及实验操作程序皆符合动物实验伦理委员会的有关规定,并经徐州医科大学动物伦理委员会批准。
1.3药物的配制 ①DNA 裂解液(A 液,pH=12):取 1.25 ml 浓度为 1 mol/L的 NaOH 和 20 μl 浓度为 0.5 mol/L 的乙二胺四乙酸二钠,总体积配到接近 50 ml,调节 pH 值到 12,再定容至 50 ml;②DNA 中和液(B 液,pH=5):取 2 ml 浓度为 1 mol/L,pH值为 8.0 的三羟甲基氨基甲烷加入双蒸水,配到总体积接近 50 ml,调节 pH 值到 5,再定容至 50 ml;③使用分析天平按每只小鼠大约需要240 μg称量DBTC并溶于95%乙醇溶液和甘油按2∶3比例配置的溶剂,稀释配成1 mg/ml的溶液,实验中使用的DBTC依据小鼠体重按8 mg/kg吸取所需的剂量。
1.4基因敲除和模型建立
1.4.1组织DNA提取 用耳标钳取微量小鼠组织,每管加入 45 μl 的 A 液,100 ℃加热 45 min后低速离心(1000 rpm),每管加入 45 μl 的 B 液,充分混匀后低速离心(1000 rpm),于4 ℃保存。
1.4.2引物序列 ①TRPA1-/-引物序列:Mutant Forward:CCTCGAATCGTGGATCCACTAGTTCTAGA-T,Mutant Reverse:GAGCATTACTTACTAGCATCCT- GCCGTGCC,Wild type Forward:TCCTGCAAGGGT GATTGCGTTGTCTA;Wild type Reverse:TCATCTG- GGCAACAATGTCACCTGCT;②TRPV1-/-引物序列:Wild type Forward:TGGCTCATATTTGCCTTCAG,Common:CAGCCCTAGGAGTTGATGGA,Mutant For- ward:TAAAGCGCATGCTCCAGACT。
1.4.3 PCR 过程及结果判定 2 x Taq 酶5.0 μl,上游引物0.5 μl,下游引物0.5 μl,DNA 提取液1.0 μl,雙蒸水3.0 μl,总体系为 10 μl。上述液体振荡混匀并短暂离心将管壁上的液体收到管底。将样品放在 PCR 仪中并启动反应:94 ℃ 4 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 50 s,30 个循环;72 ℃ 10 min延伸,完成后取出,琼脂糖凝胶电泳后检测信号,每个基因对应的两个目的条带分别显示阴性和阳性为基因完全敲除。
1.5建立CP模型 按前述分组,于未造模时将动物下腹部备皮,使用Von Frey纤维丝和热辐射刺激仪测定四组小鼠腹部机械痛阈和热痛阈得到基础值。按Helieh SOz等[8]的方法,WT-Vehicle组小鼠按体重灌注乙醇和甘油混合液(8 ml/kg)。分别在第1、7、14天对第WT-DBTC组、TRPA1-KO-DBTC组、TRPV1-KO-DBTC组小鼠经口灌注配制好的DBTC溶液(8 mg/kg),体重明显下降视为造模成功。造模成功后第7天,再次测定四组小鼠腹部机械痛阈和热痛阈,两次检测实验室条件相同,均为室温20 ℃~23 ℃和相对湿度50%~60%测定记录数据。
1.6统计学分析 统计分析与作图采用软件Graph PAD 7.0,计量资料使用(x±s)表示,比较采用t检验,P<0.05为差异有统计学意义,P<0.01为统计学意义显著,P<0.001为统计学意义极显著。
2结果
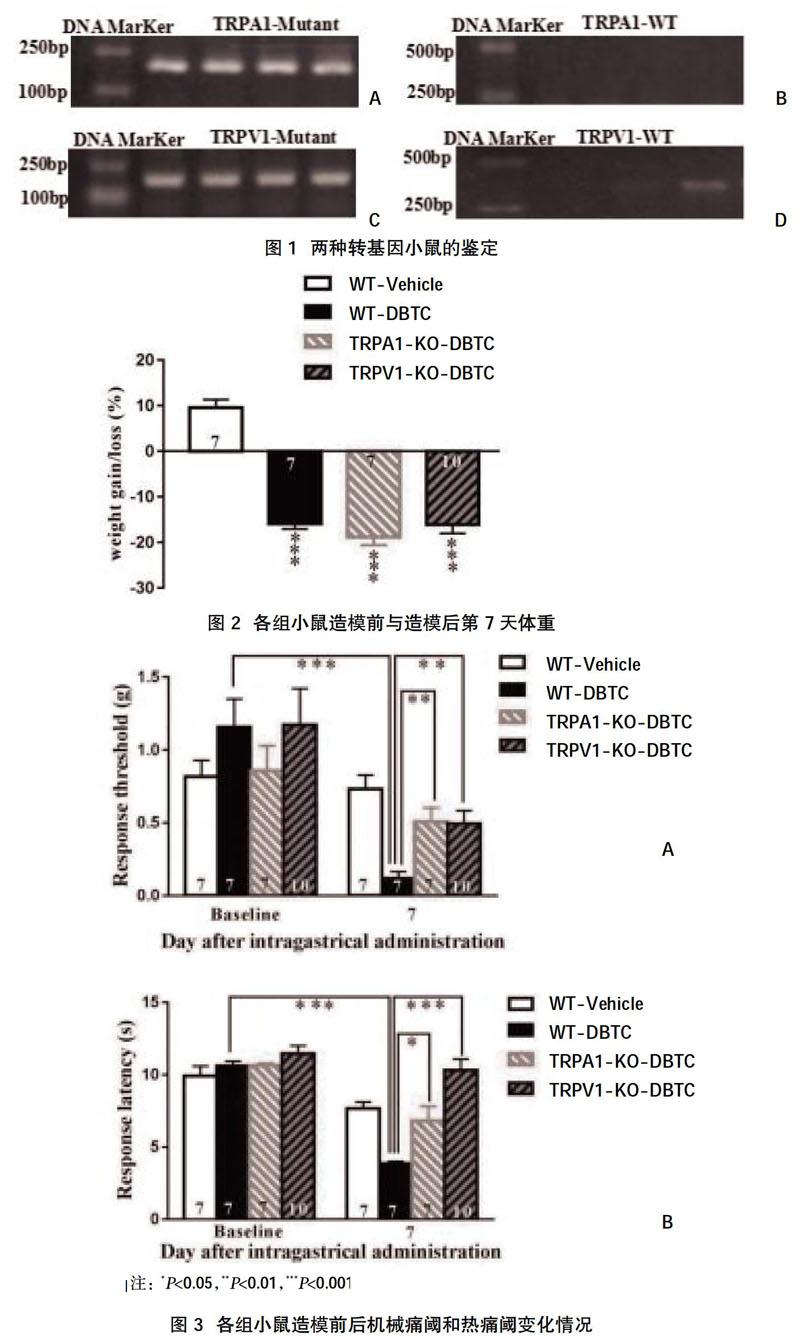
2.1两种转基因小鼠的鉴定结果 幼鼠基因组DNA琼脂糖凝胶电泳显示,TRPA1-KO-DBTC组小鼠的TRPA1-Mutant基因为阳性,目的条带为184 bp,见图1A;同时TRPA1-KO-DBTC组小鼠TRPA1-WT基因为阴性,目的条带为317,见图1B,证明该组小鼠为全身TRPA1基因敲除的纯合子小鼠。 同理,TRPV1-KO-DBTC组小鼠对应的两个目的条带分别显示为阴性和阳性,见图1C、图D,证明该组小鼠为全身TRPV1基因敲除的纯合子小鼠。
2.2各组小鼠造模前后体重变化情况 造模后第7天,与WT-Vehicle組相比,WT-DBTC组、TRPA1-KO-DBTC组、TRPV1-KO-DBTC组小鼠体重下降(P<0.001),见图2,表明CP模型建立成功。
2.3全身敲除TRPA1和TRPV1通道对CP诱发的机械痛敏和热痛敏的影响 WT-Vehicle组相比,WT-DBTC组小鼠腹部机械痛阈下降[(0.82±0.26)g vs(0.12±0.05)g](P<0.001),见图3A;造模成功后第7天,与WT-DBTC组相比,TRPA1-KO-DBTC组和TRPV1-KO-DBTC组小鼠腹部机械痛阈升高(0.12±0.05)g vs (0.48±0.14)g vs(0.47±0.17)g](P<0.01);造模成功后第7天,与WT-Vehicle组相比,WT-DBTC组小鼠腹部热痛阈显著下降[(9.91±1.68)s vs(3.87±0.35)s](P<0.001),见图3B;与WT-DBTC组相比,TRPA1-KO-DBTC组小鼠腹部热痛阈升高[(3.87±0.35)s vs(6.82±1.42)s](P<0.05),TRPV1-KO-DBTC组小鼠腹部热痛阈升高[(3.87±0.35)s vs (10.32±2.30)]s(P<0.001),见图3B。
3讨论
CP作为一种发病机制尚不明确的慢性炎症,其伴发的疼痛症状极大影响病人的生活质量。目前,CP的动物模型主要有外科手术经胆管灌注三硝基苯磺酸[8],尾静脉注射DBTC[9]等方式,均有明显的副作用。本实验通过DBTC灌胃的方式,对动物伤害较小,造模成功率较高,较为简便易行。
在本实验中,野生组小鼠在CP过程中均不同程度出现了机械痛觉过敏和热痛觉过敏的现象,即在正常的机械刺激或热刺激条件下即可出现疼痛反应行为,这可能与长期慢性疼痛导致的中枢敏化机制有关,该机制包含了多种蛋白乃至突触层面的改变[10]。本实验中TRPA1或TRPV1基因缺失的小鼠在患CP后触诱发痛现象相比于正常小鼠不明显,说明在正常小鼠中,TRPA1和TRPV1通道参与慢性炎症疼痛的传导,TRPA1或TRPV1基因缺失对CP引起的疼痛具有一定的抑制作用,可以减轻慢性炎症疼痛的刺激。但较造模前相比,TRPA1或TRPV1基因缺失的小鼠机械痛阈仍有所下降,说明可能还存在其他参与CP疼痛传导的通路,TRPA1或TRPV1基因缺失只能导致疼痛的减轻而不导致疼痛完全消失。同时,TRPV1基因缺失的小鼠在患CP后对热刺激的敏感性并未升高,而正常小鼠患CP后对热刺激的敏感性明显升高,说明TRPV1基因缺失能够在CP条件下改变热痛觉的传导。由于TRPV1通道在炎性疼痛和热痛的传导中都具有重要作用,因此,TRPV1通道缺失在CP疼痛中的具体作用仍需要进一步研究。
TRPA1和TRPV1通道作为TRP通道家族的成员,高表达在伤害性感受相关的中小直径触及感觉神经元中[11]。在组织炎症或神经损伤时,可在局部炎症介质如缓激肽、前列腺素、神经生长因子和ATP等刺激下发生功能敏化,并且导致背根神经节中降钙素基因相关肽等疼痛相关物质表达量增加[12,13]。同时,在炎症中被激活的蛋白激酶A(protein kinase A,PKA)等也可激活TRPA1和TRPV1通道[14]。目前已有多项研究通过基因敲除的方式研究TRPA1和TRPV1通道在不同疾病中的作用[15,16],同时,有研究表明基因敲除和受体阻滞两种方法各有优势,在很多情况下实验结果并不相同,甚至相差甚远[17]。在本实验中以转基因动物作为实验对象,最大限度的消除TRPA1和TRPV1通道的作用。在今后的实验中,可以通过特异性在外周神经系统敲除TRPA1和TRPV1两种基因的表达,更好地证明这两种通道在痛觉传导方面的作用。
综上所述,CP引起的疼痛会引起小鼠对机械刺激和热刺激的反应阈值降低,出现痛觉过敏现象。TRPA1和TRPV1通道在CP疼痛中具有调控作用,TRPA1通道缺失可以引起慢性炎症小鼠对机械刺激的痛觉过敏减弱,TRPV1通道缺失可以引起慢性炎症小鼠对机械刺激和热刺激的痛觉过敏减弱。
参考文献:
[1]Faillie JL,Azoulay L,Patenaude V,et al.Incretin based drugs and risk of acute pancreatitis in patients with type 2 diabetes:cohort study[J].BMJ,2014(348):g2780.
[2]屈琳林,易湘,孙红玉,等.急慢性胰腺炎免疫反应的研究进展[J].解放军医学杂志,2018,43(1):75-78.
[3]Basso L,Altier C.Transient Receptor Potential Channels in neuropathic pain[J].Current Opinion in Pharmacology,2017(32):9-15.
[4]Mcnamara CR,Mandel-Brehm J,Bautista DM,et al.TRPA1 mediates formalin-induced pain[J].Proceedings of the National Academy of Sciences,2007,104(33):13525-13530.
[5]Utsumi D,Matsumoto K,Tsukahara T,et al.Transient receptor potential vanilloid 1 and transient receptor potential ankyrin 1 contribute to the progression of colonic inflammation in dextran sulfate sodium-induced colitis in mice:Links to calcitonin gene-related peptide and substance P[J].Journal of Pharmacological Sciences,2018,136(3):121-132.
[6]Terada Y,Tsubota M,Sugo H,et al.Tacrolimus Triggers Transient Receptor Potential Vanilloid-1-Dependent Relapse of Pancreatitis-Related Pain in Mice[J].Pharmacology,2017,99(5-6):281-285.
[7]Oz HS.Multiorgan chronic inflammatory hepatobiliary pancreatic murine model deficient in tumor necrosis factor receptors 1 and 2[J].World J Gastroenterol,2016,22(21):4988-4998.
[8]Guleken Z,Ozbeyli D,Acikel-Elmas M,et al.The effect of estrogen receptor agonists on pancreaticobiliary duct ligation induced experimental acute pancreatitis[J].Physiol Pharmacol 2017,68(6):847-858.
[9]StSser S,Agarwal N,Tappe-Theodor A,et al.Dissecting the functional significance of endothelin A receptors in peripheral nociceptors in vivo via conditional gene deletion[J].Pain,2010,148(2):206-214.
[10]Ji RR,Nackley A,Huh Y,et al.Neuroinflammation and Central Sensitization in Chronic and Widespread Pain[J].Anesthesiology,2018,129(2):343-366.
[11]Weng HJ.Tmem100 Is a Regulator of TRPA1-TRPV1 Complex and Contributes to Persistent Pain[J].Neuron,2015,85(4):833-846.
[12]Wang XL,Cui LW,Liu Z,et al.Effects of TRPA1 activation and inhibition on TRPA1 and CGRP expression in dorsal root ganglion neurons[J].Neural Regeneration Research,2019,14(1):140-148.
[13]Pingle SC,Matta JA,Ahern GP.Capsaicin receptor:TRPV1 a promiscuous TRP channel[J].Handbook of Experimental Pharmacology,2007,179(179):155-171.
[14]Meents JE,Fischer MJ,McNaughton PA.Sensitization of TRPA1 by Protein Kinase A[J].PLoS One,2017,12(1):e0170097.
[15]Kemény,ágnes,Kodji X,et al.TRPA1 acts in a protective manner in imiquimod-induced psoriasiform dermatitis in mice[J].Journal of Investigative Dermatology,2018,138(8):1774-1784.
[16]Zhong B,Rubinstein J,Ma S,et al.Knockout of TRPV1 Exacerbates Left Ventricular Diastolic Dysfunction Induced by A High-fat Diet in Mice[J].Cardiovasc Hematol Disord Drug Targets,2018,18(3):215-223.
[17]Haruka H,Yuichi Y,Kanako S,et al.TRPA1 sensitization during diabetic vascular impairment contributes to cold hypersensitivity in a mouse model of painful diabetic peripheral neuropathy[J].Molecular Pain,2018(14):1744806918789812.
收稿日期:2020-04-25;修回日期:2020-05-25
編辑/肖婷婷
