一种改良盲肠结扎穿刺致大鼠脓毒症模型的方法
2020-09-04黎李俊杨国辉
黎李俊,杨国辉
1贵州医科大学临床医学院,贵阳 550001 2贵州医科大学附属医院内科ICU,贵阳 550001
脓毒症是指由感染引起的机体器官功能障碍并且伴有多种细胞因子和炎性介质的诱导、合成和释放的综合征[1],其发病机制尚未完全明确,病理生理过程复杂,致使脓毒症在临床上的病死率达到30%,而且其导致的多器官功能障碍(multiple organ dysfunction syndrome,MODS)的病死率高达50%[2- 3]。因此,建立适宜的脓毒症多器官功能障碍动物模型对研究脓毒症的病理生理机制,指导临床治疗具有重要意义。目前使用的大鼠脓毒症模型包括腹腔注射脂多糖模型、腹腔注射细菌模型以及经典的盲肠结扎穿刺(cecal ligation and puncture,CLP)模型[4]。CLP模型有类似于脓毒症患者的临床表现,并且对脓毒症病理生理过程有很好的模拟性,作为最广泛使用的脓毒症模型,被认为是研究脓毒症的金标准[5]。然而,在实际操作过程中,发现该模型仍不能达到研究要求,发生多个器官功能损害不是特别明显,死亡率低,且不符合脓毒症的临床预后[6]。据此,本研究尝试以CLP模型为基础,改进并建立更符合腹腔感染致脓毒症诱导的MODS动物模型,为进一步研究脓毒症引起的MODS的发病机制及预防奠定基础。
材料和方法
动物与分组健康SPF级雄性SD大鼠,96只,8~10周龄,体质量250~300 g,由贵州医科大学实验动物中心提供[SCXK(黔)2018- 0001],采用随机数字分组法分为假手术组、置管组、CLP组、CLP+置管组,每组24只。实验于贵州医科大学实验动物中心进行[SYXK(黔)2018- 0001],本研究经贵州医科大学实验动物伦理委员会批准(IACUC1900648)。
主要试剂与材料戊巴比妥钠(Sigma公司,美国),10%甲醛(南昌雨露实验器材有限公司,中国),苏木精、伊红(贵州吉创生物科技有限公司,中国),2 ml EDTA-K2抗凝管和2 ml肝素钠管(山东华博医疗器械有限公司,中国),留置导管(5.5号静脉采血针套管),普通离心机(上海安亭科学仪器厂),全封闭式组织脱水机ASP300(Leica公司,德国),全自动轮转切片机RM2255(Leica公司,德国),全自动染色封片一体机CV5020(Leica公司,德国),组织包埋机EG1150H(Leica公司,德国),恒温烤箱DRP- 9082(上海培因实验仪器有限公司,中国),光学显微镜CX31[奥林巴斯(中国)有限公司,日本],全自动五分类血液细胞分析仪BC6800(深圳迈瑞生物医疗电子股份有限公司,中国),BS- 380全自动血液生化分析仪(深圳迈瑞生物医疗电子股份有限公司,中国),白细胞介素(interleukin,IL)- 6、肿瘤坏死因子-α(tumor necrosis factor α,TNF-α)检测试剂盒(eBioscience公司,美国),血气分析仪ABL 80 FLEX(Radiometer公司,美国),血气分析试剂盒ABL 80 SC80(Radiometer公司,美国),4℃电冰箱(青岛海尔电器有限公司),-80℃超低温冰箱(SANYO公司,日本),低速离心机(安科生物科技有限公司,中国)。
模型制作以2%戊巴比妥钠按50 mg/kg腹腔注射麻醉大鼠,麻醉满意后大鼠无翻正反射,以碘伏常规消毒腹部区域,铺无菌洞巾,沿腹正中线作一长约1.0 cm纵行切口,用无菌镊探查并拖出暴露盲肠。假手术组:仅把盲肠拉出腹腔,然后还纳腹腔。置管组:把盲肠拖出腹腔,再还纳腹腔后在盲肠处横行置入5.5号静脉采血针套管一根。CLP组:在距盲肠盲端2 cm处用无菌4号丝线结扎盲肠,用20 G套管针将盲肠盲端贯通穿孔2次,避免损伤肠系膜及盲肠血管,挤出少许粪便后回纳腹腔,逐层缝合腹壁切口。CLP+置管组:在盲肠末端1/2处用无菌4号丝线将5.5号静脉采血针套管一并紧紧结扎在盲肠上,使其与盲肠呈“十”字型,然后用20 G套管针将盲肠贯通穿孔2次,避免损伤肠系膜及盲肠血管,挤出少许粪便后回纳腹腔,逐层缝合。术后各组大鼠均行皮下注射预热生理盐水5 ml补充手术中丢失的体液,并将其置于热垫上直至麻醉苏醒后送回饲养室正常饲养。
生存试验动态观察4组大鼠术后的病死率,观察时间为24 h[7]。
形态学检查4组大鼠均于术后24 h经腹腔注射2%戊巴比妥钠50 mg/kg麻醉后,常规开腹观察腹腔状况。取大鼠心尖部、左下肺、左肝中叶、左肾上极,除去大血管和结缔组织,分别取0.5 mm3各脏器组织投入10%甲醛中固定,各组织依次行脱水、透明、包埋、切片、苏木精-伊红染色后光镜下观察。
各脏器病理学评分标准
心肌组织损伤病理评分:包括炎性细胞浸润及坏死面积<25%计1分,25%~50%计2分,50%~75%计3分,>75%计4分。
肺组织损伤病理积分:共7项指标:(1)肺泡壁毛细血管扩张、充血;(2)肺泡腔内水肿液;(3)肺间质水肿;(4)炎细胞浸润支气管;(5)肺泡壁增厚变宽(炎细胞浸润或者纤维化);(6)肺间质出血;(7)肺泡腔内见红细胞;每项指标积分为无病变计0分,<25%计1分,25%~50%计2分,50%~75%计3分,>75%计4分。
肝组织损伤病理积分:共5项指标:(1)炎性细胞浸润;(2)肝细胞水样变形;(3)肝细胞脂肪变性;(4)肝细胞坏死;(5)肝窦扩张充血;每项指标积分为:正常、轻度视野范围≤25%计1分,中度视野范围25%~50%计2分,重度视野范围≥50%计3分。
肾组织损伤病理积分:共6项指标:(1)肾小管内皮细胞变性坏死;(2)肾小管上皮细胞水肿、空泡变性或颗粒变性;(3)肾小管扩张;(4)肾小球萎缩;(5)肾间质炎症细胞浸润;(6)肾间质出血;每项指标积分为无病变计0分,损伤面积<25%计1分,损伤面积25%~50%计2分,损伤面积50%~75%计3分,损伤面积>75%计4分。
血白细胞和血小板检测经2%戊巴比妥麻醉大鼠后,开腹取下腔静脉血1 ml置于EDTA-K2抗凝管中,用全自动血细胞分析仪行血细胞分析检测血白细胞(whole blood cells,WBC)和血小板(platelet,PLT)值。
IL- 6、TNF-α检测取下腔静脉血1.5 ml,离心后取上层血清,采用酶联免疫吸附法检测血清IL- 6和TNF-α水平,按照试剂盒说明书进行操作。
血气分析取腹主动脉血2 ml置于肝素钠管中,在血气分析仪上检测PaO2、pH及乳酸(lactic acid,LAC)水平,按照试剂盒说明书进行操作。
血清学指标检测采下腔静脉血2.5 ml,经3000 转/min(转子半径15 cm)离心7 min,取上层血清用血液生化分析仪检测肌钙蛋白T(troponin T,cTnT)、肌酸激酶同工酶(creatine kinase-MB,CK-MB)、丙氨酸氨基转移酶(alanine aminotransferase,ALT)、门冬氨酸氨基转移酶(aspartate aminotransferase,AST)、总胆红素(total bilirubin,TBIL)和肌酐(creatinine,CREA)、尿素氮(blood urea nitrogen,BUN)水平。
统计学处理所有数据经检验后均不满足参数检验的应用条件(正态性和方差齐性),因此本研究中的数据分析均采用多组独立样本比较的秩和检验,即Kruskal-WallisH检验,差异有统计学意义后(P<0.05),用Bonferroni法校正显著性水平进行组与组之间的两两比较,P<0.05为差异有统计学意义;本研究所有分析在SPSS 22.0统计软件下完成。
结 果
脓毒症病死率术后24 h,假手术组和置管组24只大鼠均存活,无病死率;CLP组19只大鼠存活,病死率20.8%;CLP+置管组11只大鼠存活,病死率54.2%。CLP+置管组病死率明显高于CLP组,差异有统计学意义(P=0.000)。
一般情况假手术组:大鼠清醒后可正常活动,12 h后未出现明显不良症状,少数大鼠出现竖毛,饮食正常,活动正常,无嗜睡,无蜷缩等;24 h后仍未出现病态症状,排尿约14 ml,排便排尿相比手术前24 h无减少;解剖发现腹腔未见明显渗液,肠管未见扩张,腹壁伤口处有网膜包裹,余脏器无明显改变。置管组:大鼠清醒后活动如常,12 h后未出现不良症状,近半数大鼠出现竖毛、饮食减少,活动如常,无嗜睡,无蜷缩等;24 h后仍未出现病态症状,排尿约14 ml,排便排尿较术前24 h无减少;解剖发现腹腔少许渗液,肠管无明显扩张,套管及腹壁伤口处有网膜包裹,余脏器无明显病变。CLP组:大鼠清醒后可正常活动,12 h后出现摄食减少、嗜睡、蜷缩、竖毛、活动减少等;24 h后多数大鼠存活,排尿约12 ml,排便排尿相较手术前24 h有所减少;解剖观察见腹腔少量渗液,轻微恶臭,肠管轻度扩张,结扎端盲肠肿胀明显,被网膜包被,与附近肠道黏连形成包块,大部分大鼠出现单个脏器(如肝脏、肺脏、肾脏)轻度充血,余脏器无明显改变。CLP+置管组:大鼠清醒后能正常活动,但未到12 h即出现逐渐加重的病态症状,活动减少,受刺激后无明显躲避动作,无进食,嗜睡、蜷缩、竖毛、腹胀显著,12 h内偶有死亡,12 h后死亡大鼠增多,排尿约9 ml,粪便稀薄,排尿较前明显减少;剖腹探查示腹腔内有大量脓性渗出物,恶臭,肠道明显扩张,结扎末端盲肠发黑并肿胀,有脓苔包裹,与周围肝、肾、小肠、膀胱、网膜等组织黏连成团,肺脏可见充血,肝表面可见出血点,多数大鼠见两个以上脏器充血出血。
脏器组织形态学变化及病理学评分
心脏:假手术组心肌细胞排列整齐,血管无扩张充血,未见炎性细胞浸润;置管组心肌细胞排列整齐,未见血管扩张充血,无炎性细胞浸润;CLP组心肌细胞排列尚齐,可见毛细血管充血,部分炎性细胞浸润;CLP+置管组心肌细胞排列紊乱,毛细血管明显扩张充血,纤维变性坏死,大量炎性细胞浸润(图1)。假手术组评分的中位数为2(n=24),置管组为3(n=24),CLP组为5(n=19),CLP+置管组为6(n=11),差异有统计学意义(H=57.770,P=0.000);其中,假手术组和置管组的病理学评分均低于CLP组及CLP+置管组(P均=0.000);假手术组与置管组、CLP组与CLP+置管组的病理学评分差异均无统计学意义(P=1.000,P=0.694)。
肺脏:假手术组大鼠肺组织结构正常,肺泡结构清晰,肺泡壁薄,未见炎性细胞浸润;置管组大鼠肺组织结构无异常,肺泡结构清晰,无明显炎性细胞浸润;CLP组肺泡周围血管腔明显扩张充血,纤维间隔增厚,部分炎性细胞浸润;CLP+置管组肺泡壁结构破坏,肺泡扩张融合,纤维间隔明显增厚,大量炎性细胞浸润(图2)。假手术组评分的中位数为1(n=24),置管组为1(n=24),CLP组为14(n=19),CLP+置管组为24(n=11),差异有统计学意义(H=62.983,P=0.000);其中,假手术组和置管组的病理学评分均低于CLP组及CLP+置管组(P均=0.000);假手术组与置管组、CLP组与CLP+置管组的病理学评分差异均无统计学意义(P=1.000,P=0.884)。
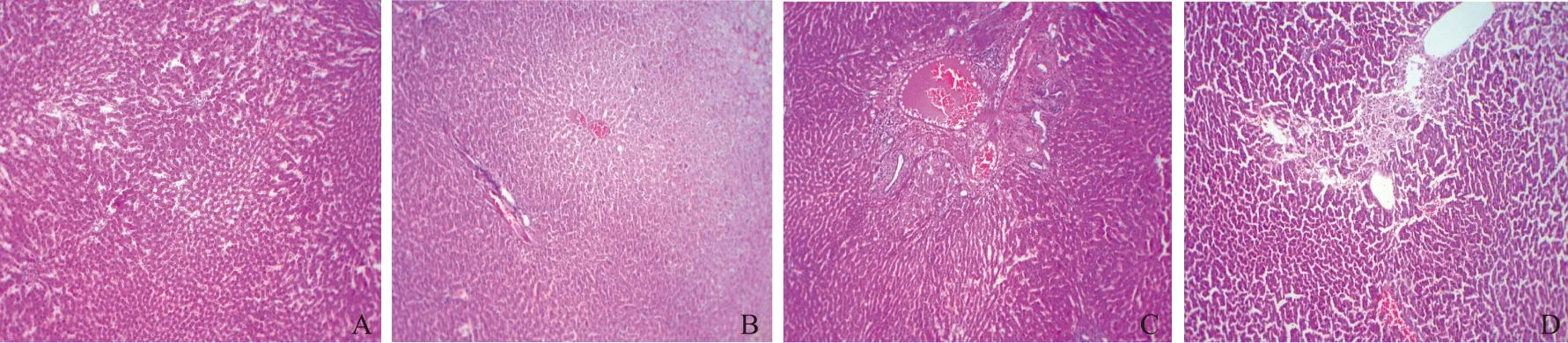
肝脏:假手术组大鼠肝小叶及肝细胞形态正常,汇管区未见炎性细胞浸润;置管组大鼠肝小叶形态正常,汇管区无明显炎性细胞浸润;CLP组少数大鼠肝细胞水肿,气球样变性,肝窦变狭,汇管区见少量炎性细胞浸润;CLP+置管组多数大鼠肝小叶结构不清,肝细胞广泛水肿,气球样变性明显,肝窦明显狭窄,汇管区见大量炎性细胞浸润(图3)。假手术组评分的中位数为5(n=24),置管组为7(n=24),CLP组为9(n=19),CLP+置管组为11(n=11),差异有统计学意义(H=62.827,P=0.000);其中,假手术组的病理学评分低于置管组、CLP组及CLP+置管组(P均=0.000);置管组的病理学评分低于CLP+置管组(P=0.001);置管组与CLP组、CLP组与CLP+置管组的病理学评分差异均无统计学意义(P=0.078,P=0.688)。
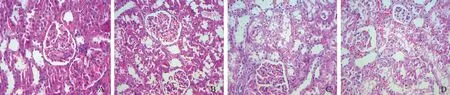
肾脏:假手术组肾小球结构正常,肾小管管腔完整,未见明显炎性细胞浸润;置管组肾小球结构正常,肾小管管腔完整,肾间质未见炎性细胞浸润;CLP组少数大鼠肾小球毛细血管扩张,肾小管上皮细胞空泡变性,灶性炎性细胞浸润;CLP+置管组肾小球毛细血管扩张、充血,肾小管上皮细胞水肿、空泡变性,可见肾皮质及间质大量炎性细胞浸润(图4)。假手术组评分的中位数为1(n=24),置管组为1(n=24),CLP组为9(n=19),CLP+置管组为13(n=11),差异有统计学意义(H=63.934,P=0.000);其中,假手术组和置管组的病理学评分均低于CLP组及CLP+置管组(P均=0.000)。
大鼠WBC和PLT水平
WBC水平:假手术组分别与CLP组(P=0.000)、CLP+置管组(P=0.000)比较,置管组分别与CLP组(P=0.000)、CLP+置管组(P=0.000)比较,差异均有统计学意义;假手术组与置管组(P=0.391)、CLP组与CLP+置管组(P=0.458)比较,差异均无统计学意义(表1)。

CLP:盲肠结扎穿刺术
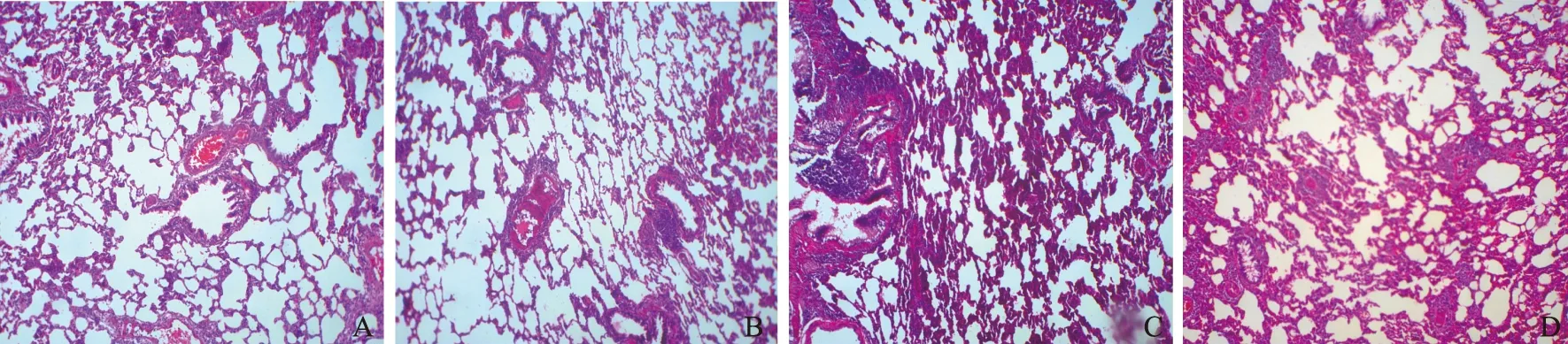
A.假手术组;B.置管组;C.CLP组;D.CLP+置管组
A.假手术组;B.置管组;C.CLP组;D.CLP+置管组
A.假手术组;B.置管组;C.CLP组;D.CLP+置管组
PLT水平:假手术组分别与CLP组(P=0.000)、CLP+置管组(P=0.000)比较,置管组分别与CLP组(P=0.000)、CLP+置管组(P=0.000)比较,差异均有统计学意义;假手术组与置管组(P=1.000)、CLP组与CLP+置管组(P=0.259)比较,差异均无统计学意义(表1)。
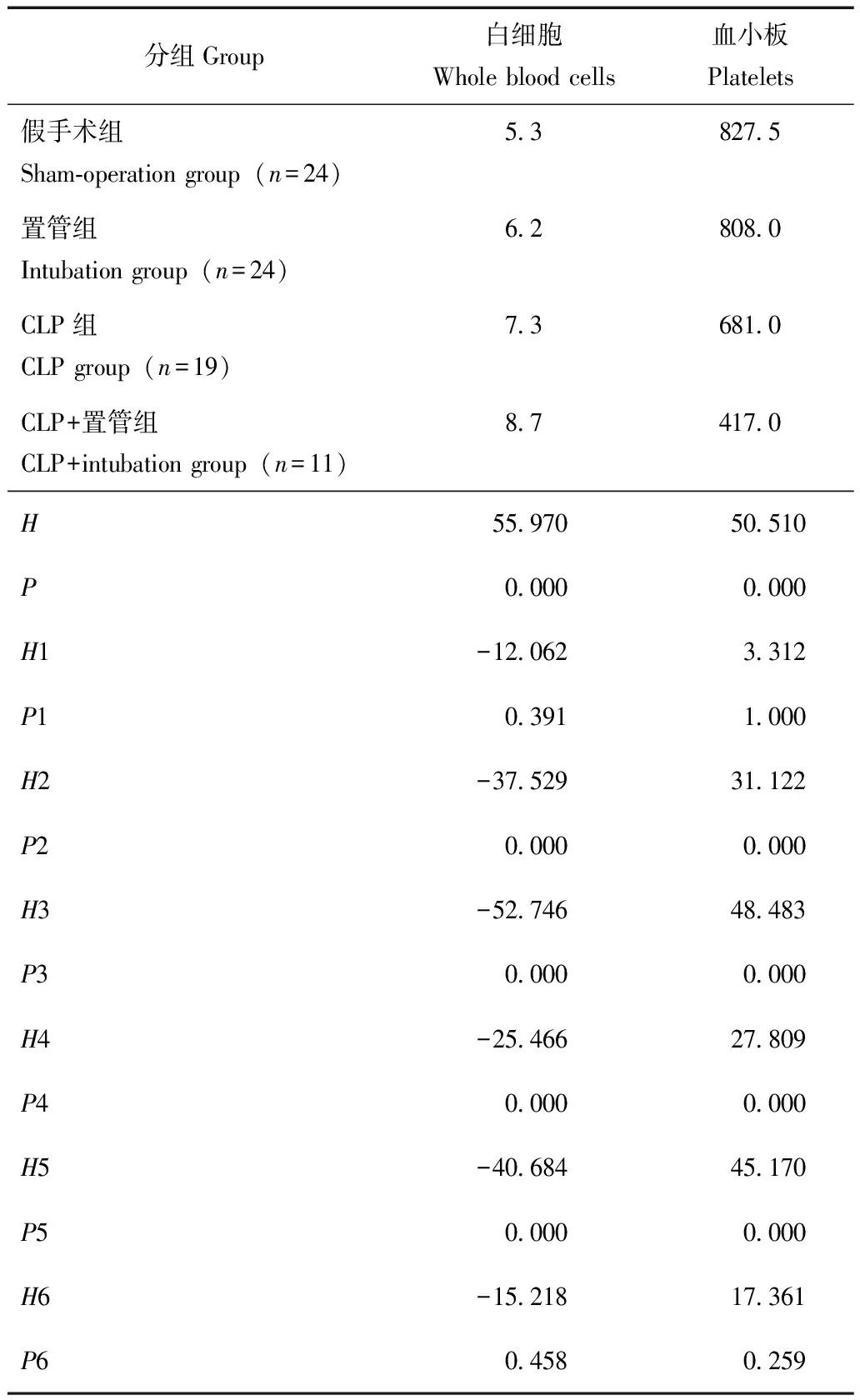
表1 4组大鼠血白细胞和血小板水平比较(中位数,G/L)
大鼠血清IL- 6、TNF-α水平
IL- 6水平:假手术组分别与CLP组(P=0.000)、CLP+置管组(P=0.000)比较,置管组分别与CLP组(P=0.001)、CLP+置管组(P=0.000)比较,差异均有统计学意义,而假手术组与置管组(P=0.346)、CLP组与CLP+置管组(P=0.484)比较,差异均无统计学意义(表2)。
TNF-α水平:假手术组分别与置管组(P=0.003)、CLP组(P=0.000)及CLP+置管组(P=0.000)比较,置管组分别与CLP组(P=0.009)、CLP+置管组(P=0.000)比较,差异均有统计学意义,CLP组与CLP+置管组比较,差异无统计学意义(P=0.484)(表2)。
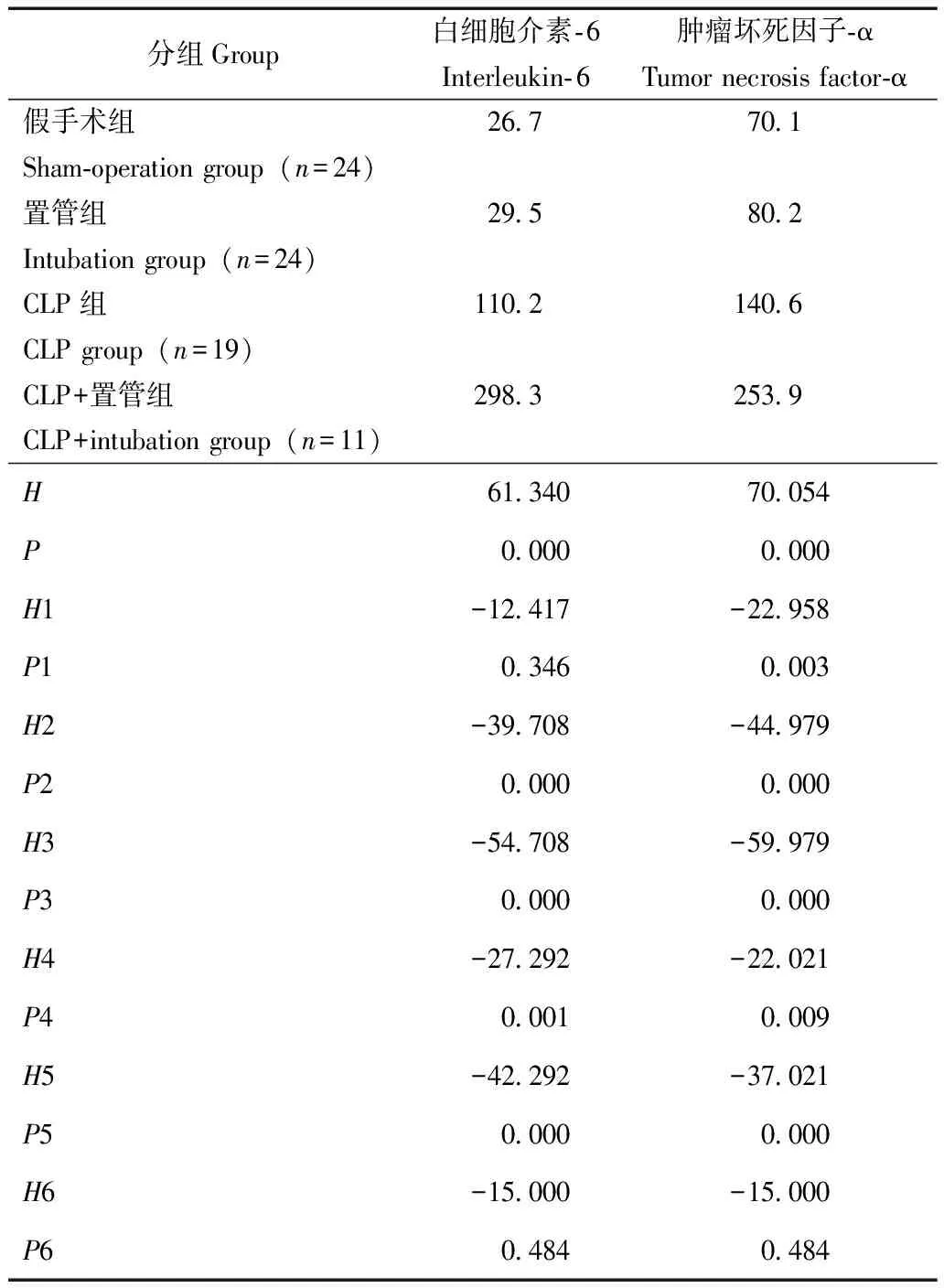
表2 4组大鼠血清白细胞介素- 6、肿瘤坏死因子-α水平比较(中位数,pg/ml)
血气分析的变化
pH水平:假手术组分别与置管组(P=0.023)、CLP组(P=0.025)比较,置管组分别与CLP组(P=0.000)、CLP+置管组(P=0.000)比较,差异均有统计学意义;假手术组与CLP+置管组(P=0.121)、CLP组与CLP+置管组(P=1.000)比较,差异均无统计学意义(表3)。
PaO2水平:假手术组分别与置管组(P=0.043)、CLP组(P=0.002)、CLP+置管组(P=0.000)比较,置管组分别与CLP组(P=0.000)、CLP+置管组(P=0.000)比较,差异均有统计学意义;CLP组与CLP+置管组比较,差异无统计学意义(P=0.501)(表3)。
LAC水平:假手术组分别与CLP组(P=0.000)、CLP+置管组(P=0.000)比较,置管组分别与CLP组(P=0.000)、CLP+置管组(P=0.000)比较,差异均有统计学意义,假手术组与置管组(P=1.000)、CLP组与CLP+置管组(P=0.487)比较,差异均无统计学意义(表3)。
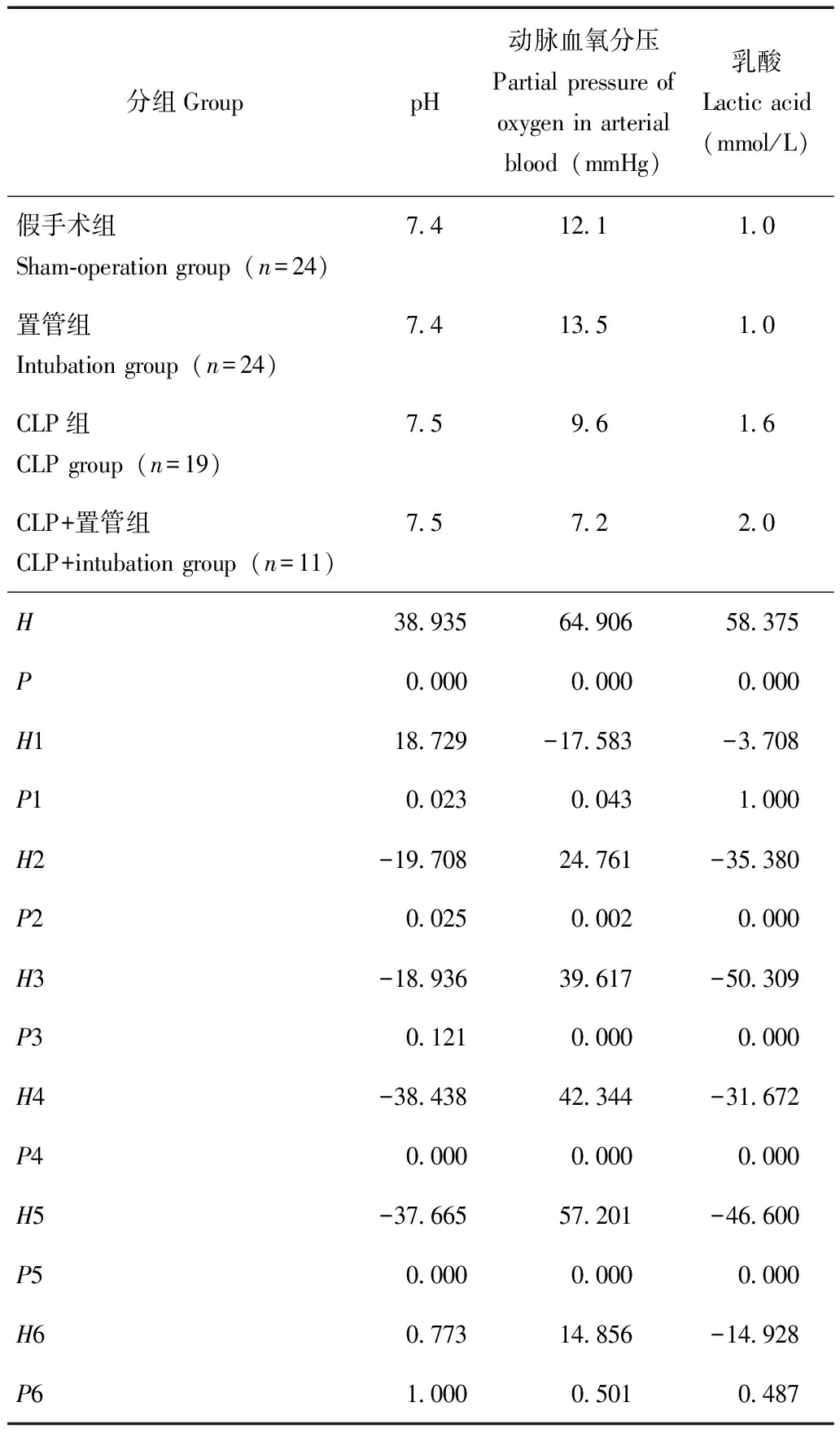
表3 4组大鼠血气分析比较(中位数)
大鼠血生化结果
CK-MB含量:假手术组分别与置管组(P=0.008)、CLP组(P=0.000)、CLP+置管组(P=0.000)比较,置管组分别与CLP组(P=0.006)、CLP+置管组(P=0.000)比较,差异均有统计学意义(表4)。
cTnT含量:假手术组分别与置管组(P=0.009)、CLP组(P=0.000)、CLP+置管组(P=0.000)比较,置管组分别与CLP组(P=0.005)、CLP+置管组(P=0.000)比较,差异均有统计学意义(表4)。
ALT含量:假手术组分别与CLP组(P=0.000)、CLP+置管组(P=0.000)比较,置管组分别与CLP组(P=0.000)、CLP+置管组(P=0.000)比较,差异均有统计学意义(表4)。
AST含量:假手术组分别与置管组(P=0.002)、CLP组(P=0.000)、CLP+置管组(P=0.000)比较,置管组分别与CLP组(P=0.011)、CLP+置管组(P=0.000)比较,差异均有统计学意义(表4)。
TBIL含量:假手术组分别与置管组(P=0.002)、CLP组(P=0.000)、CLP+置管组(P=0.000)比较,置管组分别与CLP组(P=0.012)、CLP+置管组(P=0.000)比较,差异均有统计学意义(表4)。
BUN含量:假手术组分别与置管组(P=0.007)、CLP组(P=0.000)、CLP+置管组(P=0.000)比较,置管组分别与CLP组(P=0.006)、CLP+置管组(P=0.000)比较,差异均有统计学意义(表4)。
CREA含量:假手术组分别与置管组(P=0.001)、CLP组(P=0.000)、CLP+置管组(P=0.000)比较,置管组分别与CLP组(P=0.012)、CLP+置管组(P=0.000)比较,差异均有统计学意义(表4)。
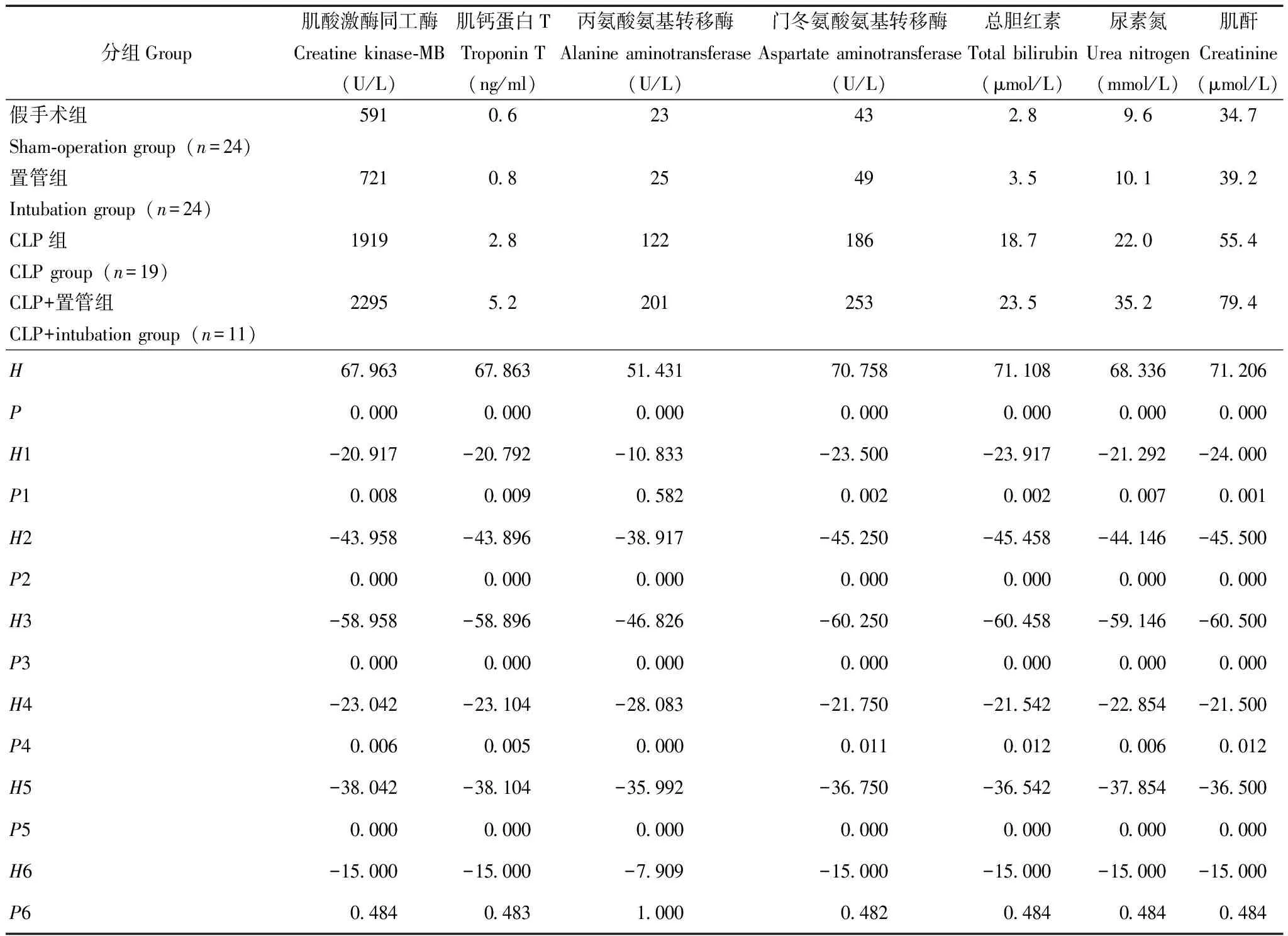
表4 4组大鼠血生化功能分析比较(中位数)
讨 论
脓毒症是机体对感染的反应失控而导致危机生命的器官功能障碍的全身性疾病,临床死亡率居高不下[8]。根据脓毒症的发病因素、病理生理过程以及临床特点,脓毒症动物模型必需具备以下基本要素:(1)具有高排低阻血流动力学以及高代谢状态的典型脓毒症表现;(2)存在多个器官功能障碍[9];(3)具有较高的自然死亡率,要求动物模型的自然死亡率达到50%~70%;(4)脓毒症是严重感染引起机体炎症反应过度激活而引起的自我损伤,不是细菌和内毒素对机体的直接伤害,因此,从脓毒症模型制备到出现器官功能障碍和动物死亡需要一定的时间[10]。如果器官功能障碍或死亡在造模后6~12 h后发生,一般是由全身炎症反应引起[11]。
CLP模型虽然被许多学者认为是研究脓毒症的金标准,但是也存在一些问题有待解决,如采取CLP法造模后大鼠全身炎症反应不重,未出现MODS[12]。大部分大鼠盲肠穿刺处被网膜和周围组织包被黏连成团块,盲肠的穿刺孔常因为盲肠水肿被堵塞,这些都不能有效地造成持续性腹腔感染状态,无法达到脓毒症动物模型的要求。而且盲肠的结扎长度对模型的预后有重要影响[13]。传统的CLP模型是由多种病原微生物感染引起的脓毒症模型,可引起与人类脓毒症相似的早期高动力性(高排低阻)及晚期低动力型(低排高阻)的血流动力学变化[14]。而腹腔持续置管引流模型模仿的是肠瘘的过程,腹腔内持续漏出肠内容物,但没有明显的缺血坏死病灶,其严重程度与支架的直径密切相关,但不足之处在于血流动力学反应特点不明显[15]。据此,本研究在CLP模型的基础上加入腹腔留置套管,通过将5.5号静脉采血针套管结扎在盲肠上,使其与盲肠呈“十”字型,可有效减少盲肠穿刺处被网膜和周围组织黏连包裹的状态,防止穿刺孔被堵塞,使盲肠内粪便可有效地流入腹腔造成持续性腹腔感染,而不致于粪便过少导致大鼠腹腔感染被局限化。本研究通过CLP模型加置管后即保留了传统CLP模型的血流动力学变化特点,也具备了腹腔持续置管引流模型有更强的炎症因子反应和更多的血液细菌数的特点。本研究结果显示,CLP组大鼠腹腔内感染病灶大多形成局部的炎性包裹,脏器水肿不明显,而CLP+置管组大鼠除了形成弥漫性腹腔脓肿以外,整个腹腔脏器都充血水肿明显。CLP+置管组大鼠腹腔感染更重,心肺肝肾组织炎性细胞浸润,出血更明显,CLP+置管组各脏器组织损伤病理积分均高于CLP组、假手术组和置管组;CLP+置管组血WBC、IL- 6和TNF-α均较CLP组升高,而PLT较CLP组下降;CLP+置管组PaO2低于CLP组,但LAC、pH均高于CLP组;CLP+置管组CK-MB、cTnT、ALT、AST、TBIL、CREA和BUN水平均较CLP组显著增高。表明CLP+置管组改良造模后大鼠全身炎症反应严重,出现心肺肝肾等重要脏器合并损伤,基本上出现多器官功能障碍,病死率高,符合脓毒症致多器官功能障碍综合征的病理生理过程及临床特点。
综上,本研究显示虽然两组模型均较好地模拟了脓毒症的病理生理机制,但CLP+置管组发生了明显的多器官功能障碍。运用CLP+置管组可以复制出更接近临床实际的腹腔感染诱发的脓毒症引起的多器官功能障碍的动物模型。但本研究仅关注造模后24 h脓毒症大鼠的情况,有待进一步动态观察不同时间点脓毒症大鼠炎性因子水平和脏器功能的变化,以明确其不同时期变化的原因。
