可视化超微通道经皮肾镜碎石术治疗儿童无积水肾结石的疗效分析
2020-09-03方晓亮黄云腾徐卯升徐国锋李约延张君颀张琪敏耿红全
方晓亮 黄云腾 徐卯升 徐国锋 贺 雷 李约延 张君颀 张琪敏 耿红全
据文献报道,过去20年美国儿童肾结石的发病率每年上升6%~10%,这项基于美国人口的观察性研究,估计儿童肾结石平均年发病率为36/10万~57/10万[1]。近年来,我国儿童肾结石的发病率也有明显上升趋势,尤其是新疆地域。儿童肾结石复发风险较高,及时评估和处理很重要,其总体目标是彻底清除结石,保护肾功能,减少对肾脏的损伤[2]。目前临床上治疗儿童肾结石常用方法有体外冲击波碎石术(extracorporeal shock wave lithotripsy,ESWL)、采用输尿管软镜的逆行肾内取石术(retrograde intrarenal surgery,RIRS)和经皮肾镜取石术(percutaneous nephrolithotomy,PCNL)。欧洲泌尿外科学会(European Association of Urology,EAU)小儿尿路结石指南推荐≥2 cm的多发性儿童肾结石以PCNL为一线治疗方法。本研究回顾性分析上海交通大学医学院附属新华医院2018年8月至2019年11月应用可视化超微通道经皮肾镜碎石术治疗14例儿童无积水肾结石的临床资料,评估其临床疗效及安全性。
材料与方法
一、临床资料
收集上海交通大学医学院附属新华医院2018年8月至2019年11月经可视化超微通道经皮肾镜碎石术治疗的14例无积水肾结石患儿病例资料,病例纳入标准:鹿角形结石、单颗结石≥2 cm、肾盂肾盏内多发结石、ESWL治疗无效的肾结石,同时患侧肾盂分离前后径≤10 mm;排除标准:肾结石合并有肾盂分离前后径>10 mm、患有心血管疾病及出血性疾病且术前控制效果不佳者;合并泌尿系统狭窄畸形者;未接受治疗或未控制的急性尿路感染者。所有患儿家属同意并签署手术知情同意书后实施手术治疗。14例(15侧)无积水肾结石患儿,其中左侧6例,右侧7例,双侧1例;单发结石3例,多发结石11例。手术中位年龄为60.77个月,年龄范围为7~190个月,结石平均直径为(14.47±6.52)mm,范围8~30 mm。结石的平均CT值为(1 031.80±341.35)HU,范围498~1 951 HU。14例无积水肾结石患儿的具体临床资料见表1。
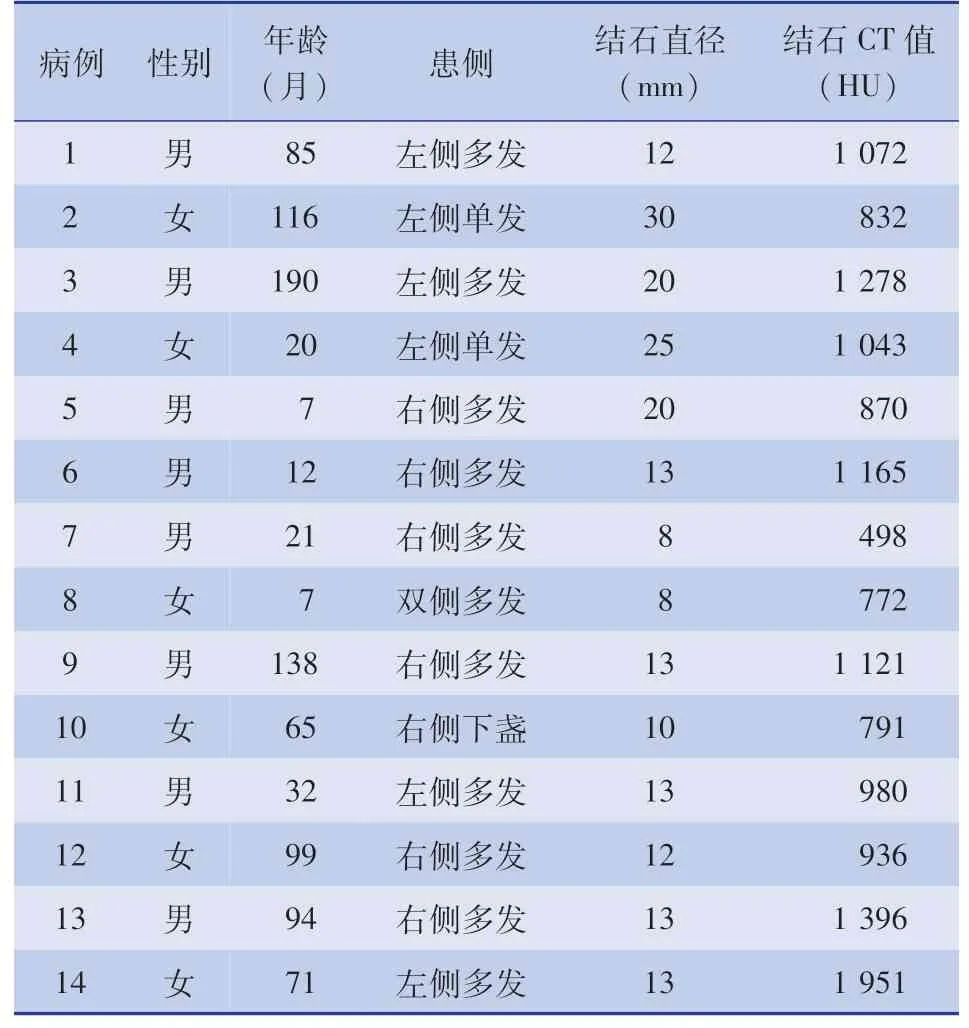
表1 14例无积水肾结石患儿临床资料Table 1 Clinical data of 14 children with nephrolithiasis without hydronephrosis
二、手术方法
手术均采用气管插管全身麻醉,患儿先取膀胱截石位,膀胱镜下向患侧输尿管插入4Fr或5Fr输尿管导管,退镜后膀胱内留置导尿管,并将输尿管导管和导尿管一并固定后,患儿改俯卧位,垫高腰腹部使腰背部平坦。
建立皮肾通道:穿刺点选择腋后线与肩胛下线之间第11肋间至第12肋下区域。从输尿管导管注入生理盐水,形成人工肾积水,经B超(西门子)引导确定穿刺角度和深度后,采用德国铂立Microperc®F4.8可视化穿刺针在直视下行目标盏穿刺。穿刺过程中从灌注通道注入生理盐水,通过外接摄像连接的显示器全程观察穿刺途径组织,穿刺成功后观察通道质量,将穿刺针留置肾盂肾盏最佳位置后拔除针芯,置入导丝,经穿刺点切开皮肤,采用筋膜扩张器从8Fr依次扩张至12Fr,留置12Fr一次性剥皮鞘并固定(图1)。经剥皮鞘置入8Fr德国铂立肾镜,找到结石后予钬激光碎石至3 mm以下,置入200μm或550μm的钬激光纤维,激光功率20 W(20 Hz/1.0 J)进行碎石,碎石随灌洗液经同一通道排出,术毕留置输尿管D-J管及12F肾造瘘管。术后第2天行腹部平片(plain film of Kidney-Ureter-Bladder,KUB)和超声检查查看有无残留结石,如没有结石残留则术后3~5 d拔除肾造瘘管,术后4周在膀胱镜下取出D-J管。术后采用腹部平片、超声或CT检查评估结石清除率,影像学表明结石完全消失或尿路残留碎片结石<4 mm则视为碎石成功。
三、资料收集
术前一般资料包括性别、年龄、左右侧以及结石负荷量等;手术及术后资料包括:皮肾通道建立成功率、手术平均时间、术中及术后并发症、术后血红蛋白下降值、术后平均住院天数、结石清除率等。Clavien-Dindo分级系统对术后的并发症进行分级,以Clavien gradeⅠ~Ⅱ为次要并发症,Clavien gradeⅢ~Ⅴ为主要并发症。
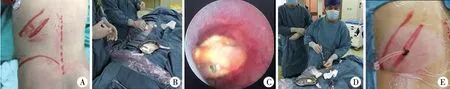
图1 可视化超微通道经皮肾镜碎石术 注 A:体位和穿刺部位;B:B超引导下穿刺;C:穿刺入目标盏,见结石;D:8Fr肾镜碎石取石术;E:经皮肾通道外观Fig.1 Visualized ultra-mini percutaneous nephrolithotripsy
结 果
所有患儿一次性成功建立皮肾通道,13例患儿单通道完成碎石、取石,1例鹿角形结石再辅助一F4.8极微通道进行碎石。平均手术时间(107.00±18.25)min,范围80~145 min。术后血红蛋白下降量(13.60±10.93)g/L,范围1~33 g/L,均未行输血治疗。术后平均住院时间(6.87±2.97)d,范围3~14 d。单次结石清除率80%(12/15),二期结石清除率93.3%(14/15)。其中1例患儿于术后1周复查KUB和超声均提示肾盂内有直径约8 mm的结石残留,辅助行ESWL治疗后结石完全清除;2例鹿角形结石负荷大需要分期手术,二期行PCNL后结石完全清除。14例患儿术后均出现不同程度的血尿(Clavien gradeⅠ),未予以特殊处理,1~3 d内自行缓解;2例术后出现发热(Clavien gradeⅡ),经血常规、血生化、尿常规和尿培养等检查后明确为尿路感染,对症治疗后好转;Clavien gradeⅠ~Ⅱ均为次要并发症。未出现感染性休克、大出血、肾集合系统穿孔、胸腹部重要脏器损伤等严重并发症。术后结石成分分析,单一草酸钙结石3例,草酸钙结石和碳酸磷灰石混合性结石5例,胱氨酸结石2例,单一碳酸磷灰石3例,尿酸和尿酸铵结石1例(表2)。术后平均随访时间(12.58±4.87)个月,范围6~22个月,仅有1例胱氨酸结石复发。
讨 论
儿童肾结石总体发病率低,但结石的自发排出率仅为34%~47%,且肾结石对处于生长发育期儿童肾功能的影响大于成人,这就意味着超过50%的儿童肾结石需要积极治疗[3]。相对成人,儿童肾结石大多数存在先天性代谢异常,尤其是原发性高草酸尿症和胱氨酸尿症,本组1例胱氨酸尿症患儿,术后11个月结石复发。儿童肾结石复发率和重复治疗率均较高,开放性手术往往会给二次治疗造成较大的影响,故儿童肾结石应优先考虑微创治疗。ESWL、PCNL和RIRS是目前临床治疗儿童肾结石的主要手段。ESWL作为<2 cm肾结石治疗的首选方法,PCNL被推荐为儿童肾结石直径≥2 cm和复杂性结石的一线治疗方法,尽管一次PCNL术后的结石清除率>85%,但在儿童这一类特殊群体中,对儿童较小的肾脏使用成人手术仪器行PCNL会增加术后相关并发症,尤其是出血[4]。与成人相比,儿童对血红蛋白下降更为敏感,严重的肾脏出血可能会导致早期终止手术和器官功能障碍,甚至死亡[5]。有研究表明,碎石通道的大小与术中、术后出血有关,使用更小直径的碎石通道可减少出血量和降低并发症发生率,但对结石清除率没有明显的影响[6]。Bilen[7]比较了26F、20F和14F Mini-PCNL这几种通道大小下的儿童PCNL,各组患儿的结石负荷、术后血红蛋白下降均无明显差异,然而26F、20F组有更高的输血率,同时14F Mini-PCNL组拥有90%结石清除率,相比较于26F组的69.5%和20F组的80%更高。本组一期结石清除率80%(12/15),二期结石清除率93.3%(14/15),与文献报道的超微通道PCNL结果相似[8]。但对于结石负荷较大的鹿角形结石,超微通道经皮肾镜碎石术存在结石清除速率下降,手术时间延长,增加了二期手术和并发症发生的风险,因此关于选取何种通道治疗儿童肾结石可获得最佳疗效,目前依然没有定论。任何碎石方式的选择都必须平衡结石清除率和手术并发症发生率之间的关系[9]。因此,探索可兼顾结石清除率和降低手术并发症风险的手术方式具有重要的临床实用价值。
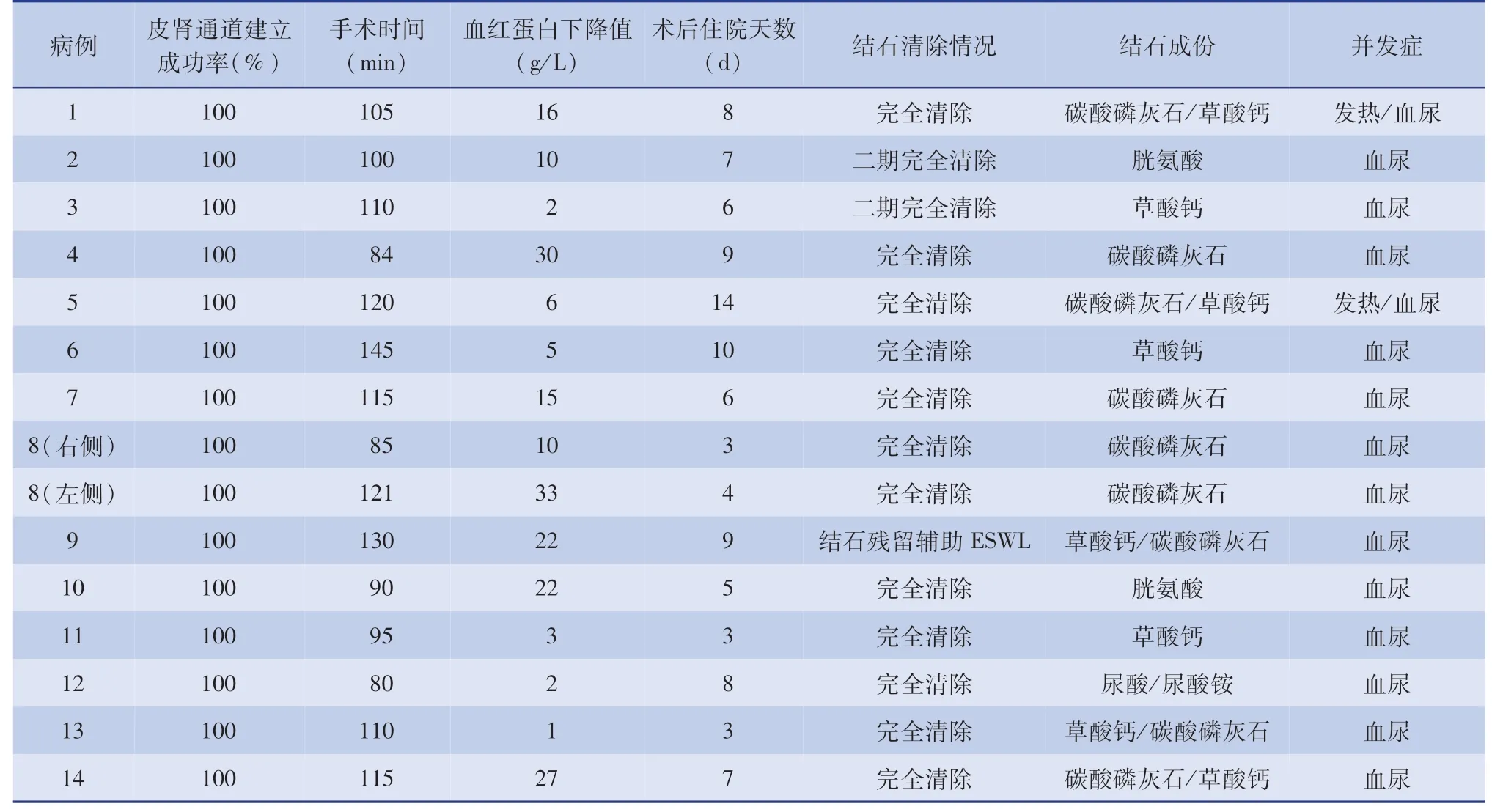
表2 14例无积水肾结石患儿手术及术后临床资料Table 2 Perioperative data of 14 children with nephrolithiasis without hydronephrosis
安全精准建立经皮肾通道是PCNL技术的关键一步,而儿童肾脏体积小、质地脆、肾脏活动度较大,这些都增加了精准穿刺的难度,尤其在肾脏无积水情况下,穿刺难度就更大。此外,穿刺可能会导致肾脏以及周围器官发生损伤、术后出血等并发症发生风险增高。可视化穿刺经皮肾镜是目前最微创的PCNL技术之一,最初由Bader等[10]报道了可视化穿刺针在行PCNL过程中建立穿刺通道,随后Desai等[11]报道在10例肾结石(3例为儿童)患者中使用该技术,术后1个月结石清除率为88.9%,术后无输血患者,并将该手术过程命名为Microperc,该手术的最大优势在于穿刺全程的可视化,从穿刺点皮肤到目标肾盏的穿刺过程中能清楚地显示每个穿刺平面,明确穿刺针在肾盂肾内的具体位置,达到精准穿刺,从而建立最佳的经皮肾通道。在儿童无积水肾结石的穿刺中,穿刺空间狭小,常规穿刺容易失败,而可视化穿刺系统全程可视,同时也可经输尿管导管向肾内注入美兰稀释液来引导精准穿刺,减少反复穿刺次数。本组病例均为一次性穿刺成功。
研究报道PCNL术后出血需要输血的发生率为5%~8%,需要血管介入栓塞治疗的比例为0.3%~1.4%,出血是影响PCNL手术进程以及患者生命的主要因素[12,13]。反复无效穿刺和因皮肾通道位置欠佳导致术中肾镜摆动幅度过大,从而增加了术中对肾脏的撕裂伤,增加了术中出血以及术后迟发性出血的风险。因此PCNL术后并发症的发生往往与手术通道的位置和大小有关。为了提高PCNL的安全性,目前已逐渐使用可视化穿刺、微通道、超微通道等进行手术。可视化穿刺系统可全程观察穿刺途径组织,可有效避免误穿、对穿,从而减少无效穿刺,减少对肾脏损伤。此外,针对鹿角形肾结石,在不增加额外超微通道或微通道的情况下,辅助F4.8可视穿刺肾镜直接碎石可最大程度地清除结石,降低出血和肾脏损伤等并发症发生率。可视化穿刺系统和超微通道PCNL同传统的PCNL相比能明显降低出血、肾脏以及邻近组织器官损伤的风险[14]。Yuan[15]比较了儿童超微通道和微通道经皮肾镜碎石,显示超微通道术后并发症、感染、出血等风险较微通道小。Dede[16]回顾性分析了39例超细经皮肾镜碎石术治疗的儿童肾结石临床资料,术后1个月结石清除率为87.1%,术后没有输血病例,术后肾绞痛(Clavien gradeⅠ)发生率为10.3%(4/39),术后发热2例(Clavien gradeⅡ)。作者认为超细经皮肾镜碎石术对于儿童肾结石的治疗是高效安全的,术中拥有较低的肾盂内压力是其优势之一。有研究提示,与RIRS相比,可视化穿刺超微通道PCNL在治疗肾脏下盏结石和<3 cm肾盂结石方面能明显提高结石清除率(83%~94%),并且不增加手术并发症发生率(4%~11%)[17,18]。本研究所有病例均一次性穿刺成功,可视化超微通道经皮肾镜碎石术后患儿血红蛋白平均下降了(13.60±10.93)g/L,范围1~33 g/L,部分可能存在容量稀释性血红蛋白下降,术后导尿管和肾造瘘管均无活动性出血,所有患儿未予以输血治疗,术后无Clavien gradeⅢ~Ⅴ并发症发生,这均说明可视化穿刺超微通道PCNL具有较好的安全性和有效性。
既往研究提示腔道内镜手术在处理肾结石后,患儿发生全身炎症反应综合征(systemic inflammatory response syndrome,SIRS)的发生率为8.6%~11.4%,如果不及时控制,部分患儿可进展为尿源性脓毒血症,甚至死亡[19,20]。研究报道,肾盂内高压、手术时间过长是腔道内镜碎石术后发生全身炎症反应综合征和尿源性脓毒血症的独立危险因素[21]。本组有2例鹿角形结石因碎石时间较长,术后出现发热,经抗感染治疗3 d后好转。虽然可视化超微通道经皮肾镜可达到良好的镜鞘比,保证了术中引流通畅,降低了手术过程中的肾盂内压,从而降低了术后感染和SIRS的发生率,但对于儿童鹿角形结石,超微通道经皮肾镜碎石术仍存在其局限性,其手术时间会明显延长,从而增加术后感染的风险,这点需要引起重视。
综上所述,随着穿刺技术和设备的不断改进与创新,经B超引导下行可视化超微通道经皮肾镜碎石术治疗儿童无积水肾结石是安全有效的,且可获得满意的结石清除率,值得推广。但本研究在设计上仍存在一定的缺点。首先,本研究仅为单中心回顾性研究,样本量也较小,在病例纳入过程中不可避免会出现选择偏倚;再者,由于随访时间不长,该术式对患儿远期肾功能的影响未能进行评估。
