二代基因测序在精神发育迟滞患儿中的应用价值
2020-09-02冯文科刘自强赖兰娣
冯文科 刘自强 赖兰娣
【摘要】 目的 分析基于二代基因测序技术的精神发育迟滞儿童相关基因的突变及位点分布, 探讨基因突变与精神发育迟滞儿童的关系及其临床应用价值。方法 选取精神发育迟滞患儿50例为研究对象, 均给予SNP-aCGH全染色体扫描, 结合临床表型对异常拷贝数进行分析, 找到致病区域及致病候选基因。将阳性病例(拷贝数异常)与阴性病例的一般临床表型进行统计学比较。结果 50例患儿中, SNP-aCGH阳性5例、SNP-aCGH阴性45例。SNP-aCGH阳性患儿的生长迟缓、内脏畸形、低出生体质量儿的比例分别为80.0%、40.0%、40.0%, 均高于SNP-aCGH阴性患儿的33.3%、8.9%、8.9%, 差异均具有统计学意义(P<0.05);SNP-aCGH阳性及阴性患儿的性别、年龄、全量表智商(FIQ)评分、特殊面容、惊厥史、家族史比例比较, 差异均无统计学意义(P>0.05)。50例患儿中, 携带致病或可疑致病的拷贝数变异(CNVs)阳性患儿5例, 检出率为10.0%, 其中4例(8.0%)携带亚端粒区CNVs, 1例(2.0%)携带非亚端粒异常CNVs。结论 除不同程度的智力低下外, 本组阳性病例几乎全部伴有生长迟缓, 部分病例伴有内脏畸形、低出生体重儿。亚端粒区域与精神发育迟滞密切相关, 但非亚端粒区域的突变可能导致疾病, 需要进一步研究。
【关键词】 精神发育迟缓;表型分析;二代基因测序
DOI:10.14163/j.cnki.11-5547/r.2020.22.093
我国是一个出生缺陷较多的人口大国, 也是世界上出生缺陷发生率较高的国家之一。随着环境污染和食品安全的加剧, 出生缺陷的发生率呈上升趋势。其中, 脑发育迟滞占出生缺陷的2%~3%, 不仅影响患儿的生活质量, 而且给家庭和社会带来沉重的负担。智力低下的病因复杂。据报道智力低下的病因未知。智力低下的病因尚不清楚, 这将影响进一步的干预。荧光原位杂交(FISH)非常耗时, 一次只能检测1个或多个已知的异常位点。多重连接探针扩增技术(MLPA)在单个反应系统中只能检测到50~100个基因位点, 其和FISH都不能在单个实验中检测到整个染色体。Illumina 二代测序平台可作为分析智力低下多基因突变的检测手段, 突变频率较高, 对临床遗传分子诊断具有一定的指导意义。
1 资料与方法
1. 1 一般资料 收集2018年6月1日~2019年10月1日本院精神发育迟滞患儿50例为研究对象。纳入标准:①格赛尔发展量表(Gesell)评分(0~6岁)或韦氏量表(Wechsler scale)评分(> 6岁)均<70分;②排除围生期窒息、感染、创伤、药物中毒等外部因素;③核型分析未见明显异常;④基因代谢串联质谱分析未发现异常;⑤排除脆性X综合征、脊髓性肌萎缩、假脂肪性肌营养不良、常见基因印迹病。特点:小头畸形、眼距宽、耳位低、耳扑动、鼻梁塌陷、鼻梁球根、短中或长中、下颌小、高弓、腭裂、突掌、指/趾短、指/趾端缺失、指/趾甲缺失或外形异常等;内脏畸形:中枢神经系统、心血管系统、气管、支气管、肺、排尿系统等器官有单发或多发畸形(1例以上为内脏畸形);生长迟缓(物理缺陷或生理缺陷):根据头围、身高、体重和健康的孩子在中国相同的年龄和性别, 偏差方法用于比较增长指数≤平均值标准差异被视为缺陷。
1. 2 智力评价 ①年龄≤6岁患儿采用北京格塞尔量表(Beijing-gesell scale), 由北京妇幼保健院统一印制, 适用年龄28 d~72个月。轻度智力残疾:55分≤发育商(DQ)≤75分;中度智力残疾:40分≤DQ≤54分;重度智力残疾:25分≤DQ≤39分;极重度力残疾:DQ <25分。②Wechsler scale评价年龄>6岁儿童智力水平(中国韦氏儿童智力量表修订手册)。轻度智力迟钝:55分≤FIQ≤69分;中度智力迟钝:40分≤FIQ≤54分;重度智力迟钝:25分≤FIQ≤39分[1]。
1. 3 检测方法 本研究经医院医学伦理委员会批准, 儿童监护人签字。采集外周血6 ml, 离心柱法提取DNA, SNP-aCGH (Agilent180K或Affymetrix Cytoscan750K)检测全基因组。主要步骤:①DNA酶切;②DNA荧光染色纯化、定量标记产品;③比较基因组杂交;④芯片扫描;⑤数据提取与分析。对阳性结果或疑似阳性结果儿童的父母进行FICH检测, 以确定新的突变或父母染色体异常[2]。
1. 4 拷贝数异常分析 参考在线人类孟德尔遗传疾病数据库(OMIM, www.ncbi.nlm.nih.gov/omim), 或与人类表型数据库(https://decipher.sanger.ac.uk)和PubMed數据库文献进行比较。在分析异常拷贝数的致病性、可疑致病性和多态性时, 参考标准为:①拷贝异常数失踪;②异常拷贝数的断点位于已知致病基因的内部, 符合表型的基因突变;③新增异常段> 3 Mb;④新的微删除或微复制具有致病性或可疑性;⑤无论> 1 Mb是否遗传或来源不明, 均可认为其具有致病性;⑥如果对健康人群中异常拷贝数有≥3项的研究, 则认为是多态性改变。携带致病因子或疑似致病因子的拷贝异常者为阳性。无拷贝数异常或多态病变者为阴性[3]。
1. 5 观察指标 比较SNP-aCGH阳性及阴性患儿的临床特点, 统计50例患儿的CNVs阳性检出情况, 并分析CNVs阳性患儿CNVs具体区域、起始部位、类型和来源。
1. 6 统计学方法 采用SPSS17.0统计学软件进行统计分析。计量资料以均数±标准差( x-±s)表示, 采用t检验;计数资料以率(%)表示, 采用χ2检验。P<0.05表示差异具有统计学意义。
2 结果
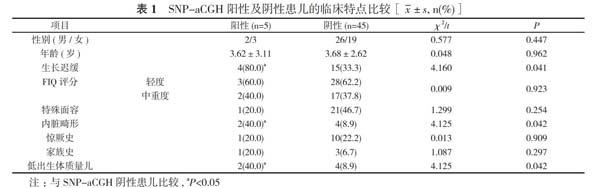
2. 1 SNP-aCGH阳性及阴性患儿的临床特点比较50例患儿中, SNP-aCGH阳性5例、SNP-aCGH阴性45例。SNP-aCGH阳性患儿的生长迟缓、内脏畸形、低出生体质量儿的比例分别为80.0%、40.0%、40.0%, 均高于SNP-aCGH阴性患儿的33.3%、8.9%、8.9%, 差异均具有统计学意义(P<0.05);SNP-aCGH阳性及阴性患儿的性别、年龄、FIQ评分、特殊面容、惊厥史、家族史比例比较, 差异无统计学意义(P>0.05)。见表1。
2. 2 CNVs分析 50例患儿中, 携带致病或可疑致病的CNVs阳性患儿5例, 检出率为10.0%, 其中4例(8.0%)携带亚端粒区CNVs, 1例(2.0%)携带非亚端粒异常CNVs。CNVs具体区域、起始部位、类型和来源见表2。
3 讨论
除了损伤、药物、感染等环境因素外, 精神发育迟滞多由遗传因素引起。遗传性精神发育迟滞具有高度异质性, 根据其发病机制可分为染色体数目或结构异常[4, 5]。不同染色体不同区域的异常拷贝及相关表型具有不同特征[6-9]。本研究发现, 50例患儿中, SNP-aCGH阳性5例、SNP-aCGH阴性45例。SNP-aCGH阳性患儿的生长迟缓、内脏畸形、低出生体质量儿的比例分别为80.0%、40.0%、40.0%, 均高于SNP-aCGH阴性患儿的33.3%、8.9%、8.9%, 差异均具有统计学意义 (P<0.05);SNP-aCGH阳性及阴性患儿的性别、年龄、FIQ评分、特殊面容、惊厥史、家族史比例比较, 差异均无统计学意义(P>0.05)。50例患儿中, 携带致病或可疑致病的CNVs阳性患儿5例, 检出率为10.0%, 其中4例(8.0%)携带亚端粒区CNVs, 1例(2.0%)携带非亚端粒异常CNVs。9p、3P、2p、15q、12p、22q、16p、17p等特异性区域对CNVs的发病机制具有特异性, 并将范围缩小至智力低下的发病基础。
综上所述, 采用SNP-aCGH作为精神发育迟滞大规模临床筛选的一线工具, 效率高, 分辨率高。SNP-aCGH不仅可以有效地缩小精神发育迟滞在染色体上致病基因的范围, 还可以为表型与基因型及发病机制的相关性研究提供良好的技术平台, 这是传统技术所不具备的优势。然而, 该技术无法检测到平衡反转、平衡移位、点突变、镶嵌异常, 待相关学者进行更加深入的研究。
参考文献
[1] 律玉强, 杨亚丽, 刘毅, 等. 二代测序技术确诊一例X连锁精神发育迟滞患儿. 中华医学遗传学杂志, 2018(2):257-260.
[2] 苏薇. 应用外显子组测序鉴定一个精神发育迟滞家系的致病基因. 中南大学, 2011.
[3] 张娜, 张伟, 张富昌, 等. NLGN3基因多态性与秦巴山区儿童精神发育迟滞的相关性. 基因组学与应用生物学, 2015, 34(2):
240-246.
[4] 刘晓芬. MTMR9与非特异性精神发育迟滞的研究. 西北大学, 2018.
[5] 魏春苗, 夏桂枝, 任榕娜. 47例不明原因婴儿期癫癎性脑病的基因突变分析. 中国当代儿科杂志, 2018, 20(2):125-129.
[6] 马玉平, 彭镜, 王颖,等. 60例不明原因早期癫癎性腦病临床特点及全基因组拷贝数变异分析.中国当代儿科杂志, 2014(11):
1100-1104.
[7] 刘毅, 董睿, 张开慧, 等. 一例以精神发育迟滞为主要临床表现的XYY综合征患儿的遗传学分析.中华医学遗传学杂志, 2016(33):689.
[8] 王宏蕾. 精神发育迟滞患儿临床干预1例.河北医学, 2015(11):
1935-1936.
[9] 游国岭, 张立辰, 张晓青, 等. 应用全外显子组测序技术鉴定
1个白化病家系致病基因HPS1.检验医学, 2017, 32(4):272-275.
[收稿日期:2020-01-16]
