恐龙的宏观进化与生态
2020-09-02黄大明郝明泽黄宇森R.B.J.Benson2
黄大明 郝明泽 黄宇森 R.B.J. Benson2

摘 要:恐龙作为鸟类的祖先是中生代(Mesozoic)的大型陆栖动物。是侏罗纪—白垩纪(Jurassic-Cretaceous)生态系统的重要角色。并且在生理、发育和繁殖上不同于现存物种。恐龙具有极大的结构多样性,并且其化石记录了向鸟类形态进化的过程。系统发育的研究为恐龙的宏观进化提供了新的研究角度,包括适应环境的体型进化,种间差异模式,鸟类和近鸟类特征的起源。探讨自然生态、生活史、恐龙生物特征对恐龙进化的影响一直是古生物学研究的前沿。
关键词:恐龙;宏观进化;生态;古生物学;系统发育
中图分类号:Q915 文献标识码:A 文章编号:1671-2064(2020)07-0212-09
0 导论
恐龙(Dinosauria)属动物界,脊索动物门,脊椎动物亚门,蜥形纲,双孔亚纲(蜥臀目、鸟臀目)。在中生代(距今约2.5亿年~距今约6500万年)的陆地生态系统中,恐龙种类十分丰富,且全球分布,具有明显的种群与群落多样性。恐龙起源于早三叠纪(Triassic)或中三叠纪(三叠纪距今约2.5亿~2亿年),是二叠纪(Permian,距今约2.9亿~2.5亿年)末期物种大灭绝后爬行类大爆发的主要时期。最古老的化石来自美国南部的卡尼阶地层(Carnian),距今约2.3亿年前[84]。根据早期分化和延绵长久的独立进化分支,分为3个大类:蜥臀目蜥脚亚目(Sauropodomorpha)、蜥臀目兽脚亚目(Theropoda)和鸟臀目(Ornithischia)。恐龙在三叠纪末期迅速发展,在早侏罗纪(Jurassic,距今约1.9亿~1.4亿年)遍布全球[81]。鸟类是现存唯一的恐龙,起源于兽脚亚目的一个类群。鸟类总群(crown-group)起源于白垩纪(Cretaceous,距今约1.4亿~6550万年),形成现有的约1万多种鸟类。是脊椎动物中的特殊类群。非鸟类恐龙(nonavian dinosaurs)生活的时间跨度达到至少1.64亿年,并在白垩纪末期灭绝。
对恐龙的各层面研究,近年来显著增多。一个包含了大约1250个物种中962个的大分枝树的建立[89],使得宏观进化中对脊椎动物适应辐射进化的系统发生研究成为可能[22,23,24,26,40,46,81,87,90,119,154,155]。因为化石的种系发生有很强的时间深度,使得宏观进化模式相比较仅用现存种群作为证据更加清晰[67]。恐龙同时也是理论生态学与营养模式的研究目标[54,63,101,108]。由于恐龙与其它哺乳动物物种间存在显著的不同。特别是其巨大陆栖卵生、大型幼体防御力弱、体型向巨大进化,也许在中生代陆地生态系统有重要作用[71,82,122,123,143]。恐龙巨大代谢速率应该在生态系统能量流动中占有重要地位,生活史中生长与繁殖的能量分配也值得研究。化石记录提供了在漫长时间尺度上认识全球生物区系的独特视角,但其提供的信息还是很不完整。大部分恐龙化石仅仅来自一些很小的考古挖掘点。是特定地质时间段上特定区域动物区系样本。在样本外,地球上大部分的生物区系在其它特定的时间段是未知的。另外化石保存与个体情况有关,因此总会有偏差存在[20,21,33,38,51,62,81,142]。
1 恐龙发展史简介
爬行动物中,在进化上与恐龙亲缘关系最近的有飞行的翼龙类(pterosaurs)和西里龙类(silesaurids)。恐龙与一些其它灭绝类群形成鸟类祖先所在的早期总群。图1:所有恐龙物种与鸟类的亲缘关系都比与鳄类(crocodilians)近。实际上,鸟类起源于兽脚类恐龙,而非鸟臀类恐龙,二者共同构成了大部分的鸟类分支主干(stem-lineage)[112,130,131,152]。
最早的恐龙是两足动物[84,130],绝大部分体重在10~30kg之间[23,26,84,130]。恐龙进化早期的生态差异由牙齿的差异体现出来[13,15,84,104,130]:早期兽脚亚目为肉食性,鸟臀目为植食性,蜥脚亚目为杂食性(蜥脚亚目后来也过渡为植食性)[14,122]。
在晚三叠纪灭绝中,恐龙表现出较高的存活率,而当时的许多其它大型陆栖脊椎动物灭绝,包括非哺乳的下孔类(nonmammaliamorph synapsids)和拟鳄类(noncrocodylomorph pseudosuchians)(哺乳动物和鳄类总群的早期分化种类)[81]。这些观察结果支持机会模式论(opportunistic model),即恐龙在早期侏罗纪的地理分布和局部丰盛度迅速增加,与其它类群的灭绝相关[27,37,130]。在早侏罗纪,由于潜在竞争者灭绝释放出生态空间,提高了大型兽脚类的丰盛度[110]。恐龙在晚三叠纪灭绝中存活的原因可能是良好的运动适应性[32]和高水平的新陈代谢[8]。尽管Brusatte等人(2008)没有发现侏罗纪早期的恐龙表型差异迅速增加的证据[37],但越来越多的证据表明这实际上是恐龙表型适应辐射的关键时期。例如,鸟臀目恐龙首次出现在早侏罗纪[12],种类从双足小型异齿龙类(Heterodontosaurids)(<5kg)到四足装甲的大型甲龙类(Scelidosaurus)(645kg)。同时,蜥脚类恐龙体型范围也迅速扩大[97]。
侏罗纪和白垩纪恐龙的表型差异巨大。这一时间段内产生多种特征的起源,例如四足行走[17],巨大体型[23,26,46,130],以及植食性动物一系列用于碾磨的牙齿特征[14,147]。在兽脚亚目中,与鸟类亲缘关系最密切的恐龙的脑容量以及其它似鸟特征经历了多次平行的增长[10],同时它们进行了飞行或飞行行为的进化。这些进化包括具有四翼的旁类动物(paravians),如小盗龙(Microraptor)和近鸟龙(Anchironis),具有蝙蝠状翼膜(wingmembranes)的擅攀鸟龙类(scansoriopterygids),以及具有鸟状翅膀的尾综骨类(pygostylians)[151,153]。尾综骨类包括现存的鸟类,它们拥有许多优越的飞行适应能力,以及小體型(见下4.1节)。通过目前的研究,尾综骨类被称为鸟类(bird/avian)。
在白垩纪末期,非鸟类恐龙的灭绝在一定程度上是突然的,这与陆地和海洋上许多其它类群的灭绝相一致。许多证据表明,一个直径约为10公里的小行星的撞击是这次灭绝的原因[5]。然而,关于恐龙多样性在此之前是否就因受到长期环境变化影响而下降的争论仍在继续,包括印度德干圈(Deccan traps)的大陆洪水火山作用引起的变化[6]。这种不确定性是由于对晚白垩世恐龙组成(尤其是北美以外的恐龙)的样本不充分造成的。即使在最好的情况下,对恐龙化石记录的解析也不能解决短期事件,例如10万年间的多样性潜在性下降[5,38],这些争论可能还需要通过大量的实地勘查来解决。
虽然鸟类是兽脚类恐龙,但在物种丰盛度或表型差异上,不等于其它恐龙亚群。事实上,鸟类的适应辐射远远超过其它恐龙。它们是早白垩世鸟臀目祖先中最早出现表型进化和多样性特征[24,40]。有研究综述了鸟类中生代的适应辐射进化[106]。鸟类的生物学特征与其它现存的爬行动物具有根本上的不同。根据形态学[29]和分子遗传学[156],鳄类是鸟类现存亲缘最近的动物。然而,许多特征将鸟类与鳄类分开,包括内温、恒温、双足直立的附肢形态、有羽毛的表皮、飞行能力、高度发育适宜运动的头骨和小体型(现存物种中约为2g~156kg)[58]。这种转变发生在1.8亿年以前,始于鸟与鳄的分支进化(早三叠纪)[103],结束于晚白垩世鸟类冠群的起源[50,116]。非鸟类恐龙的化石记录提供了这一长期转变的证据,记录了鸟类的亲缘和行为特征在鸟类分支上的零碎进化组合。在先前的研究中,鸟类特征组合的模式被大量研究[112,152]。
1.1恐龙的新陈代谢、热生理学和生长
16世纪末在英国收集到第一批非鸟类恐龙化石。1824年被确认为巨型灭绝爬行动物遗骸[57]。随后Richard Owen(1842)将这类动物命名为恐龙[111]。他认为恐龙在身体结构上与其它爬行动物不同:体型大,骶骨强直(ankylosed sacrum),四肢形态独特。基于这些特征,Owen(1842年,见p.202)[111]认为恐龙是爬行动物中最接近哺乳动物。但恐龙是典型的外温爬行动物。Bakker及其同事(1974)认为:以上特征、四肢和腰带(girdles)的其它特征,表明其祖先直立、兩足站立、高耐力和活跃的生活特征。考虑到捕食者-猎物比率和快速生长率的骨组织学证据,恐龙应该是与鸟类或哺乳类相似的高代谢率内温动物[8,9,55]。
热生理学、生长和代谢率是恐龙生物学中的核心问题:根据它们在鸟类分支上的系统发育地位,恐龙可能包括类爬行动物(reptilelike)(外温动物;Owen 1842[111])、近鸟类动物(bird-like)(内温动物;Bakker 1972[8])或在热生理学上处于中间的物种。事实上,关于这一问题有许多假设,而且所有恐龙不太可能都具有相同的生理特征[60,64,78,125,128]。热生理和代谢率不能直接在灭绝的动物体上观测。然而,可以根据生长停滞周期线和其它骨组织学观察,如纤维板层骨(fibrolamellar bone)的存在,所估计的最大生长率来推断[55,59]。纤维板层骨广泛分布于鸟类和哺乳动物中,但在爬行动物中很少见,通常被认为是快速生长的证据。
最新的共识是,即使是最早的恐龙也比其它爬行动物代谢率高,但恐龙和许多中生代鸟类的代谢率都低于现存哺乳动物和鸟类[59,71,113]。根据生长速率推断,蜥脚类的代谢率可能比哺乳动物高[71,125]。在包括西里龙和翼龙在内的恐龙的近亲中也发现了快速的生长率,这表明高代谢率特征在鸟类分支进化早期就已产生[59,103,1114]。在某些兽脚类恐龙身上出现密集的皮毛状原始羽毛,某种程度上也提供了内温动物的证据。这种保温的表皮是鸟类的羽状羽毛的进化前体,具有类似鸟类羽状羽毛的是似鸟龙类(ornithomimosaurs)和手盗龙类(maniraptorans)[152]。此外,鸟臀目恐龙[70,157]和翼龙[133]化石中的表皮丝状衍生物表明,在所有恐龙和翼龙的祖先之前,存在一种早三叠纪时期的内温动物共同起源的种类[70,157],尽管这些表皮结构存在争议[16]。
骨组织学表明,大多数恐龙都有确定的生长发育过程,类似于哺乳动物。恐龙的生长期可达3~55年[59],因此恐龙群体有较低比例的完全成年个体[59,122]。相比鸟类,恐龙产下的蛋与成年体型的比例更小。即使是最大恐龙的孵出幼崽(hatchlings)也只有几公斤重,而这些种类的个体发育会增加5个数量级的体重[122]。大范围体重变化引起的个体发育中生态位的变化会导致恐龙的生态位宽度比哺乳动物大得多[143]。
发育弹性(plasticity)在一些早期恐龙中很明显,具有非常广泛的成年体型分布范围[例如,在早期蜥脚类板龙(plateosaurus)中][124],并且个体发育具有高度变化的骨骼特征[例如,在兽脚类的腔骨龙类(coelophysoid)和西里龙类阿希利龙(dinosauromorphasilisaurus)中][72]。事实上,早期恐龙的发育弹性超过了现存的鳄类,这一特性可能有助于它们在晚三叠世灭绝中的存活[72]。在后来的恐龙,尤其是鸟类的个体发育速度极快,且具有特定形态[72]。
1.2恐龙群落异质性和进化限制
恐龙与哺乳动物的生态相似性很明显。这两类动物在陆地上体型庞大,具有与其它四足动物不同的特征,包括直立的后肢姿势、生长迅速、活跃和诸如放牧等社会行为[8,59,64]。然而,也有许多不同。例如,恐龙卵生,与哺乳动物相比,缺乏抚育后代机制。哺乳动物幼仔有社会性(juvenilesociality)[143]。由此会产生完全不同的生活史[82,143]和营养方式[121]。与鸟类一样,蜥脚类恐龙和兽脚类恐龙的颅后骨骼充满气体[22,107],这有助于局部密度的明显降低。例如,这促进了巨型蜥脚类颈部的极端伸长[121]。恐龙通过肺部的呼吸气流是单向的,与鸟类、鳄类和其它爬行动物一样[107,127],这可能比哺乳动物的潮汐式呼吸气流(respiratoryairflow)更有利于防止水分蒸发[22,122]。此外,和鸟类及其它爬行动物一样,恐龙可能以尿酸的形式排泄含氮废物,而哺乳动物则以尿素的形式排泄。与哺乳动物相比,这将帮助恐龙保持水分[78]。此外,大多数恐龙,包括早期的分类群,都有简单的用于切割的下颚,因此与几乎所有哺乳动物中都能看到的复杂咀嚼机制相比,恐龙几乎没有在口腔中处理食物[14,130,147]。这种成熟咀嚼机制的缺乏可能导致恐龙消化食物速度较慢。
宏观进化不仅需要解释发生了什么,还需要解释在群体进化过程中没有发生什么。令人惊讶的是,许多在新生代哺乳动物中反复进化的表型和生态特征,甚至包括大型哺乳动物进化出的特征,或许在非鸟类恐龙中根本没有进化[130]。我们还没有发现关于海生恐龙、胎生恐龙、或除了长期双足站立者(long-standing bipedality)之外的拇指与其它指相对的恐龙的证据[相反,在非手盗龙类(nonmaniraptoran)的兽脚亚目恐龙中,前肢的功能性退化反复出现],也没有发现真正的小型非鸟类物种(见第3.1节)。这引出了恐龙进化存在限制的问题,这可能其两足祖先,以及肌肉骨骼结构、与哺乳动物和小型爬行动物的生态竞争、或生活史和生态能量学有关。
对前肢的限制在四足恐龙的不同独立起源中是显而易见的,其中至少一种发生于蜥脚类中,三种发生于鸟臀目中[17,122,130]。其中,所有的四足鸟臀目恐龙和早期四足蜥脚类至少有一定程度的屈膝与功能不佳的前肢姿势[17,96,97]。这与蜥脚类和大型哺乳动物的旁矢状(parasagittal)、柱状直立前肢大不相同,后者能压缩性骨负荷被动、有效地支撑体重[121,122]。恐龙后肢的制约可能是由尾端肌肉与长尾巴的功能联系造成[69]。随着尾的退化和后肢肌肉的重组,这种制约在尾综骨鸟类中得到了释放,使鸟类后肢形态适应辐射进化[24,69]。
2 恐龙的体型
2.1最小体型限制
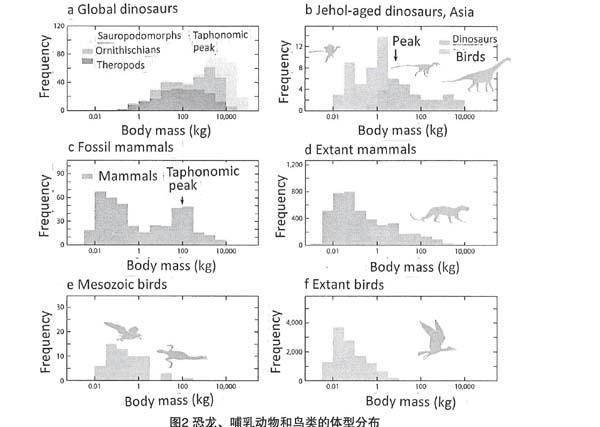
恐龙(包括鸟类)进化出的体重范有6.7个数量级(图2a)。这是在白垩纪中期,距恐龙起源1.3亿年的时间内实现的,跨度从蜥脚类中重达70t的巨大身躯[45],到中生代尾综骨鸟类中只有13g的极小体型[23,26]。除了鸟类以外,没有一种成年恐龙的体重小于400g(大约成年小型兔的重量),即便是来自保存了其它小动物(如鸟类、哺乳动物、蜥蜴)的沉积物。事实上,很少有非鸟类恐龙的体重低于750g,这是始祖鸟(Archaeopteryx)的大致体型[60,141],这一特点存在于若干独立的分支中,包括鸟臀目的异齿龙类(heterodontosaurid)[果齿龙(Fruitadens),730g][43]和多种兽脚类恐龙族群,尤其是手盗龙类[26,141]。在哺乳动物中,67%现存物种的重量小于750g,而在鸟类中,这一比例为90%[58,102]。因此,即使最小的非鸟类恐龙也占据了现存四足动物的较高体重范围区域(图2)。恐龙明显的最小体型制约很少受到关注。同样还有鸟类的最小体型制约。为什么恐龙最早的近亲可以比最小的恐龙小得多?马拉鳄龙(Marasuchus)的体重为260g[132]。
2.2 巨大体型
恐龙具有标志性的巨大体型,其中最大的超过任何陆栖哺乳动物,无论是现存的还是灭绝的。巨大体型恐龙的存在超越了陆栖脊椎动物体型的生理上限[1,7,122]。即使是两足恐龙,最大的兽脚类体量也与现存最大的哺乳动物相似[霸王龙(Tyrannosaurus),食肉动物,7.7t;恐手龙(Deinocheirus),杂食动物,7.3t]。此外,与哺乳动物相比,恐龙在群落具有更高的丰盛度和总重,可能是由于它们具有相对较低的代谢率[63,95]。现在大型动物是生态系统能量流的重要成分[35],而在过去很可能是恐龙[7,63,122]。在宏观进化上,大型动物种类较少,在一些大规模灭绝中[139],特别是在白垩纪末期的陆栖动物灭绝中,表现出较高灭绝率。所以,中生代被通俗地称为恐龙时代,然而,非鸟类恐龙种类比同期哺乳动物和非恐龙爬行动物少。在独立化石动物区系记录和区域物种丰盛度的估算中都很明显[21]。
分布在几个不同地区的最大鸟臀目恐龙,最高体重达17t(全部为食植动物),这与灭绝哺乳动物的最大体型相似(食草动物17t,食肉动物1t)[63,138]。蜥脚类动物的最大体重超过这一数值,达70t[1,45,123]。直到过去的几百万年里,鲸类[须鲸(baleen whales),上新世-更新世(Plio-Pleistocene)以来]才平衡并超过这一体重[137]。这是采用骨骼的三维数字化体积测量模型以及四肢骨骼轴圆周(shaft circumferences)的比例关系分别独立显示。[巨大的两足兽脚类[44];巨型蜥脚类动物[45]]。
关于恐龙如何能够达到如此大体型的解释很受关注[1,121,122,123]。氣候和氧气浓度等环境因素与恐龙的体型变化无关[121,122],因此最近的解释集中于内在因素:(1)考虑到蜥脚类的重力作用(graviportal)、柱状附肢形态和四足骨骼的材质特性,支撑陆地上最大恐龙的身体质量并不存在特殊的生物力学困难[1]。(2)大型恐龙通过快速生长而不是延长寿命来获得巨大的身体重量[59,113,122]。进化中体型的增加主要是由生长速度的增加引起的,如哺乳动物和鸟类,而不是由生长时间的延长引起,如外温爬行动物[59]。(3)理论上,如果恐龙的新陈代谢率与哺乳动物一样高,那么由于大型动物(表面积与体积比较低)的缓慢散热率而导致的过热可能是一个问题。但如果它们像爬行动物一样,则可以具有中等的新陈代谢率(至少与成人一样),或者在其它方面具有与哺乳动物相比更有效的蒸发散热机制[1,122,123,128]。(4)蜥脚类主要依靠胃发酵来消化食物,而哺乳动物和一些鸟臀目动物则必须使用研磨咀嚼[122]。由此产生了大型哺乳动物的巨大头部和鸟臀目动物的颈部活动限制,这意味着它们在觅食过程中必须移动整个身体。因此,移动巨大身体的高能耗会形成体型的上限[123]。在没有咀嚼的情况下,蜥脚类在巨大体重上保持着小比例的头部,这使其具有长而灵活的脖子。长颈可能大大降低大型蜥脚类觅食的能耗,使其冲破最大体型的能耗限制[122,123]。(5)卵生使得繁殖率与体重成正比,而哺乳动物则成反比[82]。再加上高生长速率,这使大型恐龙种类在环境干扰中得到快速恢复,因此与大型哺乳动物相比,它们的灭绝率可能会更低[82,121]。巨型恐龙种类幼体是食肉动物丰富的猎物资源,更易捕获。相比之下,哺乳动物中的大型食草动物会更好的抚育后代[95]。因此,大型食肉恐龙比大型的食肉哺乳动物具有相对更多的猎物[79]。(6)地球早期资源丰富,早期生长速度应该会更快。
2.3恐龙体型的频率分布和保存偏差
体型大小涉及生理学、生活史、生殖、生物力学(biomechanics)和资源生态等关系[34,139]。因此,体型的频率分布及其起源进化一直受到宏观生态学的关注。在现存的脊椎动物中,体型的正偏频率分布是普遍存在的,甚至体重转换成对数也是如此[34,80,139](图2d,f)。解释这种模式涉及到生态位可用性差异,这种差异允许在较小的体型下维持更大的物种多样性[80],通过生长和繁殖能量分配的权衡,最大化生活史过程中的生殖适应性[34],决定于环境资源[36]。
一些学者结合恐龙生物学和生活史异质性认为:中生代生态系统中异常的体型频率分布,源于大型恐龙丰富的幼体生态竞争,导致小体型物种少见[54,108]。观测资料表明:全部恐龙典型体重为1~10t(图2a),包括少数种类的1~1000kg[54],并且呈负向倾斜[108]。然而,这种模式可能是由偏差造成的:体型较大物种的化石更容易保存下来。
在过去1000万年的北美哺乳动物化石中,10~100g的小体型的峰值对应于现存哺乳动物的代表性模式体重,其中包含1570个现存物种[102](图2c,d)。然而,化石记录的体形频率分布也显示了第二个峰值,约为30~100kg,这与现存哺乳动物的体形频率分布无关[3](图2c)。从表面上看,这一峰值表明人类大小的哺乳动物与啮齿动物大小的哺乳动物在过去的1000万年中具有相同的物种丰盛度。然而,今天只有166个物种占据了30~100kg的大小等级[102],最近的一项研究表明,更新世(Pleistocene)(132000至10000年前)有另外177个大型(大于10kg)哺乳动物物种灭绝[126]。现存哺乳动物和化石的体型频率分布之间的明显差异不能用最近的大型动物灭绝来解释:即使所有灭绝的大型动物物种都正好在30~100kg的范围内,而且没有任何较小体型的物种灭绝,这仍然意味着与化石记录中的大型哺乳动物相比,小型哺乳动物物种丰盛度下降至实际的20%。
恐龙的分类较难从碎片残骸中辨认出来,至少部分原因是它们的牙齿比哺乳动物的牙齿简单[62],而且恐龙丰富保存的临界值相比哺乳动物出现在更大的体型上(恐龙超过1000kg)[33]。这一点已经由厚头龙(pachycephalosaurs):产于晚白垩世的北美和亚洲的小型鸟臀目(约16~370kg)的化石记录说明。厚头龙类拥有坚固的颅骨穹隆(skulldomes),其保存潜能与大型恐龙骨骼相似。这些穹隆产生的化石记录的数量是其它厚头龙化石的5~6倍[62],这表明小型恐龙物种的采样不足在规模上与小型哺乳动物相似。
兽脚类恐龙,尤其是手盗龙类,在小体型上经历了极大的多样化[141],很明显,小型兽脚亚目动物的物种丰盛度比目前公认的要大得多:许多沉积物中富含大型恐龙化石,但只保存了稀少难寻的小型兽脚亚目动物的化石碎片[33,91]。早白垩世热河生物群(Jehol biota)和蒙古晚白垩世[主要是坎帕尼亚(Campanian)]生物群是例外,它们保存了相对完整的小型四足动物骨骼[158]。这些组合中的恐龙的典型质量约为10kg(热河生物群;图2b)和10~100kg(蒙古)[26]。这远远小于基于埋葬学的背景化石记录所显示的1~10t(图2a)。
显然,先前对恐龙宏观生态学的研究低估了小型恐龙种类多样性及其在生态上的重要性。到目前为止,很少有人尝试仔细地描述恐龙进化史上任何时候的化石组合中的体型-频率分布[33]。然而,这些特征对于验证中生代生态系统的生态与营养假说具有重要价值。
3 恐龙的表型进化
表型代表个体与环境相互作用的方式。差异性(disparity)依据不同程度的表型变化了解生物群占据的形态空间(morphospace)[66,148],这与生态多样性有着密切的关系,尽管不一定是直接的关系。表型差异随时间变化,这些变化在化石记录中很明显。对许多化石群的分析显示,差异性在早期显著增加,随后饱和或逐渐减少[66]。这一发现符合表型进化的胁迫模式模型[41,74],也符合随时间推移而降低的进化速率(例如,early burst模型[76])。如果表型进化不受制约(这可能是罕见的),差异性通常应该随着时间的推移而增加。如果宏观进化速率更高,这些增长將会更大,导致更多的表型差异出现。相反,灭绝会导致差异减小,特别是当灭绝对特定的类群或表型具有选择性时。探讨这些机制如何随时间推移而促成可见的差异模式,是系统发育古生物学的一个核心目标,对研究宏观进化理论和鸟类等主要类群的起源都具有重要意义。系统发育的知识可以帮助我们使用系统发育比较法检验表型分化的机制:一类利用系统发育信息确定表型进化与物种多样性等的速率和模式的定量方法[115]。在过去的十年中,对恐龙的差异性和表型进化的定量研究已很普遍,经典假说得到验证,对恐龙进化产生新的理解。例如,拟鳄类和恐龙的差异性在三叠纪晚期都有所增加,这一观察结果被用作证据反驳恐龙在三叠纪/侏罗纪界线之前就已经在竞争中使拟鳄类趋于灭绝的假说[37]。这些研究运用不同数据类型、模式研究宏观进化:如适应辐射、进化趋势、环境胁迫,和创新进化。
3.1兽脚类、鸟类和扩散特征
最初构造用于系统发育分析的扩散特征矩阵已用于几项恐龙差异性和特征进化的研究[37,39,40,87]。有人认为其比连续的形态测量数据集更有效地描述表型进化[87]。Brusatte等人(2014)和Lee等人(2014)都量化了兽脚类恐龙,包括中生代鸟类,沿系统发育分支的扩散特征进化速率[40,87]。虽然他们的数据集是独立汇编,但两项研究都发现,高比率的特征变化表明:在兽脚亚目手盗龙类存在特别的差异性。与手盗龙类早期表型快速分化的适应辐射相一致。当系统进化遇到以前未被占据的适应区,包括未被占据的生态位群时,会发生适应辐射。随着物种多样性的增加,促进快速表型分化,两者都随着生态位的填满而减速[134]。其它研究也很好地支持了手盗龙类适应辐射的假说,表明手盗龙类经历了高频率的食性转换[13,154],附肢具有多功能生态形态[24],并且在体型的数量级进化上也经历了高频率转变[23]。
尾综骨鸟类(鸟类)可被视为手盗龙类适应辐射进化的一个潜在的特殊产物[23]。然而,其结构特征状态并不具备与表型一致的进化模式:Lee等人(2014)发现鸟类的进化速率与其它兽脚类动物相似[87],而Brusatte等人(2014)在鸟类中发现异常高的进化速率[40]。由于结构特征矩阵有主观性,他们最多只能有一个是正确的。系统分支进化速率的升高表明:(a)与其它恐龙相比,鸟类具有突出的进化新表型和生态特征的能力;或(b)研究兴趣的异质性导致鸟类中识别出的可变特征状态比其它恐龙更多。
早期鸟类扩散特征高进化率假说[40]与其异常的分支发生率[24],与其它兽脚类相比快速和相对不受制约的后肢比例和功能的进化[24],以及对鸟类的颅骨、下颌和牙齿的高度差异性[105,106]一致。
关于兽脚类骨骼形态测量学研究很多。如颅骨形态[31]、附肢比例[24,99]、附肢长度[56,117,150]。这些工作很大程度上是为了研究鸟类起源,并确定鸟类特征的模式,如前肢长[56,99,117],较小体型[26,141],颅后骨骼空腔[22],以及鸟类头骨雏形的起源[31]。这些发现补充了早期对非鸟类恐龙的近鸟特征状态集合中镶嵌现象的定性描述[112,152]。
3.2 植食性恐龙
植食性在兽脚亚目中进化了多次,在早期鸟臀目和蜥脚亚目中则至少各进化过一次。并非所有的植食性恐龙都是一样的。例如,植食性兽脚类经常进化为无齿(缺少牙齿)并具有很大的用于磨碎食物的胃[154];植食性的蜥脚类和一些大型鸟臀目恐龙[剑龙类(stegosaurs),甲龙类(ankylosaurs)]偏重于胃的发酵作用,并且牙齿复杂性低[14];其它的鸟臀目类群,尤其是异齿龙类、禽龙类(iguanodontians)和角龙类(ceratopsids),进化出复杂的牙齿或齿系(dentalbatteries),以及口腔中特殊的食物加工模式[14,104]。恐龙的植食性特征获得顺序在独立分支中相对固定[14,154]。有学者认为:恐龙肉食性或杂食性祖先群体胁迫性进化为高纤维植食性动物[14]。可能与哺乳动物的植食性进化过程类似。植物进化和陆生植物区系组成的主要变化发生在恐龙进化史上,特别是被子植物(angiosperms)(有花植物)在白垩纪的起源并多样化。许多研究通过比较恐龙和植物进化中主要事件的发生时间[19],分析恐龙和植物群的古地理发生[42],以及记录牙齿形态和其它特征的主要变化[93],研究恐龙和植物协同进化。尽管如此,植物和恐龙进化之间紧密结合的证据基本上还没发现。这表明恐龙与植物间的协同进化如果存在,就会是一个复杂扩散的过程。研究发现:恐龙下颌骨轮廓形状的差异随着时间的推移而稳定增加,符合扩散和无制约的进化模式。相反,生物力学差异在植食性恐龙进化的早期就已经饱和。从晚侏罗世开始,它显示出一个基本平坦,并叠加短期波动的长期模式。早期的植食性恐龙类群与晚期类群具有相同、有限的进食功能。只有很少例外[93]。表明功能性状的进化比形态学其它方面受到更多制约[93]。
3.3恐龙体型的进化
巨型恐龙(大于1t)是由重达约30kg的祖先在许多群体中独立进化出来[131]。通常被视为独立進化分支随时间发生体型增大的倾向[98]。然而,定量的系统发育研究表明,在恐龙中,体型增大的多向趋势是罕见的或不存在的[23,26,46,155]。此外,一些恐龙,特别是鸟类,体型较小,这表明群体中体型进化模式复杂且可能存在差异。
在区域性系统发育上积累的差异性相对较小,观测到的差异在早期迅速增加,随后饱和[66]。是生活史对策受到制约。环境迅速变化,使进化稳定性对策不断变化,导致体型、体重数量级的剧烈变化。例如,岛屿侏儒恐龙(islanddwarfdinosaur)的偶然或爆发式的进化。鸟类等表型上不同的群体的起源[26]。因此,恐龙和其它生物体的大多数表型差异,可能仅仅是少数进化爆发的结果,而不是环境胁迫进化过程中差异的稳定积累。
在进化上,恐龙体型变化很大。一种变化是体型较小的祖先,约10~30kg,另一种是体型较大,多吨重[26]。前者体型随着时间的推移而不断增大。如在新生代哺乳动物[2],类似于Stanley(1973)[139]提出的Cope规则(或Deperet 规
则)[23,73,74,94,139]。后者大体型的祖先转变到更小体型的区系很少见,一般与如下类群相关:异齿龙类(750g~5kg)和早期角龙类[如,鹦嘴龙(psittacosaurus),4.6kg]等小型植食恐龙分枝;与岛屿侏儒恐龙[如,侏罗纪蜥脚类欧罗巴龙(europasaurus),1t;白垩纪禽龙类查摩西斯龙(zalmoxes),190kg];和起源于兽脚亚目动物中的手盗龙类与近鸟类[23,26,117,141]。从小型到更小的像鸟一样的体型(10~100g),源自于早白垩世的一次独特转变:从始祖鸟大小的近鸟类(约750g)下降到比进化史上所有其它最小体型恐龙都小的转变[26]。
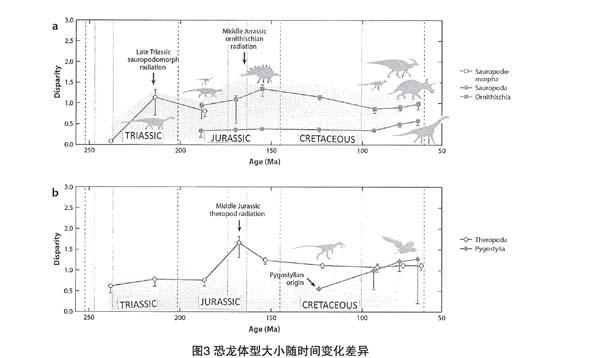
将表型进化概念定为在罕见、在缓慢或更受制约环境背景下发生的巨大变化的产物,这种变化可能对体型以外的性状有影响[76,134,145]。例如,鸟类头骨[65]。系统发育中的体型变化是恐龙进化的重要方面[26],可能与物种多样性的主要事件相关。蜥脚类在三叠纪经历了一系列转变,其体型差异在三叠纪晚期和侏罗纪早期达到最大(图3a)[96]。鸟臀目在中侏罗纪早期也发生了类似的变化,并产生了大多数的主要类群(异齿龙类、甲龙类、禽龙类、角龙类)(图3a)。同样的情况也发生在中侏罗纪的兽脚亚目中,产生出体型较小的手盗龙类和早期的近鸟类,以及重量大于1t的斑龙类(megalosauroids)和异特龙类(allosauroids),并为白垩纪早期的小型化尾综骨鸟类的适应辐射进化奠定基础(图3b)。此外,与其它恐龙不同的是,兽脚亚目恐龙在整个进化史中持续经历着越来越多的这种转变,这表明兽脚亚目身体形态的进化多样性更大,尽管其原因尚不清楚[23]。
4 恐龙的多样性与多样化
表型或功能差异、物种丰盛度都是生态系统的特征。有学者认为物种丰盛度可能受到生态位可用性的制约[80]。如果正确的话,在地质年代跨度上发现的相对受限的古生物多样性变化模式可以解释为不同物种个体间在生态时间尺度上的负相互作用,特别是竞争[129]。
多样化描述了物种丰盛度随时间的变化。净多样化率等于物种形成率减去灭绝率[129],可以是正的或负的,负的比率意味着物种丰盛度下降。如果物种灭绝率的增加与物种形成率的增加完全平衡,物种灭绝率的增加也可能导致零净变化率。这种情况,是高物种更替率随时间改变物种的种类,而不改变物种的总体丰盛度。
物种形成率和灭绝率可以通过化石物种的出现和消失率来估算。Lloyd等人(2017)根据古生物学数据库(https://paleobiodb.org)中明显的范围分布,估计这些比率平均为0.935/my(意味着物种平均持续时间为74万年)[77,89]。
Sakamoto等人使用广义线性混合模型研究恐龙多样化率的长期模式(称为净物种形成率[119]),发现恐龙在白垩纪/古近纪(Crataceous/Paleogene,K/PG)边界之前有长达5300万年的负多样化率(即多样性下降)。这一发现与估计的随时间推移的长期多样性变化模式不一致,传统模式不会在边界前有如此长期的多样性下降。造成这种差异的原因尚不清楚。可能:多样化描述了丰盛度的变化,是一个重要的宏观进化参数。但丰盛度本身是群落特征。
4.1有多少种恐龙
现有研究估算曾经存在的非鸟类恐龙的总数[例如,3400个物种[118];1844个可发现物种[146]]。晚马斯特里赫特阶(LateMaastrichtian)处在白垩纪末大灭绝事件之前,其跨度仅为280万年,在地理分布上,是恐龙进化取样最广泛的时间段之一。通过对非鸟类恐龙研究,估算出当时地球上有628到1078个恐龙物种。这意味着有更多的非鸟类恐龙物种(在静态总丰盛度和中间物种持续时间为700万年的假设下,侏罗纪-白垩纪约有12000到21000个恐龙物种)。恐龙瞬时丰盛度值仅略小于当今地球上恐龙大小的哺乳动物的数量(1107种哺乳动物超过750g)[86,102]。
4.2空间偏差的解决方案:恐龙的多样性随时间变化
一些研究就已经估计了恐龙的全球多样性随时间的相对变化模式[18,88,90,140]。这些研究已经恢复了长期多样性与短期波动叠加的静态或逐渐增加的模式。事实上,就四足动物而言,大多数地区的中生代地层中的化石数量很少或为零[51],大部分侏罗纪和白垩纪化石来自北半球的古温带纬度[51]。空间偏差较大。因此估算中生代地层的全球物种丰盛度十分困难。已有晚侏罗纪和白垩纪大陆破碎导致全球陆地多样性变化的模式[144]。早侏罗世到晚白垩世和从晚三叠纪到晚白垩世的不具备飞行能力的四足恐龙[21,51]的基本静态(即,不扩散)区域丰盛度(图4b)。静态多样性模式只能由均衡(即,零)长期净多样化率产生,这表明早期恐龙进化过程中的高多样化率在其进化史后期下降[90]。
4.3 恐龙进化过程中的物种更替和多样化
长期以来,非鸟类恐龙多样性趋势中的停滞现象并不意味着它们的进化史上没有发生事情,也不意味着人们无法知道任何事情。事实上,三叠紀一定发生了恐龙多样性的初始扩散,而且这种初始多样化的时间在主要类群中有所差异[81]。在三叠纪,没有已确定的鸟臀目恐龙化石标本,而蜥脚亚目在三叠纪晚期则变得丰富和特化。此外,中生代还经常出现标志性的进化分支和大规模灭绝,特别是晚三叠世和白垩纪末期的灭绝[38,81]。随着时间的推移,持续脉冲式的更替共同改变了恐龙组成,而且恐龙内部的独立分支显示出突出的,高多样化率的爆发。物种多样性的爆发尤其盛行于恐龙早期历史(晚三叠纪-早侏罗纪)[90],例如,在鸭嘴龙科(hadrosaurid)和鸟臀目角龙类[68,119],以及早期鸟类[24]中。
如果在总多样性的均衡模型下,在较低的分类学水平上发生类群的大量更替或波动,那么在单独类群中频繁、突出的多样化脉冲的出现可以与非鸟类恐龙总丰盛度的静态长期多样性模型相协调。换言之,适应辐射可能很常见,但主要发生在取代旧类群的小尺度上。另一类适应辐射,即通过出现全新的、大的可适应区域将丰盛度在以前的水平上大大提高,可能不太常见[21]。然而,鸟类(尾综骨类)的起源和新生代(恐龙之后)哺乳动物的适应辐射可作为典型例子。
5 中生代鸟类的适应性辐射爆发对其它飞行动物的影响
最近出现的证据显示鸟类物种丰盛度的快速和突出的适应辐射远远超过了其它恐龙。鸟类是小型动物,骨骼脆弱,化石保存潜力低。它们的化石记录主要来自少数特殊的化石沉积[106]。其中,早白垩世热河生物群(距今1.307~1.2亿年)保存了最早的尾综骨鸟类。即使在进化史的早期阶段,鸟类也超过了热河生物群中所有其它恐龙的丰盛度(非鸟类恐龙共有31属37种)。在最后一次整理中, 38属44种鸟类得到记录[158],这是一个快速增长的数字:目前记录在古生物数据库的共有82属95种(https://paleobiodb.org;访问日期:2018年6月)。
早白垩世飞行适应能力很强的鸟类(即尾综骨鸟类)的起源对陆地群落具有变革性的重要意义。这一重要性可以从其它飞行动物类群:昆虫和翼龙的表型进化的化石记录中明显看出,它证明了生态相互作用对宏观进化影响的假说。昆虫起源于石炭纪,其进化史的前1.5亿年,即早白垩纪之前的大气中氧气浓度可以很好地解释它们的最大体型[49]。随后,昆虫的最大体型减小,并显示出与氧气浓度无关的静态模式;Clapham & Karr(2012)认为这是鸟类捕食压力产生的选择[49]。同样地,三叠纪-侏罗纪翼龙的体型也呈现出限制性模式,持续7000万年。而在这一时期之后的白垩纪,翼龙的多个不同分支的体型均呈现极度明显的增大趋势[25]。引人注意的是,翼龙的最小翼展在白垩纪早期有所增加,并与热河生物群连续良好采样时间中的最大翼展相映。这表明鸟类早期适应辐射进化的竞争压力在白垩纪早期逐渐将翼龙排除在小体型之外[25],尽管观察发现鸟类和翼龙具有不同的身体比例,因此不是彼此的直接生态相似[47]。
6 生物中生代的結束与新生代的起源
6.1恐龙-哺乳动物过渡期
哺乳动物在晚三叠世就已存在,并且在进化史的前2/3时间里,与非鸟类恐龙共存。大多数具有不同表型的胎盘类哺乳动物目(placentalmammals),包括大多数现存哺乳动物,在新生代(Cenozoic)很早期,即在古新世(Paleocene)的短时间内就首次出现[109]。尽管哺乳动物在早-中侏罗世具有显著的适应辐射[53],但体型较小(几乎全部小于1kg)[2,136]。在白垩纪末期的生物灭绝中,恐龙进化分支灭绝后,为哺乳动物释放了生态空间。特别是非鸟类恐龙的灭绝。新生代早期,胎盘类哺乳动物种类丰富,体型大小无限[2,136,138]。因此,新生代生态系统中由哺乳动物,而非恐龙,构成丰富的大型陆生动物类群。
K/PG的转变通常被认为是体型较大的哺乳动物直接取代了恐龙。然而,次抽样区域的估算表明:古新世早期哺乳动物物种丰盛度的增多远远大于先前恐龙物种丰盛度的损失(图4b)[21,51]。表明K/PG的转变是陆地生态系统物种的大重组,从根本上改变了对物种多样性的制约[21]。
6.2鸟类冠群的起源和多样化
分子钟(molecularclock)的分析一致确定:鸟类冠群起源于晚白垩世早期,分化为古鸟下纲(palaeognathae)和鸡雁小纲(galloanserae)[116]。Brusatte等人(2015)综述了化石和分子扩散时间[38]。鸟类现存1万多种,鸟类总群的起源与进化很值得关注。然而,与早白垩纪化石群,如热河生物群的早期鸟类冠群进化的显著记录相比,晚白垩世仍然是一个未知的时间段,其产出的化石很少且支离破碎。在目前已知的化石中,最有可能作为鸟类冠群的是雁形目(ariseform)的主干类群维加鸟类(Vegavis iaai)[50]。
与哺乳动物相比,新生代早期关于鸟类的化石记录较少。尽管如此,在K/PG边界的600万年范围内发现有:冠群的深巢种类(deeplynestedmembers):涉禽(aequorlitornithes);企鹅(penguin)和陆生鸟(telluraves) 化石[135];鼠鸟类(mousebird)化石[83]。这表明在新生代早期,今鸟类(neoaves),包括大多数鸟类冠群的爆发性适应辐射与有胎盘哺乳动物类似。
鸟类冠群在白垩纪末期大灭绝中的存活是一个谜,特别是考虑到其它类群的灭绝,包括冠群的有齿亲属[如鱼鸟目(lchthyornithiformes)和反鸟类(enantiornithes)(可能是最具代表性的中生代鸟类)[106,112]。这些类群一直延续到晚白垩纪[92],且与鸟类冠群有许多共同特征。中生代鸟类灭绝和今鸟类存活的原因尚不清楚。大体型物种的选择性灭绝[149]可以解释所有非尾综骨类恐龙的灭绝(其最小体重约为400g;见第3.1节),但不能解释小体型鸟类群,如反鸟类的灭绝。对于鸟类冠群的选择性存活,已有多种解释,包括神经系统的进化允许更大的行为弹性[100],食鱼性,食种子[85],衍生的消化道结构[105],嘴替代前肢功能[30]以及快速的孵化时间[61]。目前,这些假说仍然难以验证,因此解释鸟类冠群的存活和显著的新生代适应辐射仍是恐龙研究的主要课题。
7 结语
(1)关于恐龙宏观生态学与中生代陆地生态系统的研究还存在一些问题。由于化石标本的异质性,对小型恐龙体重(小于1t)的估算可能有1个数量级的偏差。理解和解释这些偏差需要对特殊化石组合进行埋葬学的分析和实地研究。(2)化石材料显示恐龙体型和肢体形态的进化限制。蜥脚类恐龙具有庞大的体型。肌肉骨骼形态和功能功能明显低于哺乳动物。(3)化石记录的空间范围影响研究恐龙物种数量和丰盛度的时间动态模式。标准化空间样本方法只对化石记录中最丰富的部分进行丰盛度计算。因此必须继续实地考察,特别是样本非常少的古低纬度地区。进一步研究丰盛度的时空变化与表型的关系。(4)鸟类的早期多样化对昆虫、翼龙和许多其它陆生生物(包括植物),有着重大的宏观进化上的影响,因为鸟类是种子的重要传播媒。鸟类的化石记录很不完整,但相对恐龙,其表型与物种多样性都非常丰富。早白垩世鸟类的起源丰富了陆地生物种类。此外,白垩纪末期生物大灭绝后哺乳动物物种丰盛度的增加远远超过了恐龙的损失,同时期鸟类爆发性的适应辐射。目前对此还没有合适的解释。
参考文献
[1] Alexander M. 1998. All-time giants: the largest animals and their problems. Palaeontology 41:1231-1245.
[2] Alroy J. 1998. Copes rule and the dynamics of body mass evolution in North American. fossil mammals. Science 280:731-734.
[3] Alroy J. 2000. Global climate change and North American mammalian evolution. Paleobiology 26:259-288.
[4] Alroy J. 2010. Geographical, environmental and intrinsic biotic controls on Phanerozoic marine diversification. Palaeontology 53:1211-1235.
[5] Alvarez LW. 1983. Experimental evidence that an asteroid impact led to the extinction of many species 65 million years ago. PNAS 80:627-642.
[6] Archibald JD, Clemens WA, Padian K, Rowe T, Macleod N, et al. 2010. Cretaceous extinctions: multiple causes. Science 328:973.
[7] Bakker RT. 1971. Ecology of the brontosaurs. Nature 299:172-174.
[8] Bakker RT. 1972. Anatomical and ecological evidence or endothermy in dinosaurs. Nature. 238:81-85.
[9] Bakker RT, Galton PM. 1974. Dinosaur monophyly and a new class of vertebrates. Nature. 248:168-172.
[10] BalanoffAM, Bever GS,RoweTB, Norell MA. 2013. Evolutionary origins of the avian brain. Nature 501:93-96.[11] -[158]文獻略
收稿日期:2020-02-12
基金项目:本研究得到清华大学SRT项目支持。
作者简介:黄大明(1963—),男,北京人,博士,特别研究员,研究方向:生态学。
Dinosaur Macroevolution and Macroecology
HUANG Da-ming1,HAO Ming-ze1,HUANG Yu-sen1,R.B.J. Benson2
(1. Laboratory of ecology, School of life sciences,Tsinghua University, Beijing 100084, PRC;
2. Department of Earth Sciences, University of Oxford, Oxford OX1 3AN, United Kingdom)
Abstract:Dinosaurs were large-bodied land animals of the Mesozoic that gave rise to birds. They played a fundamental role in structuring Jurassic-Cretaceous ecosystems and had physiology, growth, and reproductive biology unlike those of extant animals.Dinosaurs achieved substantial structural diversity, and their fossil record documents the evolutionary assembly of the avian body plan. Phylogeny-based research has allowed new insights into dinosaurmacroevolution, including the adaptive landscape of their body size evolution, patterns of species diversification, and the origins of birds and bird-like traits. This presents major challenges at the frontier of paleobiological research regarding tests of macroecological hypotheses and the effects of dinosaur biology, ecology, and life history on their macroevolution.
Key words:dinosauria;macroevolution;macroecology;paleobiology;phylogeny
