碳酸镧治疗维持性血液透析疗效及对患者冠状动脉钙化的影响
2020-09-01江莉萍刘凌云唐玲旭
李 婉, 周 萍, 李 琴, 江莉萍, 刘凌云, 唐玲旭
(成都医学院第一附属医院肾病科, 四川 成都 610500)
维持性血液透析是治疗慢性肾脏疾病的重要方法,但是患者容易发生高磷血症,对于合并高磷血症的维持性血液透析患者而言,若不予以有效控制,可导致继发性甲状旁腺功能亢进、心肌肥厚、血管钙化等[1,2],增加心血管疾病发生率,调查显示,此类患者冠状动脉钙化发生率较同龄、同性健康人群高出20~30倍[3]。相关研究表明,血磷(P)水平是预测维持性血液透析患者死亡风险的重要因子,患者血P升高1mg/dL,其死亡风险也会增加18%[4]。因此控制维持性血液透析伴高磷血症患者血P水平,对改善患者预后、提高其生存质量具有重要意义。碳酸镧是一种磷结合剂,能够降低血P水平,逐渐受到临床重视[5]。本次研究以我院105例维持性血液透析伴高磷血症患者为研究对象,探讨碳酸镧对其治疗效果,以及对患者冠状动脉钙化的影响。
1 资料与方法
1.1一般资料:选择2018年8月至2019年7月我院收治的105例维持性血液透析伴高磷血症患者,纳入标准:①定期行血液透析治疗,且维持性血液透析>3个月;②血P≥1.78mmoL/L(即5.5mg/dL);③均知情同意。排除标准:①合并严重甲状旁腺功能亢进(iPTH>1000pg/mL);②合并恶性肿瘤;③依从性差;④合并严重胃肠道疾病或近半年内发生过胃肠道出血;⑤急性感染;⑥急性心脑血管疾病;⑦严重肝病。以随机数字表法将患者分为两组,对照组52例,观察组53例,两组资料比较差异均不显著(P>0.05),见表1。
1.2方法:两组治疗前均接受为期2周的洗脱期(即不予以任何磷结合剂干预),之后对照组给予碳酸钙治疗,观察组给予碳酸镧(英国Hamol Limited,批准文号:H20171351 ,500mg*20s*1瓶)治疗,初始剂量:血P为1.78~2.26mmoL/L的患者每次口服250mg,2次/d;血P>2.26mmoL/L的患者每次口服500mg,2次/d。治疗过程中根据患者血P水平调整剂量,若血P为1.13~1.78mmoL/L,则维持原剂量,若血P<1.13mmoL/L,原剂量为500mg的减至250mg,原剂量为250mg的停止给药。3个月为1个治疗周期,两组均治疗2个周期。

表1 两组一般资料比较
1.3观察指标:①于治疗前和治疗后6个月对两组患者行空腹采血,采用本院检验中心的日本全自动生化分析仪进行血清钙(Ca)、P检测,校正血Ca(mmoL/L)=血清Ca(mmoL/L)+0.25[40(g/L)-血清白蛋白(g/L)],采用化学发光法检测血清全段甲状旁腺激素(iPTH)水平。②于治疗前和治疗后6个月对两组患者行空腹采血,自动生化分析仪测定其血清骨碱性磷酸酶(BALP)水平,酶联免疫吸附法检测成纤维细胞生长因子(FGF-23)水平。③于治疗前和治疗后6个月,采用心脏彩色多普勒超声检查评估两组患者左心室肥厚情况,左心室质量指数(LVMI)作为评估指标,LVMI=左心室心肌质量/体表面积,男性、女性LVMI分别超过135g/m2、110g/m2表示左心室肥厚;采用多层螺旋CT评估两组患者冠状动脉钙化情况,CT值取130HU为阈值,钙化面积≥1mm2,冠状动脉钙化积分(CACS)作为评估指标,测量钙化病变面积和钙化病灶峰值,算得其乘积,各断层图像独立分析后将全部断层钙化分数相加,所得之和为CACS。④记录两组不良反应。
1.4疗效评价[6]:根据两组患者治疗前后血P下降水平评估治疗效果,显效:血P≤1.78mmoL/L;有效:血P>1.78mmoL/L,但其水平较治疗前下降程度>25%;无效:未达到上述要求。总有效率=显效率+有效率。

2 结 果
2.1两组疗效比较:观察组治疗总有效率优于对照组(P<0.05),见表2。

表2 两组疗效比较n(%)
2.2两组治疗前后血清Ca、P、iPTH水平比较:治疗前,两组血清Ca、P、iPTH水平比较差异均不显著(P>0.05);观察组治疗前后血清Ca、P、iPTH水平差值均大于对照组(P<0.05),见表3。
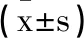
表3 两组治疗前后血清Ca P iPTH水平比较
2.3两组治疗前后血清FGF-23、ALP水平比较:治疗前,两组血清FGF-23、ALP水平比较差异不显著(P>0.05);观察组治疗前后血清FGF-23、ALP水平差值均大于对照组(P<0.05),见表4。
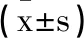
表4 两组治疗前后血清FGF-23 ALP水平比较
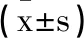
表5 两组治疗前后LVMI CACS比较
2.4两组治疗前后LVMI、CACS比较:治疗前,两组LVMI和CACS比较均无明显差异(P>0.05);观察组治疗前后LVMI和CACS差值均小于对照组(P<0.05),见表5。
2.5两组不良反应比较:观察组治疗过程中有2例患者出现轻度腹泻,2例患者出现便秘,1例患者出现恶心;对照组有2例患者食欲下降,2例患者出现水肿。观察组不良反应发生率(9.43%)与对照组(7.69%)比较差异无统计学意义(P>0.05)。
3 讨 论
随着肾功能不断恶化,慢性肾脏疾病患者容易发生骨骼及矿物质代谢紊乱,统称为慢性肾脏病-矿物质和骨异常(CKD-MBD),CKD-MBD包含骨异常、心血管钙化、软组织钙化等,患者并发心血管疾病的风险也较高[7~9]。而患者钙磷代谢紊乱是引起血管钙化的主要危险因素,其中高磷血症在慢性肾脏疾病患者血管钙化中起到了重要作用[10]。高磷血症可导致骨骼及矿物质代谢紊乱,诱发和促进血管钙化,主要作用机制有以下几点:①高磷血症可诱导血管平滑肌细胞向骨样细胞表型转换,促使血管平滑肌细胞释放基质囊泡,该物质在细胞凋亡诱导血管钙化中有重要作用,其含有促凋亡蛋白BAX,基质囊泡/凋亡小体可浓缩钙和使其结晶,导致血管钙化;②高磷血症可抑制单核细胞/巨噬细胞分化成破骨细胞;③高磷血症会导致FGF-23含量增加,FGF-23为成骨细胞合成及释放血P的重要调节因子,在维生素D代谢、继发性甲状旁腺功能亢进中有重要作用,Klotho蛋白是FGF-23的辅助因子,参与了钙磷代谢调节,慢性肾脏疾病患者Klotho蛋白表达水平较低,会激活钙-NFAT信号传导通路,继而引起左心室肥厚,并造成血管钙化。
控制含磷丰富的食物摄入、充分血液透析以及服用可结合磷的药物为目前临床治疗高磷血症的主要方法,但对于某些患者(如尿毒症)而言,饮食要求为高蛋白饮食,而这会增加P摄入,因此仅凭减少高磷食物摄入而达到治疗效果是很难的。而充分透析则要求每周透析次数较多或单次透析时间延长等,这会增加患者经济负担,对治疗时间和具体操作也有较高要求。因减少高磷食物摄入和充分透析难以将血P水平控制在理想范围内,故而使用磷结合剂来降低血P水平已成为临床控制患者血P水平的重要方法。口服磷酸盐结合剂,通过其与肠内膳食磷酸盐结合来抑制磷酸盐吸收,是降低及控制晚期慢性肾脏疾病患者血P水平管理内容之一。以往常用结合磷的物质为醋酸钙、碳酸钙等,但是长期采取这类含钙的磷结合剂,尤其是与不当维生素D治疗结合时,容易发生高钙血症而引起远处血管钙化,增加心血管疾病发生风险。而尽管铝可有效结合磷,但长时间服用含铝的磷结合剂容易造成铝滞留于体内而发生铝中毒,对患者健康不利。
碳酸镧是一种重要的磷酸盐结合剂,主要作用物质为镧,其是一种天然稀土元素,可与磷酸盐相结合。碳酸镧口服后可在胃部酸性环境中发生分解,进而释放出镧离子,镧离子与磷酸盐结合形成磷酸镧,因其水溶性低,不容易被胃肠道吸收,口服生物利用度很小,小部分通过肠道排出,大部分通过胆汁排出体外。实验表明,碳酸镧可最低限度被吸收,且不会被代谢,以较低密度沉积于骨骼及肝脏中。故而碳酸镧不会积聚于血浆中,对肾脏产生的损害较小,临床安全性较高。本次研究将碳酸镧用于慢性肾脏疾病维持性血液透析伴高磷血症患者的治疗,结果显示观察组治疗后血清Ca、P、iPTH水平均低于对照组(P<0.05),治疗有效率优于对照组(P<0.05),表明碳酸镧可以有效控制高磷血症,降低血Ca、P水平,改善机体代谢,控制继发性甲状旁腺功能亢进。赵文静等[11]研究也显示,碳酸镧能够有效控制高磷血症维持性血液透析患者血Ca、P、iPTH水平,效果优于碳酸钙。本次结果还显示,治疗后观察组血清FGF-23、ALP水平低于对照组(P<0.05),LVMI和CACS均低于对照组(P<0.05),提示碳酸镧可以较好延缓患者左心室肥厚及冠状动脉钙化,而这与碳酸镧有效控制血Ca、P、iPTH、FGF-23等水平有关。对比两组不良反应,显示两组不良反应发生率比较差异不显著(P>0.05),且观察组患者不良反应主要为胃肠道反应,药物停服后症状好转,未造成明显不良后果。
综上所述,采用碳酸镧治疗能够有效控制维持性血液透析伴高磷血症患者血Ca、P、iPTH水平,获得较好疗效,能够改善其冠状动脉钙化情况,延缓血管钙化进展。
