急性低氧胁迫对大规格军曹鱼幼鱼肝脏氧化应激、能量利用及糖代谢的影响
2020-08-31郭志雄曾泽乾黄建盛王维政李洪娟
郭志雄,曾泽乾,黄建盛,2,3,王维政,李洪娟,陈 刚,2,3
急性低氧胁迫对大规格军曹鱼幼鱼肝脏氧化应激、能量利用及糖代谢的影响
郭志雄1,曾泽乾1,黄建盛1,2,3,王维政1,李洪娟1,陈 刚1,2,3
(1. 广东海洋大学水产学院,广东 湛江 524088;2. 南方海洋科学与工程广东省实验室(湛江),广东 湛江 524025;3. 广东省水产经济动物病原生物学及流行病学重点实验室,广东 湛江 524088)
【】研究军曹鱼在急性低氧应激时肝脏代谢机能状态变化。测定急性低氧胁迫前后肝脏氧化应激指标、能量利用指标及糖代谢指标的变化。1)急性低氧胁迫后,军曹鱼肝脏超氧化物歧化酶(SOD)活性、谷胱甘肽过氧化物酶(GSH-Px) 活性均降低,与胁迫前差异极显著(<0.01);脂质过氧化物(LPO) 活性、丙二醛(MDA) 含量均升高,与胁迫前差异极显著(<0.01);过氧化氢酶(CAT) 活性略有降低,与胁迫前无显著性差异(> 0.05)。2)急性低氧胁迫后,军曹鱼肝糖原(LG) 含量、ATP酶活性均下降,与胁迫前差异极显著(< 0.01)。3)急性低氧胁迫后,军曹鱼肝脏乳酸脱氢酶(LDH)、丙酮酸激酶(PK)、己糖激酶(HK)活性均升高,与胁迫前差异极显著(<0.01)。急性低氧胁迫对军曹鱼幼鱼肝脏组织造成显著的氧化损伤,使肝脏氧化应激、能量利用及糖代谢相关指标发生显著变化。
军曹鱼;急性低氧;氧化应激;能量利用;糖代谢
军曹鱼()隶属鲈形目、军曹鱼科、军曹鱼属,亦称海鲡、海龙等,分布于大西洋、印度洋和太平洋等热带水域,为肉食性鱼类。因其肉质细嫩鲜美、无肌间刺、营养价值高、生长速度快、经济价值高等优势现已成为我国南方沿海地区深水网箱重要养殖对象,为具有开发前景海水鱼类养殖品种之一。本课题组在2002年突破军曹鱼全人工繁育技术及规模化育苗关键技术,成功解决了种苗来源问题。在军曹鱼幼鱼生长及抗氧化酶活性[1]、仔鱼生长及消化酶活性[2]、血细胞发生[3]、骨骼系统[4]、消化系统胚后发育[5]、能量收支[6]等多方面开展研究。近年来,军曹鱼养殖海区,特别是在较高密度的养殖区域,常因风和潮汐,水体温度、季节等因素的影响而出现短期急性缺氧现象。本实验室开展系列军曹鱼响应急性低氧反应机理的探讨,并报道了急性低氧对军曹鱼大规格幼鱼血液生化指标的影响[7]。肝脏是机体对外界刺激反应最早、最敏感的组织之一,也是最早出现损伤的组织,严重时则会使鱼类肝脏处于超负荷状态[8]。鱼类应对急性低氧引起的氧化应激,肝脏组织的代谢情况也备受关注[8-11]。因此,在前期研究基础上,笔者以大规格军曹鱼幼鱼为对象,研究急性低氧胁迫对其肝脏氧化应激、能量利用及糖代谢的影响,以期为军曹鱼养殖产业的健康发展及其耐低氧品种选育的抗逆性研究提供参考资料。
1 材料与方法
1.1 试验鱼
军曹鱼幼鱼100尾,体质量(240.78±30.24)g,体长(27.75±2.08)cm,取自广东省湛江市东海岛生物研究基地。2018年7月10日充氧运输至广东海洋大学水产学院鱼类种子工程与养殖团队实验室,置于室内自制的循环水系统(包括供气、回流水循环系统、生物滤池和20个养殖水槽等)暂养。养殖水槽容量规格为长70 cm,宽50 cm,高60 cm,水体交换量90 L/h。将试验鱼分别放入5个水槽中,每个水槽放幼鱼20尾。暂养期间,通过调节水槽内的充气量大小,保持水中溶解氧在6 mg/L以上,盐度28 ~ 30,温度27.5 ~ 29.0 ℃,pH 8.0,氨氮在0.01 mg/L以下,自然光照周期,每天09:00投喂一次海水鱼专用配合饲料(水分、粗蛋白、粗脂肪、粗灰分、粗纤维、钙、磷质量分数分别为9.01%、52.94%、12.21%、14.51%、3.0%以下、2.0%以下、1.8%以下)。暂养2周后进行试验。试验开始前一天停止投喂。
1.2 试验设计
试验在循环水养殖系统的5个水槽中进行。胁迫前采集对每个水槽水体及幼鱼取样。试验时停止充气及流水,用保鲜薄膜封闭水槽上方,使水体溶解氧迅速下降,当鱼出现缺氧症状,上蹿下跳和打转随后卧于水底濒临死亡时对水体及幼鱼取样。胁迫前后每个水槽取3次水样,用碘量法测定水体溶解氧,胁迫前为(6.23±0.23)mg/L,胁迫后为(1.85±0.11)mg/L。实验鱼从开始到出现缺氧症状历时25 ~ 30 min。胁迫前、后每个水槽各取幼鱼10尾,置于含100 mg/L MS-222的海水中快速麻醉,用纱布擦干鱼体,剖取肝脏组织,迅速置于液氮中速冻,于‒80 ℃冰箱中保存待测。
1.3 指标测定
组织样品按每克待测组织加入9 mL生理盐水的比例在冰水浴条件下用匀浆机制成100 g/L的匀浆,以2 000 r/min、4 ℃条件离心10 min。取上清液,于4 ℃冰箱保存,用以测定酶活性和蛋白质、糖原含量。
超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、乳酸脱氢酶(LDH)、ATP酶、谷胱甘肽过氧化物酶(GSH-Px)、脂质过氧化物(LPO)、丙酮酸激酶(PK)和己糖激酶(HK)活性以及丙二醛(MDA)、肝糖原(LG)、蛋白质含量均使用购自南京建成生物科技有限公司试剂盒,参照说明书检测。采用羟胺法测定SOD,钼酸铵法测定CAT活性,微板法测定LDH活性,考马斯亮蓝法测定蛋白质含量;采用比色法测定ATP酶、PK、HK、GSH-Px活性及糖原含量。
1.4 数据分析
用GraphPad Prism 5软件处理数据并作图,用配对检验法分析军曹鱼急性低氧胁迫前后肝脏各指标数据差异显著性,显著性水平α = 0.05或0.01。
2 结果
2.1 急性低氧对军曹鱼肝脏氧化应激指标的影响
军曹鱼肝脏氧化应激指标结果见图1。由图1可知,急性低氧胁迫后,CAT活性差异无统计学意义(= 2.372,4,> 0.05)(图1-b)。SOD活性比胁迫前降低18.77 U/mg(95% CI:10.99 ~ 26.55),差异有统计学意义(= 6.204,4,< 0.01)(图1-a);GSH-Px活性降低119.2 U/mg(95% CI:61.17至177.2),差异有统计学意义(= 5.282,4,< 0.01)(图1-c);LPO活性升高0.4 μmol/g(95% CI:-0.5463至-0.2537),差异有统计学意义(= 7.027,4,< 0.01)(图1-d);MDA含量升高3.0 nmol/mg(95% CI:-4.134至-1.880),差异有统计学意义(= 6.858,4,< 0.01)(图1-e)。
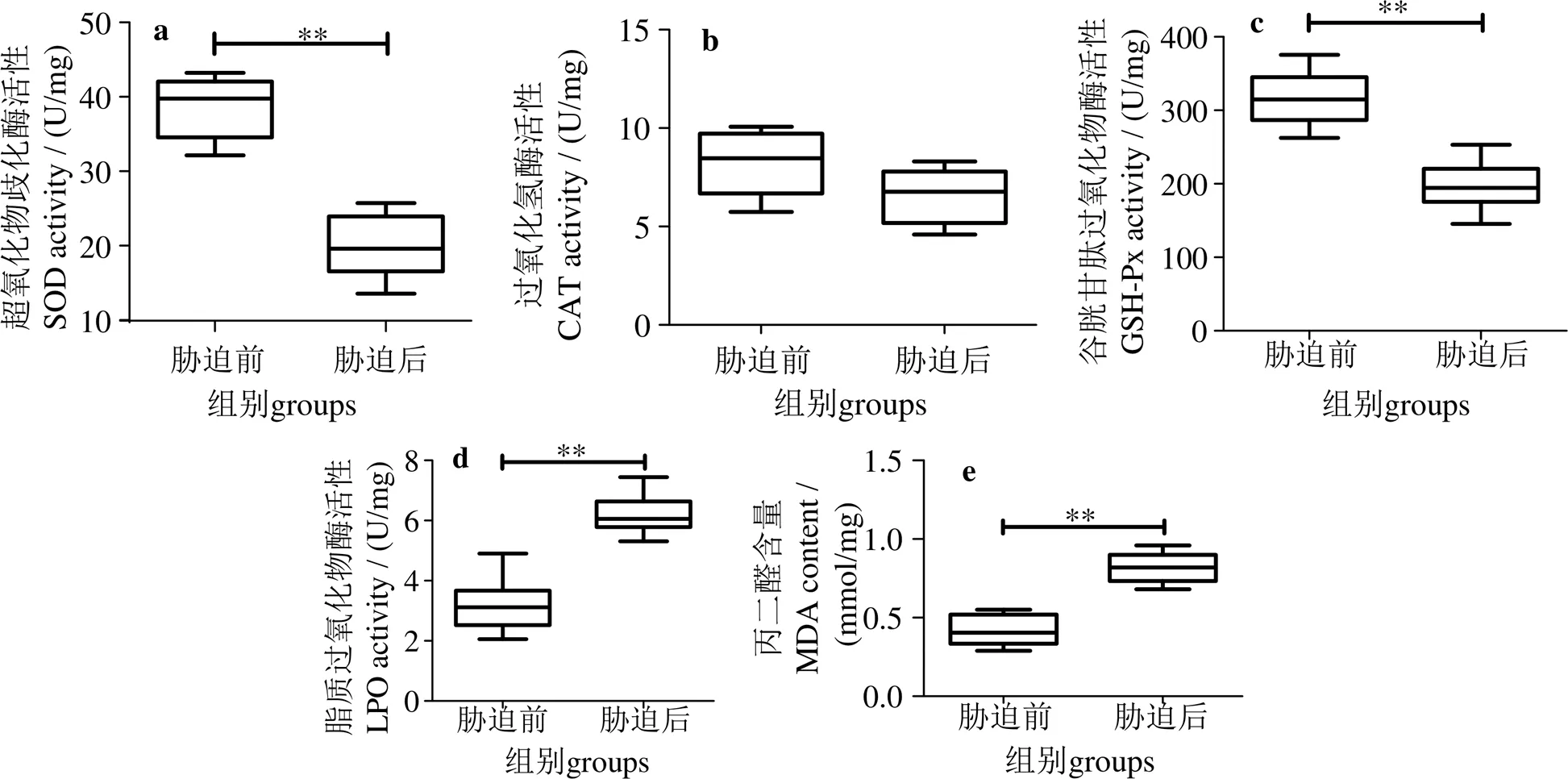
**表示差异极显著(P<0.01)Notes:** shows extremely significant difference.
2.2 急性低氧对军曹鱼肝脏能量利用的影响
军曹鱼肝脏糖原含量、ATP酶活性结果见图2。由图2可知,低氧胁迫后,糖原含量比胁迫前降低9.4 mg/g(95% CI:6.062 ~ 12.75),差异有统计学意义(= 7.234,4,< 0.01)。ATP酶活性下降3.8 U/mg(95% CI:1.999 ~ 5.505),差异有统计学意义(= 5.502,4,< 0.01)。
2.3 急性低氧对军曹鱼肝脏糖代谢的影响
军曹鱼肝脏乳酸脱氢酶活性、丙酮酸激酶活性和己糖激酶活性结果见图3。由图3可知,急性低氧胁迫后,乳酸脱氢酶活性比胁迫前升高115.5 U/mg(95% CI:-143.4 ~ -87.67),差异有统计学意义(= 10.66,4,< 0.01)。丙酮酸激酶活性升高1.1 U/mg(95% CI:-1.132 ~ -1.014),差异有统计学意义(= 46.87,4,< 0.01)。己糖激酶活性升高1.3 U/mg(95% CI:-1.824 ~ -0.7462),差异有统计学意义(= 6.132,4,< 0.01)。

**,差异极显著(Extremely significant difference)(P < 0.01)

图3 急性低氧对军曹鱼肝脏乳酸脱氢酶活性、丙酮酸激酶活性和己糖激酶活性的影响
3 讨论
3.1 急性低氧对军曹鱼肝脏氧化应激的影响
研究表明,鱼类在低氧环境下有氧呼吸速率下降,活性氧自由基(ROS)增加,可影响鱼体抗氧化防护能力,从而引起鱼类产生氧化应激[9, 12]。当过多的ROS无法被鱼类自身及时有效地消除时,多余的ROS会引发诸如蛋白、核酸等生物大分子的加重氧化,生成可能直接破坏细胞结构功能完整性的过氧化物产物,引起各种生理机能的改变,最终诱发疾病[13, 14]。为减少ROS的积累,增强细胞保护,降低氧化应激水平,鱼类在长期适应进化过程中已形成以抗氧化酶(SOD、CAT、GSH-Px)和小分子抗氧化剂(类胡萝卜素、维他命等)一套稳定的抗氧化体系机制[12, 14]。本研究中,军曹鱼幼鱼经历急性低氧胁迫后,肝脏SOD、GSH-Px活性极显著低于胁迫前水平(<0.01),CAT活性无显著性差异(>0.05),显示肝脏抗氧化酶系统不能有效清除机体内ROS,机体出现氧化应激,最终导致MDA积累。此外,MDA含量和LPO活性极显著高于胁迫前也证实这一结论。MDA和LPO为脂质过氧化指标,其含量增加表明低氧胁迫已对鱼体产生氧化损伤[15, 16]。有观点认为,脂质过氧化物积累过多将会降低甚至降解抗氧化酶活性[17]。经历急性低氧胁迫的军曹鱼幼鱼MDA增加、SOD降低的现象支持上述观点,大黄鱼()低氧胁迫[18]研究亦支持这一观点。在以往研究中,淇河鲫 () 在低氧环境下肝胰脏抗氧化酶活性显著降低[9];葛氏鲈塘鳢()[19]、细鳞肥脂鲤()[20]肝胰脏CAT活性和GSH-PX活性显著降低,与本研究结果相似。也有与本研究不一致的报道,如银鲫()[21]肝脏CAT活性,德国镜鲤()[11]、鲻鱼()[8]肝脏SOD活性在低氧环境下显著升高;花鲈()在低氧胁迫后肝脏中SOD和CAT活力与对照组无显著性差异[22]。这与鱼类对低氧胁迫的耐受性、发育阶段、胁迫处理等因素有关。鱼类响应低氧胁迫是一种复杂的生理过程,是多种因素相互作用的结果[18],需在基因水平、信号通路、低氧信号途径网络调控等层次深入探讨其响应机理。
3.2 急性低氧对军曹鱼肝脏能量利用的影响
肝脏是鱼类存储糖原的重要器官[23]。糖原是机体内最重要的供能物质,对维持机体的能量代谢及重要功能物质合成有重要作用[22],肝糖原、肌糖原是鱼体内主要的糖存储能源,但正常情况下肝糖原相对稳定,其含量受无氧代谢中乳酸积累影响[29]。研究发现,鱼类面临低氧胁迫时,会用肌肉、肝脏的糖原作为能量代谢底物来获得足够的能量,延长存活时间。如白鲢()经急性低氧处理后,肝糖原含量呈下降趋势[24];银鲇鱼()经低氧处理后肝糖原迅速分解并加快糖异生[23]。花鲈()肝脏中糖原和乳酸含量则在低氧处理后显著降低[22],褐牙鲆() 幼鱼经10 d的低氧处理后,有明显动员体内糖原作为能量代谢底物的过程[25]。本研究也有类似结果。军曹鱼经历急性低氧胁迫后,肝糖原含量极显著降低,表明军曹鱼启动肝糖原利用应对急性低氧应激。笔者在前期的研究发现,军曹鱼经历急性低氧胁迫后,血液中的葡萄糖含量显著升高[7],也说明大量的肝糖原分解为葡萄糖释放到血液中,导致鱼体出现应激性高血糖现象,是机体自我保护机制的表现。
ATP是鱼类进行正常生命活动的主要供能物质,其合成由ATP酶控制。水体溶解氧变化影响着鱼类ATP酶活性[26, 27]。有研究显示,随着水体溶解氧的降低,鱼类ATP酶活性呈先升后降的变化趋势[26]。河川沙塘鳢()急性低氧时肝脏ATP酶活性呈先上升后回落的趋势[27],小鳞毛足鲈() ATP酶在低氧条件下出现上升趋势[28]。但是,本研究中,急性低氧胁迫后,军曹鱼肝脏ATP酶活性出现极显著降低(<0.01)。推测军曹鱼在短期(30 min)急性低氧胁迫后,ATP消耗量显著超过再合成量,鱼体调节能力在线粒体内膜出现损伤后可能受到一定干扰,使能量代谢紊乱。这反映不同鱼类应对低氧环境适应机理不同,军曹鱼属于低氧敏感鱼类。
3.3 急性低氧对军曹鱼肝脏糖酵解的影响
鱼类面临低氧胁迫后,机体内的有氧代谢水平被抑制,导致机体所需要的能量供给不足,机体就会被动地进行以无氧代谢为主的供能方式[22,29-30]。多数鱼类已发展不同分子策略来应对低氧胁迫,如启用葡萄糖转运蛋白-2低氧诱导葡萄糖转运[31];采取一系列与糖酵解相关的酶完成氧化磷酸化过渡到糖酵解转化[32]。就低氧条件下糖酵解相关酶活性显著提高来说,这种反应更像是一种在细胞水平下必不可少的保护机制,这种机制是一种进化上保守,可满足细胞短期低氧环境下的生长所需[33]。在生物体内,LDH可催化糖无氧代谢的最终产物乳酸,脱去全部吸附的氢原子,实现乳酸与丙酮酸之间的逆转化。转化成的丙酮酸在线粒体中被氧化成水和二氧化碳,经过电子传递链生成ATP供能,所以乳酸脱氢酶是糖酵解代谢过程中又一重要酶[34]。丙酮酸激酶是糖酵解过程中的主要限速酶之一,可催化磷酸烯醇式丙酮酸转化为烯醇式丙酮酸,并产生ATP供能。己糖激酶是催化己糖官能基团的磷酸化糖酵解反应的第一步,与底物亲和力较低,也决定了其与肝脏生理功能和机体血糖稳定密切相关的关系,所以也决定了己糖催化激酶在整个磷酸化反应中比较重要的作用。研究表明,在机体利用无氧代谢时,鱼体内LDH活性显著升高,催化丙酮酸转化为乳酸。鳉()在缺氧下糖酵解酶活性发生变化,LDH显著增加[35];叉尾石首鱼()在缺氧时,鳃中的LDH活力显著升高[36];在长时间低氧胁迫下,斑马鱼转录组测序数据后得出,斑马鱼与糖酵解有关的基因表达增强[37]。本研究中,经历急性低氧胁迫后,军曹鱼肝脏乳酸脱氢酶活性、丙酮酸激酶活性和己糖激酶活性均出现极显著性升高,与鳉、叉尾石首鱼的结果一致。一般认为糖酵解受低氧诱导因子(HIF)调节。研究表明,LDH和丙酮酸脱氢酶激酶(PDK1)都不同程度地受低氧诱导因子HIF-1α调节。在HIF-1α诱导下,LDH表达可进一步促进丙酮酸转化为乳酸[38],PDK1表达则会对丙酮酸转化为乙酰辅酶A产生抑制作用[39]。目前,已从多种鱼类中克隆和鉴定出HIF-1ɑ[40-41],关于军曹鱼HIF-1ɑ在低氧条件的调节有待进一步探讨。
4 结论
在急性低氧胁迫前后,大规格军曹鱼幼鱼在调节自身氧化抗氧化酶体系活性的过程中,幼鱼肝脏氧化应激、能量利用及糖代谢相关指标均发生显著变化,肝脏组织出现一定程度的氧化损伤。
[1] 杨健, 陈刚, 黄建盛, 等. 温度和盐度对军曹鱼幼鱼生长与抗氧化酶活性的影响[J]. 广东海洋大学学报, 2007, 27(4): 25-29.
[2] 汤保贵, 陈刚, 张健东, 等. 饵料系列对军曹鱼仔鱼生长、消化酶活力和体成分的影响[J]. 水生生物学报, 2007, 31(4): 479-484.
[3] 陈刚, 周晖, 张健东, 等. 军曹鱼血液指标及血细胞发生的观察[J]. 水生生物学报, 2005, 29(5): 564-570.
[4] 陈刚, 张健东, 吴灶和. 军曹鱼骨骼系统的研究[J]. 湛江海洋大学学报, 2004, 24(6): 6-10.
[5] 初庆柱, 张健东, 陈刚, 等. 军曹鱼消化系统胚后发育的组织学研究[J]. 水生态学杂志, 2010 (4): 89-94.
[6] 王忠良, 黄亿彬, 陈刚, 等. 饥饿与补偿生长对军曹鱼幼鱼能量收支的影响[J]. 吉首大学学报(自然科学版), 2012, 33(6): 102-106.
[7] 黄建盛, 陆枝, 陈刚, 等. 急性低氧胁迫对军曹鱼大规格幼鱼血液生化指标的影响[J]. 海洋学报, 2019, 41(6): 76-84.
[8] 熊向英, 黄国强, 彭银辉, 等. 低氧胁迫对鲻幼鱼生长、能量代谢和氧化应激的影响[J]. 水产学报, 2016, 40(1): 73-82.
[9] 赵燕静, 狄桂兰, 孔祥会, 等. 低氧环境下poly I:C刺激对淇河鲫肝胰脏抗氧化防护的影响[J].水产学报, 2016, 40(12): 1830-1841.
[10] 姜景腾, 吴雄飞, 蒋宏雷. 低氧胁迫对真鲷(♀)与黑鲷(♂)杂交子一代体内酶活力的影响[J]. 宁波大学学报(理工版), 2010, 23(4): 10-14.
[11] LUSHCHAK V I, LUSHCHAK L P, MOTA A A, et al. Oxidative stress and antioxidant defenses in goldfishduring anoxia and reoxygenation [J]. American Journal of Physiology Regulatory Integrative & Comparative Physiology, 2001, 280(1): 100-107.
[12] LEVEELAHTI L, RYTKONEN K T, RENSHAW G M C, et al. Revisiting redox-active antioxidant defenses in response to hypoxic challenge in both hypoxia-tolerant and hypoxia-sensitive fish species [J]. Fish Physiology and Biochemistry, 2014, 40(1): 183-191.
[13] MARTINEZ-ALVAREZ R M, MORALES A E, SANZ A. Antioxidant Defenses in Fish: Biotic and Abiotic Factors [J]. Reviews in Fish Biology and Fisheries, 2005, 15(1/2): 75-88.
[14] LESSER M P. Oxidatytive stress in marine environments: Biochemistry and Physiological Ecology [J]. Annual Review of Physiology, 2006, 68(1): 253 – 278.
[15] DEL RIO D, STEWART A J, PELLEGRINI N. A review of recent studies on malondialdehyde as toxic molecule and biological marker of oxidative stress [J]. Nutrition Metabolism and Cardiovascular Diseases, 2005, 15(4): 316-328.
[16] NAIEL M A, BDELWAHAB M M, EL-SABAN M, et al. Oxidative stress and mitochondrial dysfunction in sepsis.[J]. British Journal of Anaesthesia, 2011, 107(1): 57-64.
[17] LUSHCHAK V I. Environmentally induced oxidative stress in aquatic animals[J]. Aquatic Toxicology, 2011, 101(1):0-30.
[18] 王永红, 张建设, 曾霖. β-葡聚糖对低氧胁迫下大黄鱼幼鱼的保护作用及其机理 [J]. 水产学报, 2018, 42(6): 15-24.
[19] LUSHCHAK V I, BAHNYUKOVA T V. Hypoxia induces oxidative stress in tissues of a goby, the rotan[J]. Comparative Biochemistry and Physiology B-Biochemistry & Molecular Biology, 2007, 148(4): 390-397.
[20] SAMPAIO F G, BOIJINK C D L, OBA E T, et al. Antioxidant defenses and biochemical changes in pacu () in response to single and combined copper and hypoxia exposure [J]. Comparative Biochemistry and Physiology C-Toxicology & Pharmacology, 2008, 147(1): 43-51.
[21] VÍG É, NEMCSÓK J. The effects of hypoxia and paraquat on the superoxide dismutase activity in different organs of carp,L [J]. Journal of Fish Biology, 1989, 35(1): 23-25.
[22] 常志成, 温海深, 张美昭, 等. 溶解氧水平对花鲈幼鱼氧化应激与能量利用的影响及生理机制[J]. 中国海洋大学学报(自然科学版), 2018, 48(7): 20-28.
[23] LERMEN C L, LAPPE R, CRESTANI M, et al. Effect of different temperature regimes on metabolic and blood parameters of silver catfish[J]. Aquaculture, 2004, 239(1-4): 497-507.
[24] 何伟, 曹振东, 付世建. 温度和低氧对白鲢乳酸与糖水平的影响 [J]. 重庆师范大学学报(自然科学版), 2013, 30(5): 27.
[25] 李洁, 唐夏, 张灵燕, 等. 溶解氧水平对褐牙鲆幼鱼能量代谢和氧化应激的影响研究[J]. 广西科学院学报, 2015, 31(1): 22-27.
[26] 王春枝, 李忠, 梁宏伟, 等. 低氧胁迫对鲢线粒体ATP酶活性及F1-δ基因表达的影响 [J]. 中国水产科学, 2014, 21(3): 454-463.
[27] 贾秀琪, 张宏叶, 王丽, 等. 低氧胁迫对河川沙塘鳢抗氧化酶及ATP酶活性的影响[J]. 海洋渔业, 2017, 39(3): 306-313.
[28] HUANG C Y, LIN H C, LIN C H. Effects of hypoxia on ionic regulation, glycogen utilization and antioxidative ability in the gills and liver of the aquatic air-breathing fish[J]. Comparative Biochemistry and Physiology a-Molecular & Integrative Physiology, 2015, 179: 25-34.
[29] FUJIORI T, ABE H. Physiological roles of free- and-alanine in the crayfishwith special reference to osmotic and anoxic stress responses [J]. Comparative Biochemistry and Physiology A— Molecular and Integrative Physiology, 2002, 131(4): 893-900.
[30] 李梦晓. 低氧应激对尼罗罗非鱼糖脂代谢的影响及红景天苷的调节作用研究[D]. 上海: 华东师范大学, 2018.
[31] TEROVA G, RIMOLDI S, BRAMBILLA F, et al. In vivo regulation of GLUT2 mRNA in sea bass () in response to acute and chronic hypoxia [J]. Comparative Biochemistry and Physiology Part B-Biochemistry & Molecular Biology, 2009, 152(4): 306-316.
[32] ZHU C D, WANG Z H, YAN B A. Strategies for hypoxia adaptation in fish species: a review [J]. Journal of Comparative Physiology B–Biochemical Systems and Environmental Physiology, 2013, 183(8): 1005-1013.
[33] 任倩妍. 低氧诱导大弹涂鱼低氧生理应激及葛根素和姜黄素的缓释作用研究[D]. 舟山: 浙江海洋大学, 2018.
[34] ALIMEIDA-VAL V M, VAL A L, DUNCAN W P, et al. Scaling effects on hypoxia tolerance in the Amazon fish(Perciformes: Cichlidae): contribution of tissue enzyme levels [J]. Comparative Biochemistry and Physiology Part B, Biochemistry & Molecular Biology, 2000, 125(2): 219-226.
[35] KRAEER L D, SCHULTE P M. PRIOR PCB exposure suppresses hypoxia-induced up-regulation of glycolytic enzymes in[J]. Comparative Biochemistry and Physiology C–Toxicology & Pharmacology, 2004, 139(1-3): 23-29.
[36] COOPER R U, CLOUGH L M, FARWELL M A, et al. Hypoxia-induced metabolic and antioxidant enzymatic activities in the estuarine fish[J]. Journal of Experimental Marine Biology and Ecology, 2002, 279(1): 1-20.
[37] VAN DER MEER D L M, VAN DEN THILLART G, WITTE F, et al. Gene expression profiling of the long-term adaptive response to hypoxia in the gills of adult zebrafish [J]. American Journal of Physiology – Regulatory Integrative and Comparative Physiology, 2005, 289(5): 1512-1519.
[38] FIRTH J D, EBERT B L, RATCLIFFE P J. Hypoxic regulation of lactate dehydrogenase A. Interaction between hypoxia-inducible factor 1 and cAMP response elements [J]. The Journal of biological chemistry, 1995, 270(36): 21021-21027.
[39] PAPANDREOU I, CAIRNS R A, FONTANA L, et al. HIF-1 mediates adaptation to hypoxia by actively downregulating mitochondrial oxygen consumption [J]. Cell Metabolism, 2006, 3(3): 187-197.
[40] SHEN R J, JIANG X Y, PU J W, et al. HIF-1 alpha and -2 alpha genes in a hypoxia-sensitive teleost species: cDNA cloning, expression and different responses to hypoxia [J]. Comparative Biochemistry and Physiology B – Biochemistry & Molecular Biology, 2010, 157(3): 273-280.
[41] LAW S H W, WU R S S, NG P K S, et al. Cloning and expression analysis of two distinct HIF-alpha isoforms – gcHIF-1alpha and gcHIF-4alpha – From the hypoxia-tolerant grass carp,[J]. BMC Molecular Biology, 2006, 7(1): 1-13.
Effects of Acute Hypoxia on Oxidative Stress, Energy Utilization and Carbohydrate Metabolism in Liver of Large-Sized Juvenile Cobia ()
GUO Zhi-xiong1, ZENG Ze-qian1, HUANG Jian-sheng1,2,3, WANG Wei-zheng1, LI Hong-juan1, CHEN Gang1,2,3
(1.,,524088,; 2.(),524025,; 3.524088,)
To study the changes in metabolic functions of cobia () liver under hypoxia stress.The oxidative stress index, energy utilization index and glucose metabolism index were measured before and after acute hypoxia stress.1) After acute hypoxia stress, the activities of superoxide dismutase (SOD) and glutathione peroxidase (GSH-Px) in the liver were decreased, and the differences were highly significant (<0.01) while the increase in lipid peroxide LPO) and malondialdehyde (MDA) were significantly (<0.01). Although the activities of catalase (CAT) was decreased slightly, the difference was not significant (>0.05). 2) After acute hypoxia stress, glycogen (LG) content and ATPase activity in the liver decreased in different degrees, and the differences were highly significant (<0.01). 3) After acute hypoxia stress, lactate dehydrogenase (LDH) activity, pyruvate kinase (PK) activity and hexose kinase (HK) activity in the liver increased in different degrees, and the difference was highly significant (<0.01).Acute hypoxia stress caused significant oxidative damage to the liver of juveniles cobia, resulting in significant changes in oxidative stress, energy utilization and some related indicators of glucose metabolism.
; acute hypoxia stress; oxidative stress; energy utilization; carbohydrate metabolism
S917.4;S965.399
A
1673-9159(2020)03-0134-07
10.3969/j.issn.1673-9159.2020.03.017
2019-12-12
现代农业产业技术体系专项资金资助(CARS-47);南方海洋科学与工程广东省实验室(湛江)(ZJW-2019-06);2018年广东海洋大学起航计划项目(QHJHZR201818);广东海洋大学大学生创新创业训练计划项目(CXXL2018131)
郭志雄(1993―),男,硕士研究生,主要研究方向海水鱼类养殖生理生态学。E-mail: 478210431@qq.com
黄建盛(1981―)男,博士,副教授,主要研究方向为海水鱼类养殖生理生态学。E-mail:huangjs@gdou.edu.cn
郭志雄,曾泽乾,黄建盛,等. 急性低氧胁迫对大规格军曹鱼幼鱼肝脏氧化应激、能量利用及糖代谢的影响[J]. 广东海洋大学学报,2020,40(3):134-140.
(责任编辑:刘庆颖)
