等边浅蛤肉酶解产物超滤组分免疫调节作用
2020-08-31丁霈希章超桦高加龙秦小明曹文红郑惠娜林海生
丁霈希,章超桦,2,3,4,5,高加龙,2,3,4,5,秦小明,2,3,4,5,曹文红,2,3,4,5,郑惠娜,2,3,4,5,林海生,2,3,4,5
等边浅蛤肉酶解产物超滤组分免疫调节作用
丁霈希1,章超桦1,2,3,4,5,高加龙1,2,3,4,5,秦小明1,2,3,4,5,曹文红1,2,3,4,5,郑惠娜1,2,3,4,5,林海生1,2,3,4,5
(1.广东海洋大学食品科技学院,广东 湛江 524088;2.海洋食品精深加工关键技术省部共建协同创新中心,辽宁 大连 116034;3.广东省水产品加工与安全重点实验室//4.广东普通高等学校水产品深加工重点实验室//5.国家贝类加工技术研发分中心(湛江),广东 湛江 524088)
【】探讨等边浅蛤()肉的基本营养成分、蛋白质氨基酸组成及中性蛋白酶酶解产物超滤组分的免疫活性。采用中性蛋白酶酶解等边浅蛤肉,利用3 ku超滤膜对等边浅蛤肉酶解产物进行超滤分离,通过细胞实验和动物实验评价小于3 ku和大于3 ku两个超滤组分的免疫调节作用。等边浅蛤肉具高蛋白低脂肪特点,其氨基酸种类和含量丰富。细胞实验表明,<3 ku组分的细胞相对增殖率及吞噬中性红能力均显著高于阳性对照组(<0.05),其中质量浓度为250 μg/mL时细胞相对增殖率高达126.22%;动物实验表明,与空白对照组相比,<3 ku组分能够极显著提高迟发型变态反应(DTH)程度、半数溶血值(HC50)、抗体生成细胞数、吞噬指数及NK细胞活性(<0.01)。细胞实验和动物实验均表明<3 ku组分的免疫调节作用优于>3 ku组分。等边浅蛤肉酶解产物的<3 ku超滤组分具有一定的免疫调节作用。
等边浅蛤;酶解产物;超滤组分;免疫调节作用
《中国卫生健康统计年鉴2018》统计数据显示,2017年心脑血管病、癌症和慢性呼吸系统疾病等慢性疾病是我国城乡居民主要致死病因,占比超过80%[1]。因此,越来越多人关注如何提高人群机体免疫力。食源性免疫活性肽无毒、低敏、安全性高且可以调节人和动物机体免疫能力,在人类营养健康和疾病调节中发挥着不可替代的作用[2]。而海洋类动物由于生长环境特殊,因此体内氨基酸结构与陆地动物不同,其分离出活性肽带正电荷与显负电性的细胞因子受体大量结合,增强机体免疫力[3]。海洋贝类中马氏珠母贝()[4]、青蛤()[5-6]、波纹巴非蛤()[7]、文蛤()[8-10]、牡蛎()[11-13]、扇贝()[14]、贻贝()[15]等均被证明存在免疫活性肽。
等边浅蛤()隶属瓣鳃纲(Lamellibranchia),异齿亚纲(Heterodonta),帘蛤目(Veneroida),帘蛤科(Veneridae),浅蛤属(),别名“沙蛤”[16],属于广温广盐性种类,在我国南北海岸均分布,是一种栖息于潮间带中、下潮区泥砂质底营底栖生活的经济贝类[17]。等边浅蛤一般以带壳鲜销为主,少数加工为罐头制品和干制品。近年来等边浅蛤虾塘和滩涂养殖规模不断扩大[18],为提高其产品附加值,本研究对等边浅蛤的基本营养成分和氨基酸组成进行分析,并对等边浅蛤肉酶解产物超滤组分的免疫活性进行评价,以期为等边浅蛤肉高值化开发利用提供基础数据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料 等边浅蛤(),壳长(3.8 ± 0.2)cm,购自汕尾,开壳取肉后-40 ℃贮藏备用。
1.1.2 试剂 中性蛋白酶(3.2 × 104U/g),购自广西庞博生物科技有限公司;中性红,购自天津市天新精细化工有限公司;脂多糖(LPS)、噻唑蓝(MTT),购自美国Sigma公司;磷酸缓冲盐溶液(PBS)、胎牛血清、1640无血清培养基(RPMI-1640)、青/链霉素双抗、dulbecco's modified eagle medium培养基(DMEM),购自美国Gibco公司;20%绵羊红细胞,购自蕊特生物技术有限公司;印度墨汁、乳酸脱氢酶(LDH)、水杨酸缓冲液(SA缓冲液)、碘硝基氯化四氮唑蓝(INT)、乳酸锂,购自上海源叶生物有限公司;烟酰胺腺嘌呤二核苷酸(NAD),购自北京索莱宝科技有限责任公司;聚乙二醇辛基苯基醚(TRITONX-100),购自碧云天生物技术有限公司;都氏试剂,购自雨朵生物技术有限公司;吩嗪硫酸甲酯 (PMS),美仑生物技术有限公司;豚鼠血清,购自鸿泉生物技术有限公司公司;红细胞裂解液,购自白鲨易生物有限公司;盐酸左旋咪唑片,购自南国药业有限公司;其余试剂,均为国产分析纯。
1.1.3 细胞 RAW264.7巨噬细胞、小鼠淋巴瘤细胞(YAC-1)购自中科院上海细胞库。
1.1.4 动物 SPF级昆明种雄性小鼠,4周龄,体质量(20 ± 2)g,合格证号SCXKL(鲁)20140007,购自济南朋悦实验动物繁殖有限公司;饲养于广东海洋大学SPF级动物房,许可证号SYXK(粤)2019-0204。
1.2 仪器与设备
VULCAN 3-550 PD马福炉,美国Vulcan公司;VAPODEST450全自动凯氏定氮仪,德国Gerhardt公司;WTM-CM-01陶瓷膜分离设备(杭州沃腾膜有限公司);FA2104A电子分析天平(上海天平仪器厂);旋转蒸发仪R-1005 (郑州长城科工贸有限公司);HHT4-LX-C50L型立式压力蒸汽灭菌器(北京中西远大科技有限公司);CKX41型倒置显微镜(日本Olympus);SW-CJ-2FD型超净工作台(苏州净化有限公司);Forma370型CO2恒温箱、Multiskan FC型酶标仪(Thermo公司,美国);TDL-5-A低速离心机(上海安亭科学仪器厂)。
1.3 方法
1.3.1 等边浅蛤肉基本成分分析 水分测定:常压干燥法(GB/T5009.3-2016);粗蛋白、非蛋白氮测定:凯氏定氮法(GB/T5009.5-2016);灰分测定:高温灼烧法( GB/T5009.4-2016);粗脂肪测定:索氏提取法( GB/T5009.6-2016);总糖含量测定:苯酚硫酸法。
1.3.2 等边浅蛤肉氨基酸组成分析 等边浅蛤肉水解后用氨基酸自动分析仪测定除色氨酸(Trp)、半胱氨酸(Cys)以外的16种氨基酸[19]。
1.3.3 等边浅蛤肉酶解产物超滤组分的制备 冻藏等边浅蛤肉解冻后加适量水用组织搅碎机匀浆,匀浆液中加水调最终料水比为1∶3(g/mL),加入原料质量分数1%的中性蛋白酶,50 ℃下酶解3 h后沸水浴灭酶15 min,酶解液于8 000 r/min离心20 min(4 ℃),收集上清。利用200 μm无机陶瓷膜微滤装置过滤除去大分子物质、胶体颗粒及杂质后选择3 ku超滤膜对其进行分级处理。
1.3.4 细胞实验
1.3.4.1 MTT法检测细胞活性 RAW264.7巨噬细胞浓度调整为1 × 105个/mL后接种到96孔板,100 μL/孔。培养16 h后加药,设空白对照组,阳性对照组 (20 μg/mL LPS) 和加药组A、B、C、D、E(浓度为4倍梯度稀释,从小到大依次为50、100、250、500、1 000 μg/mL),每个组设6个平行孔。24 h后每孔加20 μL 5%MTT溶液,孵育4 h后去除上清,加入200 μL的DMSO,充分震荡10 min,于酶标仪490 nm处检测吸光值,计算相对增殖率。
1.3.4.2 中性红法检测细胞吞噬能力 RAW264.7巨噬细胞浓度调整为5 × 105个/mL后接种到96孔板,100 μL/孔。培养16 h后加药,24 h后每孔加20 μL 10%中性红溶液,孵育2 h后去除上清,PBS洗板后加入200 μL的裂解液,充分震荡10 min,于酶标仪540 nm处检测吸光值。
1.3.5 动物实验
1.3.5.1 分组、给药 经过7 d适应期后,330只昆明小鼠随机分11组,每组30只(包括A、B组)每天定时灌胃,每周称质量,连续30 d。分为空白组(蒸馏水)、阳性组(左旋咪唑40 mg·kg-1·d-1)、酶解产物低(40 mg·kg-1·d-1)中(80 mg·kg-1·d-1)高(160 mg·kg-1·d-1)剂量组、>3 ku低(40 mg·kg-1·d-1)中(80 mg·kg-1·d-1)高(160 mg·kg-1·d-1)剂量组、<3 ku低(40 mg·kg-1·d-1)中(80 mg·kg-1·d-1)高(160 mg·kg-1·d-1)剂量组。
1.3.5.2 碳廓清指数法检测吞噬指数 按体质量从小鼠尾静脉注入稀释4倍的印度墨汁(100 mL/kg)后立即计时。注入墨汁后2、10 min,分别从小鼠的内眦静脉丛取血20 μL,并立即加入0.1% Na2CO3溶液2 mL,在600 nm处检测吸光值,以Na2CO3做空白对照。将老鼠处死后,取肝脏和脾脏,分别称质量。
= (lg1-lg2) ÷ (2-1), (1)
其中,1表示第1次取血测的吸光度;2表示第2次取血测得的吸光度,1表示注入墨汁后第1次从内眦静脉丛取血的时间;2表示注入墨汁后第2次从内眦静脉丛取血的时间。表示吞噬指数,身体表示体质量,肝表示肝质量,脾表示脾质量。
1.3.5.3 乳酸脱氢酶法(LDH)检测自然杀伤(NK)细胞活性 脾细胞悬液制备方法:无菌处死小鼠后取脾脏置盛有Hank’s液的平皿中,用注射器活塞研磨,使单个细胞游离出来;1 000×离心10 min,弃上清液,用Hank’s液洗涤后将细胞悬浮于RPMI1640完全培养液,台盼蓝染色计数活细胞数(应在95%以上),调整细胞浓度为2 × 107个/mL。制备细胞浓度为2 × 107个/mL脾细胞悬液(效应细胞)和细胞浓度为4 × 105个/mL YAC-1细胞悬液(靶细胞)。取靶细胞和效应细胞各100 µL(效靶比50∶1),加入96孔板中,细胞自然释放孔加靶细胞及培养液各100 µL,靶细胞最大释放孔加靶细胞和1% NP40各100 µL;上述各项均设3个平行孔,于37 ℃、5% CO2培养箱中培养4 h,然后将96孔板1 500 r/min离心5 min,每孔取上清100 µL于96孔板中,同时加入LDH基质液100 µL,反应3 ~ 10 min,加入1 mol/L HCl 30 µL,在490 nm处检测吸光值。
NK细胞活性=(反应孔-自然释放孔)÷
(最大释放孔-自然释放孔)。(3)
1.3.5.4 半数溶血值(HC50)法检测血清中溶血素 取用SA缓冲液200倍稀释的血清1 mL,依次加入体积分数为10% SRBC 0.5 mL,和用SA缓冲液稀释9倍的补体1 mL。另设不加血清的对照管。置37 ℃恒温水浴锅中水浴15 ~ 30min后,冰浴终止反应。2 000 r/min 离心10 min后取上清1 mL,加都氏试剂3.75 mL,体积分数为10% SRBC 0.25 mL。充分混匀后,放置10 min,于540 nm处检测吸光值。
1.3.5.5 抗体生成细胞测定 小鼠采血后,迅速摘取脾脏,用生理盐水冲洗干净,处理并配制成4 × 106个/mL浓度的脾细胞悬液。在离心管中依次加入0.5 mL的体积分数为2% SRBC细胞悬液和10%补体,另设不加补体的空白对照管,置于37 ℃水浴中温育1 h,3 000×离心10 min,取上清液于413 nm 处检测吸光值。
1.3.5.6 足趾增厚法检测迟发型变态反应(DTH) 使用体积分数为2% SRBC腹腔注射免疫四天后测量左后足趾厚度,然后再测量部位皮下注射体积分数为20% SRBC,注射24 h后测量左后足趾厚度,同一部位测量3次,取平均值。以攻击前后足趾的厚度差表示DTH的程度。
1.4 数据处理
2 结果与分析
2.1 等边浅蛤肉基本营养成分及蛋白质氨基酸组成分析
等边浅蛤肉基本营养成分含量(干基)如表1所示,其粗蛋白占53.80%,略高于文蛤(51.53%)和近江牡蛎(50.63%);粗脂肪含量占1.88%,明显低于文蛤(6.78%)与近江牡蛎(6.95%)[20-21]。可见,等边浅蛤是一种高蛋白低脂肪的水产品。

表1 等边浅蛤肉基本营养成分分析(干基)
注:试验数据以平均值士标准差(Mean ± SD)表示。
Note: the test data are expressed as Mean standard deviation (Mean ± SD).
由表2可知,等边浅蛤检测的16种氨基酸中谷氨酸含量最高,天冬氨酸次之,精氨酸、亮氨酸、甘氨酸、赖氨酸和丙氨酸含量也比较高,其中人体必需氨基酸含量较高,占总氨基酸比例为35.17%。谷氨酸和天冬氨酸不仅是鲜味氨基酸,还是脑营养剂,是人类消耗最大的氨基酸,能够促进神经细胞兴奋,对大脑功能和中枢神经系统的正常活动具有重要意义[22]。有研究表明,补充外源性谷氨酰胺能有效预防运动导致的免疫抑制[23]。精氨酸能够保护胸腺、提高巨噬细胞的活性和对肿瘤细胞的杀伤功能、刺激机体IL-2升高和抑制肿瘤细胞的生长[24]。
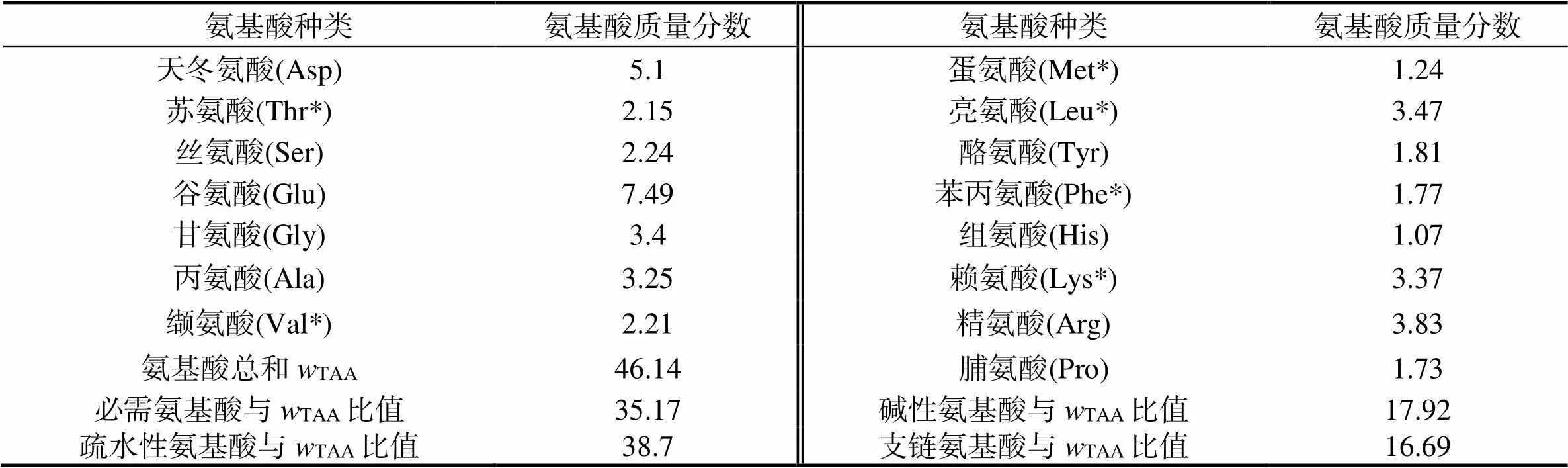
表2 等边浅蛤蛋白质的氨基酸组成
注:*为必需氨基酸。表中疏水性氨基酸含量是指 Phe、Val、Leu、Ile、Pro、Ala、Gly 7种氨基酸总和占氨基酸总量的值;碱性氨基酸含量是指His、Arg、Lys 3种氨基酸总和占氨基酸总量的值;支链氨基酸含量是指 Val、Leu、Ile 3种氨基酸总和占氨基酸总量的值。
Note: essential amino acid marked with *. The hydrophobic amino acid content in the table refers to the total amino acid content of Phe, Val, Leu, Ile, Pro, Ala and Gly. Basic amino acid content refers to the total amino acid value of His, Arg and Lys. Branched chain amino acid content refers to the total amino acid content of Val, Leu and Ile.
2.2 等边浅蛤肉酶解产物超滤组分的体外免疫活性评价
2.2.1 对小鼠RAW264.7细胞增殖能力的影响 巨噬细胞是体内主要抗原递呈细胞,在机体中不仅执行非特异性免疫应答的效应功能,而且通过递呈抗原启动特异性免疫应答[25]。因此,本实验采用RAW264.7小鼠单核巨噬细胞模拟体内巨噬细胞参与免疫调节过程。如图1所示,在质量浓度为50 ~ 1 000 μg/mL的范围内等边浅蛤肉酶解产物的>3 ku和<3 ku这两个超滤组分对RAW264.7细胞增殖作用,均呈现先上升后下降趋势,且均在质量浓度为250 μg/mL时具有最大值,其中<3 ku超滤组分的相对增殖率为126.22%(<0.05)。与LPS阳性对照组相比,>3 ku超滤组分仅在质量浓度为250 μg/mL时,对RAW264.7细胞的增殖作用更显著(<0.05)。而<3 ku超滤组分在质量浓度为50、100、250及500 μg/mL时均显著高于>3 ku超滤组分及LPS阳性对照组。说明等边浅蛤肉酶解产物的>3 ku超滤组分各质量浓度对RAW264.7细胞无毒性,且能不同程度地促进细胞生长和增殖作用。根据研究表明[26]绿豆肽可促进RAW264.7巨噬细胞的增殖。与绿豆肽比较,等边浅蛤酶解产物超滤组分对于增强RAW264.7巨噬细胞的增殖作用有较好效果。
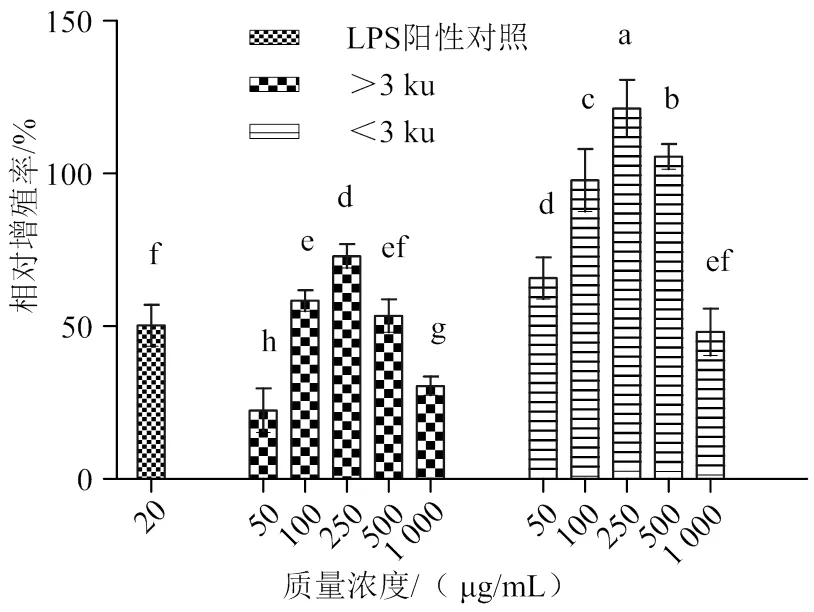
凡含一个相同字母者表示差异不显著(P > 0.05)
2.2.2 对小鼠RAW264.7细胞吞噬中性红能力的影响 活化巨噬细胞最显著的特征之一是吞噬作用激增,这是巨噬细胞对病原体和癌细胞反应的第一步,也是至关重要的一步[27]。如图2所示,随着质量浓度增加,两个超滤组分对RAW264.7细胞吞噬中性红能力均呈现先上升后下降趋势,在质量浓度为250 μg/mL时达到最大值,且<3 ku超滤组分效果最好。在质量浓度为100、250及500 μg/mL时,<3 ku超滤组分的吸光值均显著高于>3 ku超滤组分(<0.05)。与阳性对照组相比,>3 ku超滤组分在质量浓度为250 μg/mL时与LPS对照组无显著性差异,其余情况均低于阳性对照组。<3 ku组分在质量浓度为250 μg/mL时对RAW264.7细胞的吞噬作用均显著高于LPS阳性组(<0.05),且在质量浓度为100及500 μg/mL时,与LPS阳性对照组无统计学差异(>0.05)。与韦懿芳等[28]实验结果相比,等边浅蛤肉酶解产物的超滤组分促进RAW264.7细胞吞噬抗原的能力更好,说明<3 ku超滤组分能有效促进RAW264.7细胞吞噬抗原。研究人员发现,文蛤[8]、牡蛎[12]、青蛤[29]中存在小分子肽能促进巨噬细胞吞噬活性。有文献报道[30]巨噬细胞的非炎性吞噬作用受到抗炎细胞因子的调控。因此,<3 ku超滤组分可能是通过抗炎因子对巨噬细胞的吞噬作用进行调控。

凡含一个相同字母者表示差异不显著(P > 0.05)
2.3 等边浅蛤肉酶解产物超滤组分体内免疫活性评价
2.3.1 对小鼠碳廓清实验及NK细胞活性的影响 巨噬细胞是一类非特异性免疫细胞,活化后可通过对异物的吞噬、向机体免疫系统提呈抗原以及释放炎性细胞因子,清除病原微生物与衰老细胞,促进炎症反应,诱发特异性免疫反应,在非特异免疫中起重要作用,因此可以通过单核吞噬细胞的吞噬指数及NK细胞活性指标来评价等边浅蛤肉酶解产物超滤组分对小鼠非特异性免疫的影响[31]。如图3A所示,与空白组相比,阳性组、酶解产物及两超滤组分的高、中、低剂量组的吞噬指数均显著高于空白组(<0.05),且<3 ku超滤组分的高剂量组吞噬指数最大,说明<3 ku超滤组分能有效提高体内碳颗粒被清除的速率,且呈现剂量效应关系。NK细胞活性实验中,如图3B所示,与空白组相比,阳性组、酶解产物及两超滤组分的高中低剂量组均显著高于空白组(<0.05),且<3 ku超滤组分中剂量组的NK细胞活性最大,说明<3 ku超滤组分能有效提高NK细胞的活性。因此,酶解产物及两个超滤组分都能提高小鼠机体非特异性免疫功能,但<3 ku超滤组分效果最明显。NK细胞的功能是由NK细胞自身以及其他细胞如T细胞和单核吞噬细胞共同产生的免疫调节细胞因子介导和调节的。IL-2和IFN-γ是介导NK活性最重要的细胞因子[32]。因此,等边浅蛤肉酶解产物超滤组分可能是通过调控NK细胞本身和单核吞噬细胞等分泌IL-2和IFN-γ等细胞因子来提高NK细胞的免疫能力。
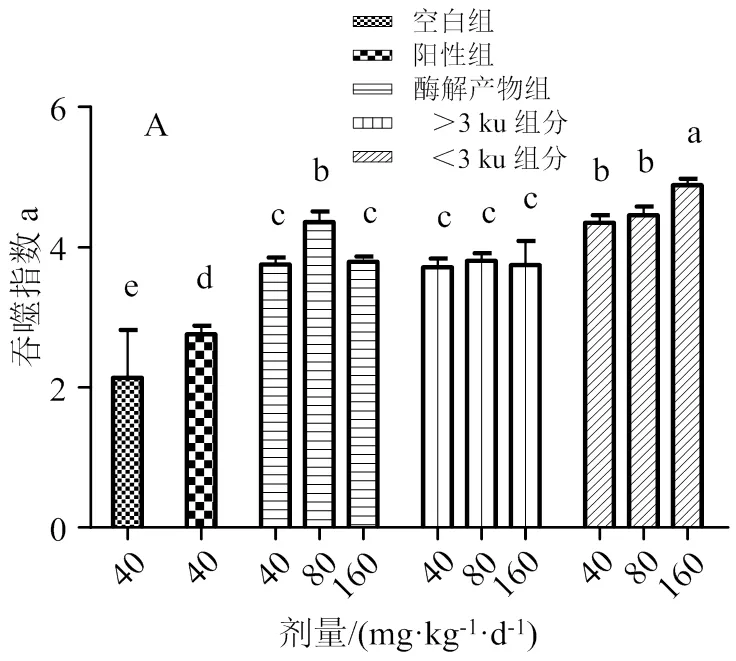
凡含一个相同字母者表示差异不显著(> 0.05)
The data with a same letter mean no significant difference at 0.05 level
图3 不同组分对单核吞噬细胞吞噬指数(A)和NK细胞活性(B)的影响
Fig. 3 Effects of different components on the phagocytosis index of mononuclear phagocytes(A) and NK cell activity(B)
2.3.2 对血清溶血素含量及抗体生成细胞数的影响 体液免疫是通过 B 淋巴细胞介导产生抗体来达到保护目的的免疫机制。SRBC免疫小鼠后,B淋巴细胞分泌溶血素,血清中溶血素的含量和抗体生产细胞数量可用于评估体液免疫功能的状态[33]。一般用半数溶血值来表示血清溶血素的含量,如图4A所示,与空白组相比,阳性组、酶解产物及两个超滤组分的高、中、低剂量组均显著高于空白组(<0.05),且<3 ku组分的中、高剂量组半数溶血值最大,说明<3 ku组分的中、高剂量组能够有效促进浆细胞分泌抗体。抗体生成细胞的数量通过定量溶血分光光度计法检测,如图4B所示,与空白组相比,阳性组、酶解产物及两超滤组分的高、中、低剂量组均显著高于空白组(<0.05),其中<3 ku超滤组分低、中剂量组的抗体生成细胞最多,说明该组份能有效促进小鼠机体的B细胞分化为浆细胞。因此,酶解产物及两超滤组分都能提高小鼠机体特异性免疫中的体液免疫功能,但<3 ku超滤组分效果最明显。

凡含一个相同字母者表示差异不显著(> 0.05)
The data with a same letter mean no significant difference at 0.05 level
图4 不同组分对抗体生产细胞数量的影响(A)和不同组分对血清溶血素的影响(B)
Fig. 4 Effect of different components on the number of cells producing antibodies(A) and serum hemolysin(B)
2.3.3 对小鼠迟发型变态反应的影响 检测迟发型变态反应程度(DTH)可以评估小鼠机体特异性免疫中的细胞免疫的影响,DTH一般用被攻击部位的肿胀程度来表示[34]。如图5所示,与空白组相比,阳性组、酶解产物及两个超滤组分的高中低剂量组的足趾厚度差值均显著高于空白组(<0.05),且<3 ku超滤组分的高中低剂量组足趾厚度差值最大,无显著性差异。说明<3ku超滤组分可有效促进小鼠机体T细胞分化为效应T细胞。李婉等[12]在对牡蛎免疫活性成分研究中发现,牡蛎的酶解产物超滤组分能够增强正常小鼠的DTH,有效增强由T淋巴细胞介导的特异性免疫反应。而Yu等[6]对青蛤中的多肽对免疫缺陷小鼠的免疫增强作用研究中发现,SCSP可增强免疫抑制小鼠的细胞免疫功能,调节T淋巴细胞亚群的异常分布并改善免疫受损小鼠的细胞免疫状态。因此,等边浅蛤肉酶解产物及两个超滤组分能提高小鼠机体特异性免疫中的细胞免疫功能,尤其<3 ku超滤组分效果较明显。
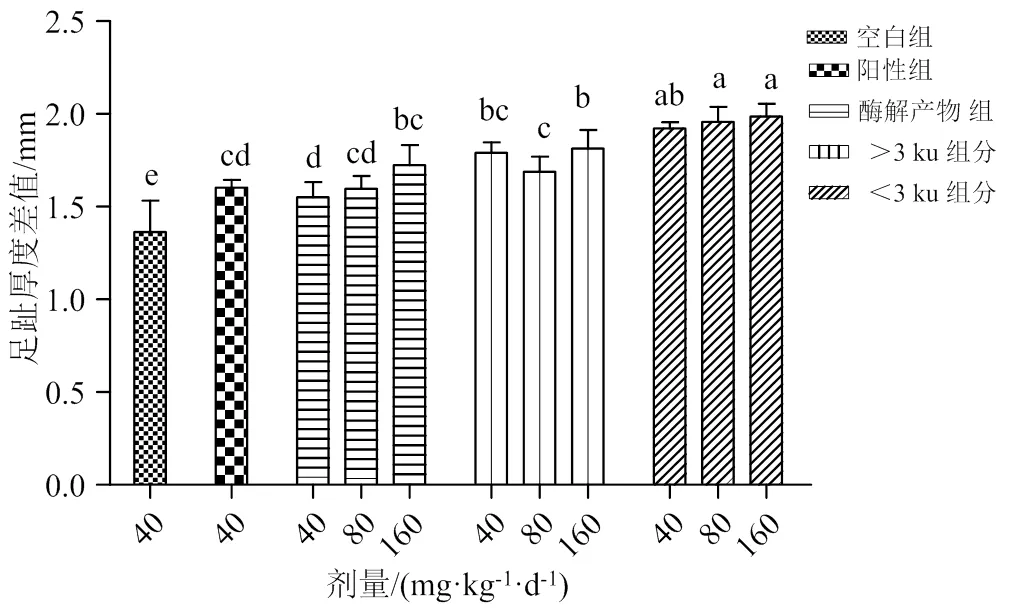
凡含一个相同字母者表示差异不显著(P > 0.05)
3 结论
等边浅蛤具有高蛋白低脂肪的特点,其氨基酸种类和含量丰富,且谷氨酸、天冬氨酸、精氨酸等与免疫功能有关的氨基酸含量丰富。细胞实验表明,等边浅蛤肉酶解产物<3 ku超滤组分具有增强巨噬细胞增殖和吞噬作用,有增强非特异性免疫反应的潜力。动物实验表明,等边浅蛤肉酶解产物<3 ku超滤组分能增强肝单核巨噬细胞的吞噬作用,促进NK细胞活性、抗体生成、抗体产生细胞生成和迟发型超敏反应,有增强特异性免疫反应的潜力。因此等边浅蛤酶解产物的<3 ku超滤组分具有较强的免疫调节作用。
[1] 刘国栋, 王桦, 汪琦, 等. 四大类主要慢性病流行现状与应对策略[J]. 中国社会医学杂志, 2017(1): 53-56.
[2] 李浩然, 高丹丹, 陈桂芳, 等. 食源性免疫活性肽的研究进展[J]. 食品工业科技, 2018, 39(22): 304-308.
[3] 程媛, 曹慧, 徐斐, 等. 食源性蛋白中免疫活性肽的研究进展[J]. 食品科学, 2015, 36(17): 296-299.
[4] 邓志程, 张迪, 吉宏武, 等. 马氏珠母贝免疫活性肽的纯化与鉴定[J]. 广东海洋大学学报, 2017, 37(4): 78-86.
[5] Li W, Ye S W, Zhang Z W, et al. Purification and characterization of a novel pentadecapeptide from protein hydrolysates ofand its immunomodulatory effects on RAW264.7 cells[J]. Marine drugs, 2019, 17(1): 30-45.
[6] Yu F M, Zhang Z W, Ye S W, et al. Immunoenhancement effects of pentadecapeptide derived from Cyclina sinensis on immune-deficient mice induced by Cyclophosphamide[J]. Journal of Functional Foods, 2019, 60: 103408-103409.
[7] 何小庆. 波纹巴非蛤活性肽的酶法制备及其免疫活性的研究[D]. 湛江:广东海洋大学, 2014.
[8] 叶蕾, 阎洁, 张文, 等. 文蛤寡肽对RAW264.7细胞的免疫调节作用[J]. 水产学报, 2019, 43(2): 410-418.
[9] Schmeer M R. Growth-inhibiting agents from mercenaria extracts: chemical and biological properties[J]. Science, 1964, 28(3): 413-414.
[10] Schmeer A C. Chemical characterization and biological activity of an anticancer agent of marine origin[J]. Physiological Chemistry and Physics, 1979, 21(11): 415-424.
[11] 刘淑集, 许旻, 苏永昌, 等. 牡蛎寡肽对免疫低下小鼠模型免疫功能的影响[J]. 华南师范大学学报(自然科学版), 2018, 50(2): 70-76.
[12] 李婉, 曹文红, 章超桦,等. 牡蛎酶解产物的组成特点及其体外免疫活性[J]. 食品工业科技, 2017, 38(16): 35-42.
[13] Wang Y K, He H L, Wang G F, et al. Oyster () hydrolysates produced on a plant scale have antitumor activity and immunostimulating effects in BALB/c mice[J]. Marine Drugs 2010, 8: 255–268.
[14] 张彩梅, 刘晓萍, 张红梅, 等. 扇贝多肽对小鼠非特异性免疫功能的调节作用[J]. 中国海洋药物, 2006(5): 38-40.
[15] Qin C L, Huang W, Zhou S Q, et al. Characterization of a novel antimicrobial peptide with chiting-biding domain from Mytilus coruscus[J]. Fish & Shellfish Immunology, 2014, 41: 362–370.
[16] 庄启谦. 中国动物志(软体动物门双壳纲帘蛤科)[M]. 北京: 科学出版社, 200l: 211-212.
[17] 尤仲杰, 王一农, 颜正荣, 等. 等边浅蛤的群体组成与生长[J]. 台湾海峡, 1991(1): 54-60.
[18] 黄继, 张海鸣, 王峥, 等. 等边浅蛤人工育苗中几个技术问题的探讨[J]. 海峡科技与产业, 2016(7): 135-136.
[19] 何小庆, 曹文红, 章超桦, 等. 波纹巴非蛤蛋白酶解产物的抗氧活性及分子量分布研究[J]. 现代食品科技, 2014, 30(1): 74-80.
[20] 张安国, 李太武, 苏秀榕, 等. 同地理群体种群文蛤的营养成分研究[J]. 水产科学, 2006, 25(2): 79-81.
[21] 章超桦, 吴红棉, 洪鹏志, 等. 马氏珠母贝肉的营养成分及其游离氨基酸组成[J]. 水产学报, 2000, 24(2): 180-184.
[22] Lin L, Li B F. Radical scavenging properties of protein hydrolysates from jumbo flying squidSteenstrup) skin gelatin [J]. Journal of the Science of Food and Agriculture, 2006, 86(14): 2290-2295.
[23] Castell L M, Poortmans J R, Newsholme E A. Dose glutamine have a role in reducing infections in athletes?[J]. European Journal of Applied Physiology and Occupational Physiology, 1996, 73: 488-490.
[24] 陈大伟, 黎介寿. 精氨酸对代谢和免疫功能的调节作用[J]. 国外医学.创伤与外科基本问题分册, 1990(3): 132-135.
[25] Yi Y, Liao S T, Zhang M W, et al. Immunomodulatory activity of polysaccharides protein complex of Longan () [J]. Molecules, 2011, 16(12): 10324-10336.
[26] 刁静静, 迟治平, 孙迪, 等. 绿豆肽对RAW264.7巨噬细胞的免疫调节作用[J]. 中国生物制品学杂志, 2019, 32(9): 950-957.
[27] Waqas A, Ibrahim J, Endang K, et al. Immunomodulatory effects ofextract and its major compounds on the immune functions of RAW264.7 macrophages [J]. International Immunopharmacology, 2018, 60: 141-151.
[28] 韦懿芳, 屈思雨, 王丁丁, 等. 干贝蛋白酶解物对免疫细胞的影响研究[J]. 中国保健营养, 2019, 29(14): 52-53.
[29] 叶盛旺, 杨最素, 李维, 等. 青蛤酶解多肽对RAW264.7巨噬细胞的免疫调节作用[J]. 食品科学, 2019, 40(7): 185-191.
[30] Divate R D, Chung Y C. In vitro and in vivo assessment of anti-inflammatory and immunomodulatory activities ofmycelium[J]. Journal of Functional Foods, 2017, 35: 81-89
[31] 任国庆, 邹晓峰, 韩亚男, 等. 人参全草免疫调节作用研究[J]. 中国现代中药, 2019, 21(1): 54-61.
[32] R Y, Zhang Z F, PEI X R, et al. Immunomodulatory effects of marine oligopeptide preparation from Chum Salmon () in mice [J]. Food Chemistry, 2009, 113(2): 464-470.
[33] Joël L M, Paul S, MarcE W. Effect of age on humoral immunity, selection of the B-cell repertoire and B-cell development[J]. Immunological Reviews, 1997, 160: 115-126.
[34] Akagawa K S, Tokunaga T. Delayed-type hypersensitivity (DTH) in BCG-sensitized mice I. Lack of suppressor T cell activity on DTH to sheep red blood cells[J]. Microbiology and Immunology, 1979, 23(5): 403-14.
Immunomodulatory effects of the ultrafiltration fractions of enzymatic hydrolysates from the edible part of
DING Pei-xi1, ZHANG Chao-hua1,2,3,4,5, GAO Jia-long1,2,3,4,5, QIN Xiao-ming1,2,3,4,5,CAO Wen-hong1,2,3,4,5, ZHENG Hui-na1,2,3,4,5, LIN Hai-sheng1,2,3,4,5
(1.,,524088,;2.,116034,;3.//4.,524088,//5.,524088,)
This study investigated the essential nutrients, amino acid composition of protein and the immunoactivity of the ultrafiltrated enzymatic hydrolysis products ofmeat.A 3 ku ultrafiltration membrane was used to separate the neutral protease hydrolyzate of the,and then cell and in vivo experiments were conducted to test the immunomodulatory effects of ultrafiltration components.meat has high contents of protein and low fat level. Its amino acid species and content are rich. Result of cell experiments showed that the relative proliferation rate and the ability to devour neutral red of ultrafiltration component with MW <3 ku were higher than those of the positive control group (<0.05). When the mass concentration is 250 μg/mL the relative proliferation rate was as high as 126.2%. In vivo data showed that the degree of delayed allergic reaction (DTH), hemolytic value (HC50), the number of antibody-producing cells, phagocytic index and NK cell activity were higher than these of controls (<0.01). Both cell culture and in vivo results showed that the immunomodulatory effect of the ultrafiltration component with molecular weight <3 ku was better than that of >3 ku.The <3 ku hydrolyzate fraction from the ofhas immunomodulatory effects.
; Enzymatic hydrolysate; Ultrafiltration fractions; Immunomodulatory effects
TS254.1
A
1673-9159(2020)03-0114-08
10.3969/j.issn.1673-9159.2020.03.015
2019-12-31
广东海洋大学创新强校工程重大科研成果培育计划(GDOU2017052606);国家贝类产业技术体系项目(CARS-49);广东普通高等学校水产品高值化加工与利用创新团队项目(GDOU2016030503)
丁霈希(1994-),女,硕士研究生,主要研究方向为水产品高值化利用。E-mail:18320274250@163.com
章超桦,教授。E-mail:zhangch2@139.com
丁霈希,章超桦,高加龙,等. 等边浅蛤肉酶解产物超滤组分免疫调节作用[J].广东海洋大学学报,2020,40(3):114-121.
(责任编辑:刘岭)
