炔诺酮对斑马鱼肠道免疫调节因子的干扰效应
2020-08-31梁燕秋司徒艳结董忠典许文强梁杏仪景占鑫
梁燕秋,司徒艳结,董忠典,许文强,梁杏仪,景占鑫
炔诺酮对斑马鱼肠道免疫调节因子的干扰效应
梁燕秋1,司徒艳结1,董忠典2,许文强1,梁杏仪1,景占鑫1
(1. 广东海洋大学化学与环境学院,广东 湛江 524088;2. 广东海洋大学水产学院,广东 湛江 524088)
【】研究孕激素炔诺酮对斑马鱼 () 肠道免疫调节因子的干扰效应。将成年斑马鱼分别在含0、7、84和810 ng/L炔诺酮的水环境中暴露90 d,分析炔诺酮对斑马鱼肠道组织中核转录因子κB(NF-κB),细胞因子α干扰素(IFN-α)、白细胞介素1α(IL-1α)、白细胞介素1β(IL-1β)、肿瘤坏死因子α(TNF-α)等含量的影响。炔诺酮主要在810 ng/L时显著提高雌鱼肠道组织中IFN-α、IL-1α和TNF-α含量,以及雄鱼肠道组织中NF-κB、IFN-α、IL-1α、IL-1β和TNF-α含量。炔诺酮可激活斑马鱼肠道组织中NF-κB信号通路,促进细胞因子的分泌,从而诱导斑马鱼肠道发生炎症反应。
斑马鱼;肠道免疫;炔诺酮;孕激素;干扰;细胞因子;核转录因子κB
孕激素是一种类固醇激素,广泛用于人类避孕药物以及治疗激素引起的各项疾病[1-3],还广泛用于畜牧业,以提高动物产量和增肥[4-5]。这导致受纳环境存在不同浓度的孕激素[2,6],其中炔诺酮(Norethindrone,NET)在加拿大和马来西亚污水处理厂出水中质量浓度高达159和188 ng/L[7-8],在中国养猪场冲刷水中质量浓度达143 ng/L[9]。美国受废水排放河流中检测出高浓度NET (872 ng/L)[10]。水环境中残留的NET会对生物的生长发育和生殖系统产生不良影响。已有文献报道,NET可抑制黑头呆鱼()和日本青鳉()产卵量[11],可引起雌鱼发生雄性化[11-12],还可改变斑马鱼性别比例,导致更多雄鱼产生[13]。此外,黑头呆鱼早期发育阶段暴露于NET可抑制其存活和生长[14]。笔者亦报道,斑马鱼()长期暴露于NET会抑制生长,抑制卵巢成熟,诱导精巢发育,改变与生殖相关基因的转录表达水平[15]。迄今,关于孕激素对生物免疫功能和炎症反应的研究主要集中于对人类和哺乳动物的干扰效应[16-18]。然而,关于孕激素NET对生物免疫系统干扰效应,尤其是对鱼类肠道免疫调节因子的干扰效应研究未见报道。
鱼类肠道黏膜层不仅是消化吸收营养物质的场所,还是机体内复杂的免疫组织[19],通过肠道相关淋巴组织(Gut-associated lymphoid tissues,GALT)发挥免疫防御和免疫调节作用。GALT含有许多巨噬细胞、浆细胞、淋巴细胞等免疫细胞。免疫细胞受到一些刺激物诱导后,可分泌调节细胞功能的小分子可溶性蛋白——细胞因子[20]。细胞因子可促进细胞生长分化和免疫系统发育,对机体免疫功能有重要调节作用。在斑马鱼中,细胞因子研究主要包括α干扰素(Interferon α,IFN-α)、白细胞介素1α(Interleukin 1α,IL-1α)、白细胞介素1β(Interleukin 1β,IL-1β)、肿瘤坏死因子α(tumor necrosis factor α,TNF-α)等,可通过激活核转录因子κB(Nuclear factor-kappa B,NF-κB)信号通路调控这些细胞因子的产生[21]。这些免疫调节因子是炎症反应的重要组成部分。
笔者研究成年斑马鱼长期暴露于低剂量NET后,肠道NF-κB、IFN-α、IL-1β、IL-1α和TNF-α等5种免疫调节因子的变化,探究NET对斑马鱼肠道细胞免疫影响,为评价孕激素的生态健康风险提供科学依据。
1 材料与方法
1.1 试验化合物
NET购于德国TRC公司,纯度≥98%,取25 mg的NET溶于二甲基亚砜(DMSO),制成质量浓度为100 mg/L的母液,放置- 20 ℃下待用。
1.2 实验鱼类
健康的成年斑马鱼饲养在广东海洋大学水生毒理实验室,水温(26±1)℃,水的氧饱和度大于70%,pH控制在7 ~ 8,光暗周期14 h:10 h。每天上午和下午投喂新孵化的卤虫()。
1.3 暴露实验设计
选取20 L的鱼缸作为暴露容器,暴露水体积为12 L,水体中NET未检出。设置12缸,每缸随机放入雌、雄健康斑马鱼各8尾,雄鱼全长(3.67 ± 0.18)cm、体质量(0.37 ± 0.06)g,雌鱼全长为(3.60 ± 0.13)cm、体质量(0.31 ± 0.03)g。根据文献[7-10]报道以及普通河流中的NET浓度[6],暴露实验设置10、100、1 000 ng/L 3个质量浓度组和一个溶剂对照组(体积分数0.001% DMSO),各组设3个平行组。所有NET暴露组均含有体积分数0.001% DMSO助溶剂。暴露期间,每48 h换水1次。饲养条件同1.2,并用虹吸管吸走粪便及食物残渣。暴露期间,每周测定水体pH值、溶解氧、电导率等参数,每天统计斑马鱼死亡数量。在暴露90 d后,将斑马鱼至于冰上麻醉、解剖,无菌采集肠道组织,立即放入液氮中速冻,然后转入-80 ℃下保存。
1.4 肠道免疫因子分析
对每个平行中收集的所有肠道组织称取质量,加入500 μL生理盐水,匀浆,以3 000 r/min离心10 min,取上清液,根据酶联免疫试剂盒(上海酶联生物有限公司)说明书方法测定斑马鱼肠道组织中NF-κB、IFN-α、IL-1β、IL-1α和TNF-α等免疫调节因子的含量。
1.5 暴露溶液中NET的测定
所有处理组水样在暴露50、86 d的换水后(0)和换水前(48)采集。水样分析方法参考文献[9, 15]。从每个平行中收集1 L水样,每个处理组3个平行,共12个水样,使用固相萃取柱(Waters HLB,6 mL,500 mg)富集水样中NET,用9 mL色谱纯的乙酸乙酯对固相萃取柱进行洗脱。将收集的洗脱液放在缓慢吹出的氮气气流中吹干乙酸乙酯。用1 mL色谱纯的甲醇将氮吹后残留在玻璃管中的物质重新溶解,随后密封于2 mL进样小瓶,置于-20 ℃中避光保存,备测。采用高效液相色谱串联质谱(RRLC-MS/MS)(Agilent 1290 LC-Agilent 6460 QQQ, USA)测定NET浓度。NET检测限和回收率分别为0.02 ~ 0.24 ng/L和72% ~ 107%[9]。NET在3个处理组的实测质量浓度分别为7、84和810 ng/L,溶剂控制组未测到NET。下文以NET的实测浓度表示。
1.6 数据分析
所得数据以平均数±标准差的形式来表示,采用Spss13.0进行数据处理和统计分析,并用OriginPro 2016作图。采用单因素ANOVA检验分析方法中的Tukey多重比较法分析溶剂对照组与NET处理组免疫调节因子含量差异的显著性,≤0.05(*)、≤0.01(**)、≤0.001(***)时,差异有统计学意义。
2 结果
2.1 NET对斑马鱼肠道组织中NF-κB含量的影响
斑马鱼雌鱼和雄鱼肠道组织中NF-κB含量测定结果如图1所示。NET在7和84 ng/L时对雌性斑马鱼肠道中NF-κB含量无显著影响,在810 ng/L时NF-κB平均值提高,但与对照组无显著性差异(图1A)。在雄鱼肠道组织中,NET在7 ng/L时NF-κB含量平均值低于对照组,但与对照组无显著性差异(图1B);NET在810 ng/L时显著提高雄鱼肠道组织中NF-κB含量(< 0.05),但在84 ng/L时没有改变NF-κB水平(图1B)。

图1 不同浓度NET处理90 d后斑马鱼肠道组织中NF-κB含量变化
2.2 NET对斑马鱼肠道组织中IFN-α含量的影响
雌性和雄性斑马鱼肠道组织中IFN-α含量测定结果如图2所示。雌鱼肠道中,7和84 ng/L暴露组IFN-α含量平均值较对照组有一定提高,但变化无统计学意义(图2A);NET在810 ng/L时显著提高肠道IFN-α水平(< 0.01)(图2A)。在雄鱼肠道组织中,IFN-α含量在7 ng/L时有下降趋势,但差异无统计学意义(图2B);NET在84 ng/L时未改变肠道IFN-α水平,但在810 ng/L时显著提高IFN-α含量(< 0.05)(图2B)。

图2 不同浓度NET处理90 d后斑马鱼肠道组织中IFN-α含量变化
2.3 NET对斑马鱼肠道组织中IL-1α含量的影响
雌、雄性斑马鱼肠道组织中IL-1α含量测定结果见图3。雌鱼肠道中,随NET暴露浓度的上升,IL-1α含量平均值不断升高(图3A),但仅在810 ng/L时显著提高IL-1α含量水平(< 0.05)(图3A)。雄鱼肠道中,NET在7和84 ng/L时IL-1α含量无显著变化,在810 ng/L时显著提高IL-1α含量(<0.001)(图3B)。
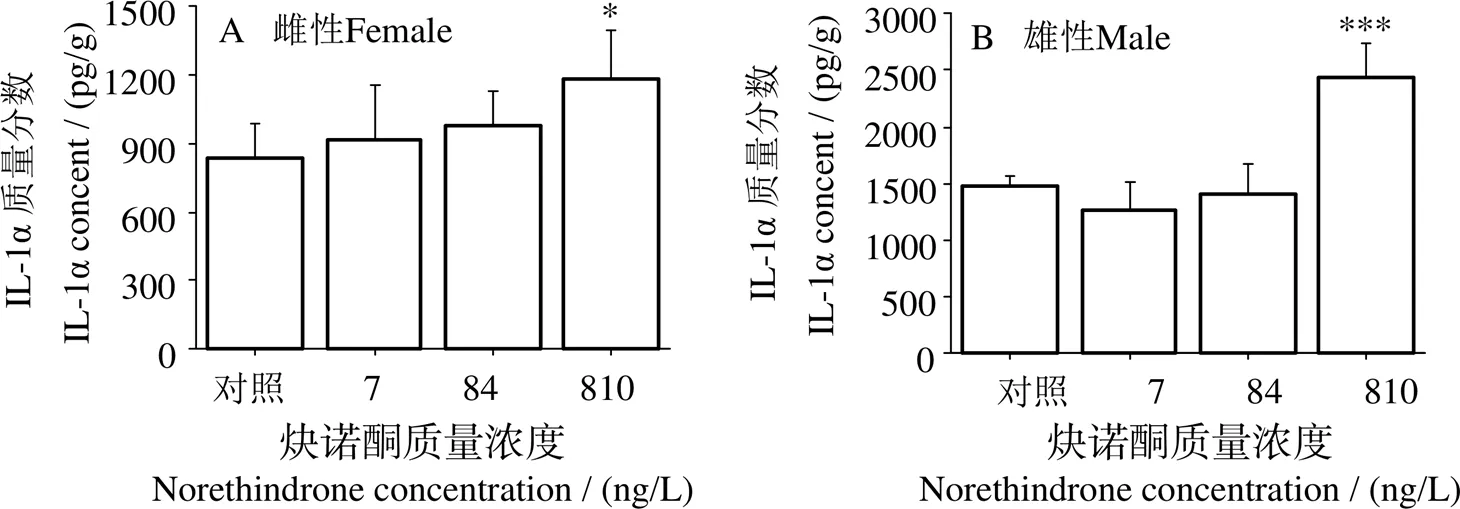
图3 不同浓度NET处理90 d后斑马鱼肠道组织中IL-1α含量变化
2.4 NET对斑马鱼肠道组织中IL-1β含量的影响
图4可见,在雌鱼肠道中,各组IL-1β含量差异无统计学意义,仅在7 ng/L NET处理组有下降趋势(图4A)。在雄鱼肠道组织中,NET暴露在7 ng/L时显著降低IL-1β含量(<0.01),在810 ng/L时亦显著提高了IL-1β水平(<0.05),而在84 ng/L时IL-1β含量,但无明显变化(图4B)。

图4 不同浓度NET处理90 d后斑马鱼肠道组织中IL-1β含量变化
2.5 NET对斑马鱼肠道组织中TNF-α含量的影响
雌、雄斑马鱼鱼肠道组织中TNF-α含量测定结果如图5所示。在雌鱼肠道组织中,随着NET暴露浓度不断提高,TNF-α含量平均值不断提升,在810 ng/L时TNF-α水平有统计学意义(<0.01)(图5A)。在雄鱼肠道组织中,NET仅在810 ng/L时显著提高TNF-α水平(<0.001),在7、84 ng/L NET处理组TNF-α含量差异无统计学意义,但7 ng/L组平均值有所下降(图5B)。
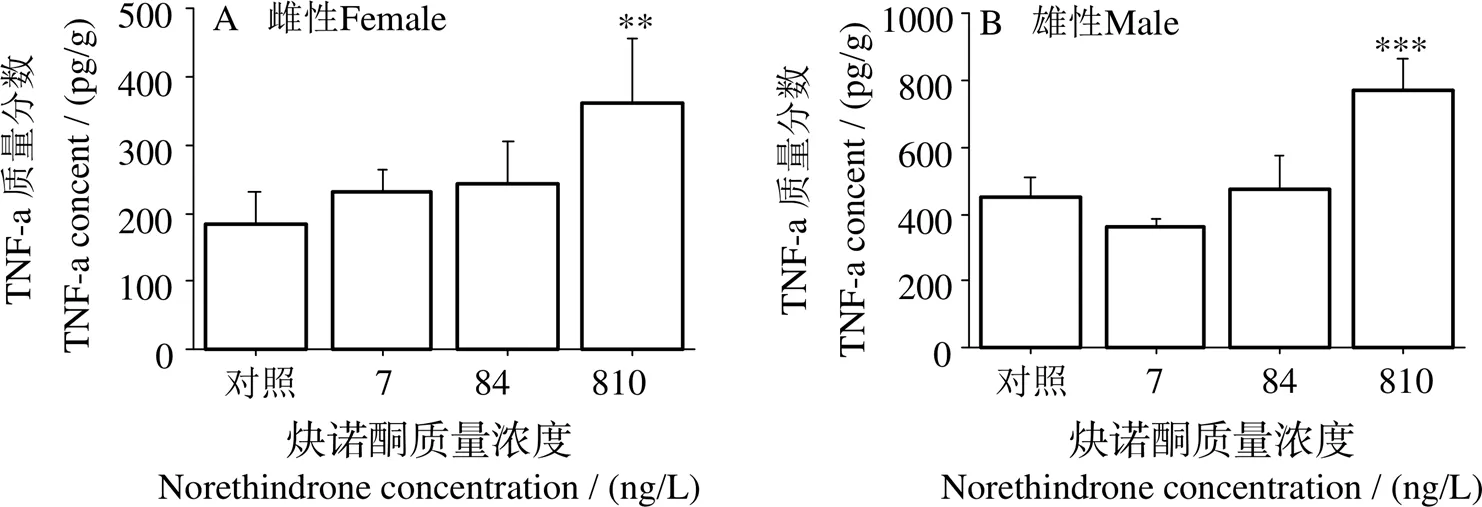
图5 不同浓度NET处理90 d后斑马鱼肠道组织中TNF-α含量变化
3 讨论
本研究表明,NET主要在高浓度组(810 ng/L)对肠道组织中NF-κB、IFN-α、IL-1α、IL-1β和TNF-α产生显著影响,提高了它们的含量,对肠道免疫系统有潜在的干扰效应。
核转录因子κB(NF-κB)蛋白家族参与免疫细胞活化和组织应激性反应,在生物中广泛存在[20,22]。NF-κB可调控细胞因子的产生,在细胞的免疫应答和炎症反应中起关键作用。本研究发现,NET在最高浓度组诱导了雄鱼肠道组织NF-κB的表达,且对雌鱼肠道组织NF-κB水平也有提高趋势,进而调控细胞因子IFN-α、IL-1α、IL-1β和TNF-α的产生。本研究也检测到这些细胞因子含量在NET处理下显著上升。
干扰素(IFN)是一种特殊的分泌蛋白或糖蛋白,是人体或动物机体对环境中各种刺激(包括病毒)而产生的,通过调节干扰素刺激基因的转录表达来达到发挥抗病毒的作用[23]。干扰素有较强的免疫调节、抗肿瘤、抗病毒能力,主要包括IFN-α、IFN-β、IFN-γ三类。研究发现,病毒的感染可诱导斑马鱼IFN的表达,诱导斑马鱼的免疫应答[24]。本研究中,NET在810 ng/L时显著诱导了雌、雄斑马鱼肠道组织中IFN-α表达,表明环境中残留的NET可诱导斑马鱼肠道干扰素的产生,从而对环境中NET做出免疫应答效应,保护斑马鱼免受NET的污染,有潜在抗污染能力。
白细胞介素(IL)是一类由免疫细胞或白细胞产生且在免疫应答中发挥极为重要作用的糖蛋白。可参与炎症反应,促进炎症的产生[25],鱼类体内存在IL-1α与IL-1β两种类型的分子。本研究发现,高浓度组NET主要提高了IL-1α和IL-1β的含量,暗示NET可加剧斑马鱼肠道组织的炎症反应,防止机体受外来物质的干扰。值得注意的是,NET在极低浓度时(7 ng/L)可降低雄鱼肠道组织IL-1β含量,可能与暴露浓度有关,具体原因有待进一步研究。
肿瘤坏死因子(TNF)是具有生物活性的细胞因子,主要分为TNF-α和TNF-β两种亚型,TNF-α由单核巨噬细胞产生,而TNF-β由T细胞产生。斑马鱼TNF主要是由活化的巨噬细胞所分泌的TNF-ɑ亚型,已有研究显示,斑马鱼体内的TNF-ɑ与哺乳动物体内的TNF-ɑ相似[20, 26],因而重点研究TNF-ɑ在斑马鱼肠道中的表达量。研究发现NET可显著提肠道TNF-ɑ含量,进而使机体肿瘤细胞发生坏死,从而保护机体免受污染物侵袭。
环境中NET等孕激素物质进入斑马鱼,会对斑马鱼肠道组织产生一定影响,而斑马鱼肠道组织将以产生炎症来抵御NET引起的损伤,并分泌免疫调节因子以激起机体的免疫应答,进而诱导免疫细胞对机体的炎症进行修复。湛江近海沉积物中,多氯联苯可诱导斑马鱼肠道IL-1β、IL-8和TNF-α基因的转录表达[20];多溴联苯醚(DE-71)可提高斑马鱼肠道中IL-1β水平[27];聚苯乙烯微塑料也可提高斑马鱼肠道中IL-1α、IL-1β、IFN基因的转录表达水平和蛋白水平[28]。这些环境污染物对免疫调节因子的影响,可反映斑马鱼机体发生炎症以及受损情况。因此,免疫调节因子的含量变化可以用于监测环境污染物的污染情况。
[1]Kejuan F, Meirik O, Yongang D, et al. Once-a-month contraceptive pills in China: a review of available evidence [J]. Contraception, 2007, 75: 337-343.
[2] Kumar V, Johnson AC, Trubiroha A, et al. The challenge presented by progestins in ecotoxicological research: A critical review[J]. Environmental Science & Technology, 2015, 49: 2625-2638.
[3] Qureshi M, Attaran M. Review of newer contraceptive agents[J]. Cleveland Clinic Journal of Medicine, 1999, 66: 358-366.
[4] Mortensen S K, Pedersen M. Confirmatory analysis of acetylgestagens in plasma using liquid chromatography–tandem mass spectrometry[J]. Analytica Chimica Acta, 2007, 586: 217-222.
[5] Yang Y, Shao B, Zhang J, et al. Determination of the residues of 50 anabolic hormones in muscle, milk and liver by very-high-pressure liquid chromatography– electrospray ionization tandem mass spectrometry[J]. Journal of Chromatography B, 2009, 877: 489-496.
[6] Fent K. Progestins as endocrine disrupters in aquatic ecosystems: Concentrations, effects and risk assessment[J]. Environment International, 2015, 84: 115-130.
[7] Al-Odaini N A, Zakaria M P, Yaziz M I, et al. Multi-residue analytical method for human pharmaceuticals and synthetic hormones in river water and sewage effluents by solid-phase extraction and liquid chromatography-tandem mass spectrometry[J]. Journal of Chromatography A, 2010, 1217: 6791-6806.
[8] Fernandez M P, Ikonomou M G, Buchanan I. An assessment of estrogenic organic contaminants in Canadian wastewaters[J]. Science of The Total Environment, 2007, 373: 250-269.
[9] Liu S S, Ying G G, Liu S, et al. Analysis of 21 progestagens in various matrices by ultra-high-perfor- mance liquid chromatography tandem mass spectrometry (UHPLC-MS/MS) with diverse sample pretreatment[J]. Analytical and Bioanalytical Chemistry, 2014, 406: 7299-7311.
[10] Kolpin D W, Furlong E T, Meyer M T, et al. Pharmaceuticals, hormones, and other organic wastewater contaminants in US streams, 1999–2000: A national reconnaissance[J]. Environmental Science & Technology, 2002, 36: 1202-1211.
[11] Paulos P, Runnalls T J, Nallani G, et al. Reproductive responses in fathead minnow and Japanese medaka following exposure to a synthetic progestin, norethindrone[J]. Aquatic Toxicology, 2010, 99: 256-262.
[12] Hou L P, Chen S D, Chen H X, et al. Rapid masculinization and effects on the liver of female western mosquitofish () by norethindrone[J]. Chemosphere, 2019, 216: 94-102.
[13] Hou L P, Chen H X, Tian C E, et al. The progestin norethindrone affects sex differentiation and alters transcriptional profiles of genes along the hypothalamic-pituitary-gonadal and hypothalamic-pitui- tary-adrenal axes in juvenile zebrafish[J]. Aquatic Toxicology, 2018, 201: 31-39.
[14] Overturf M D, Overturf C L, Baxter D, et al. Early life-stage toxicity of eight pharmaceuticals to the fathead minnow,[J]. Archives of Environmental Contamination and Toxicology, 2011, 62: 455-464.
[15] Liang Y Q, Jing Z X, PAN C G, et al. The progestin norethindrone alters growth, reproductive histology and gene expression in zebrafish ()[J]. Chemosphere, 2020, 242: 125285.
[16] 张莲香. 克林霉素磷酸酯与醋酸甲羟孕酮联用对患者产后子宫内膜炎的疗效及其对炎症因子水平的影响[J]. 抗感染药学, 2018, 15(71): 159-161.
[17] 宋俏俏. 孕酮对大肠杆菌感染的山羊子宫内膜炎症反应研究[D]. 扬州: 扬州大学, 2019.
[18] 张磊, 李艳欣, 沈鹏, 等. 孕酮与雌激素对犬子宫组织炎症发生的作用机制研究[J]. 黑龙江畜牧兽医(上半月), 2017 (8): 29-34; 286.
[19] 涂永锋, 宋代军. 鱼类肠道组织结构及其功能适应性[J]. 江西饲料, 2004 (4): 16-19.
[20] 俞云鹏. 湛江近海沉积物PCBs对斑马鱼肠组织结构、微生物和细胞因子的影响[D].湛江: 广东海洋大学, 2018.
[21] 张乐. 3种拟除虫菊酯杀虫剂诱导稀有鮈鲫免疫毒性研究[D]. 武汉: 华中农业大学, 2019.
[22] 张智慧. 模型动物斑马鱼对鳗弧菌减毒活疫苗的免疫应答[D]. 上海: 华东理工大学, 2013.
[23] Samuel C E. Antiviral actions of interferons[J]. Clinical Microbiology Reviews, 2001, 14(4): 778-809.
[24] 宋亚娇, 胡秀彩, 吕爱军, 等. 弹状病毒感染诱导斑马鱼免疫应答的分子机制[J]. 中国科学: 生命科学, 2018, 48(7): 745-759.
[25] Dinarello C A. Interleukin-1[J]. Cytokine & Growth Factor Reviews, 1997, 8(4): 253-265.
[26] Goetz F. Tumor necrosis factors[J]. Developmental & Comparative Immunology, 2004, 28(5): 487-497.
[27] Chen L G, Hu C Y, Lok-Shun Lai N , et al. Acute exposure to PBDEs at an environmentally realistic concentration causes abrupt changes in the gut microbiota and host health of zebrafish[J]. Environmental Pollution, 2018, 240: 17-26.
[28] Jin Y X, Xia J Z, Pan Z H, et al. Polystyrene microplastics induce microbiota dysbiosis and inflammation in the gut of adult zebrafish[J]. Environmental Pollution, 2018, 235: 322-329.
Effects of Northindrone on Immunoregulatory Factors of Intestine in Zebrafish ()
LIANG Yan-qiu1, SITU Yan-jie1, DONG Zhong-dian2, XU Wen-qiang1, LIANG Xing-yi1, JING Zhan-xin1
(1.,,524088,; 2.,524088,)
To assess the adverse effects of the progestin northindrone on immunoregulatory factors of the intestine in zebrafish ().Adult zebrafish were exposed to 0, 7, 84 and 810 ng/L northindrone for 90 d, and the effects of northindrone on the contents of nuclear factor κB (NF-κB), as well as cytokines containing interferon α (IFN-α), interleukin 1α (IL-1α), interleukin 1β (IL-1β), and tumor necrosis factor α (TNF-α) were investigated in the intestine of females and males.Northindrone significantly increased the levels of IFN-α, IL-1α and TNF-α in the intestine of females, as well as NF-κB, IFN-α, IL-1α, IL-1β and TNF-α in the intestine of males.Northindrone could activate the NF-κB signaling pathway and promote the secretion of cytokines in the intestine of zebrafish, consequently induce inflammation response in the intestine.
; intestinal immunity; norethindrone; progestin; interruption; cytokines;nuclear factor-kappa B
X174;X503.225
A
1673-9159(2020)03-0001-06
10.3969/j.issn.1673-9159.2020.03.001
2020-01-13
广东省自然科学基金项目(2017A030310662);国家自然科学基金项目(41907346);广东海洋大学科研启动费资助项目(R17075);广东海洋大学2019年度大学生创新训练项目(CXXL2019304)
梁燕秋(1989—),女,博士,讲师,主要从事环境化学与生态毒理学研究。E-mail: liangyanqiu11@126.com
董忠典(1987—),男,博士,讲师,主要从事水产动物健康养殖及分子生物学研究。E-mail: dzhd888@163.com
景占鑫(1986—),男,博士,讲师,主要从事海洋化学方向的研究。E-mail:393345494@qq.com
梁燕秋,司徒艳结,董忠典,等. 炔诺酮对斑马鱼肠道免疫调节因子的干扰效应[J]. 广东海洋大学学报,2020,40(3):1-6.
(责任编辑:刘庆颖)
