NaCl胁迫对胡麻种子萌发、幼苗生长及Na+/H+逆向转运蛋白基因表达的影响
2020-08-31赵东晓董亚茹孙景诗耿兵王照红郭洪恩王向誉
赵东晓,董亚茹,孙景诗,耿兵,王照红,郭洪恩,王向誉
(山东省蚕业研究所,山东 烟台 264002)
胡麻(Linum usitatissimumL.)是亚麻科(Lianceace)亚麻属(Linum)油用亚麻的俗称,相较其他作物,具有较强的抗旱、抗寒、抗贫瘠能力[1]。胡麻种子含油量高,仅次于花生,是我国重要的油料作物。胡麻油富含人体必需的α-亚麻酸和亚油酸等不饱和脂肪酸,因此被誉为“陆地上的深海鱼油”,是一种优质的保健食用油,具有抗心脑血管疾病等保健功能[2]。此外,胡麻籽还含有丰富的木酚素、亚麻胶、果胶、膳食性纤维和优质蛋白等多种营养成分,近年来在食品、化妆品、工业、医药和保健品领域被广泛应用[3]。胡麻在我国主要分布于西北和华北等省份,是种植地区重要的经济作物之一[4]。我国胡麻主产区一直在遭受不同程度的土壤盐渍化危害,随着我国盐渍化土壤面积的不断扩张,土壤盐渍化已成为当前我国胡麻生产面临的主要非生物胁迫之一,严重制约了胡麻产业的可持续发展[5]。因此,研究不同程度盐胁迫对胡麻生长的影响对当前胡麻育种和生产具有重要意义。
种子萌发阶段是植物生活史的起始阶段,种子萌发和幼苗生长时期是植物最脆弱的阶段,也是对胁迫环境最为敏感的时期[6]。种子能够发芽并且生长,是决定植物能够生存繁育的重要因素[7]。盐渍化土壤主要通过过高的Na+对植物造成渗透胁迫和离子毒害。植物为了有效抵御盐胁迫,进化出一种Na+/H+逆向转运蛋白(Na+/H+antiporter protein,NHX),其位于细胞质膜和液泡膜上,可以将Na+从细胞质内转运到细胞或液泡外或将Na+区域化,以此维持细胞内Na+浓度、稳定细胞的渗透势。研究表明,NHX参与了诸多生理生化过程,如细胞增殖、调控细胞内pH值平衡、盐应激反应、离子运输和生长发育等,是与植物耐盐性相关的关键因子[8-13]。以往已有不少纤维用亚麻在盐胁迫下萌发和幼苗生理响应的研究[14-16],但针对不同浓度盐胁迫对胡麻影响的研究还鲜有报道。本研究用一定浓度的NaCl溶液对胡麻种子进行胁迫处理,调查发芽指标和幼苗生长情况,并用荧光定量PCR法检测了不同组织中NHX的表达情况,以期为胡麻的盐碱地栽培提供理论参考。
1 材料与方法
1.1 材料
供试胡麻品种为定亚17号,由中国农业科学院麻类研究所提供。
1.2 试验方法
1.2.1 种子萌发与胁迫处理 挑选颗粒饱满的胡麻种子置于75%乙醇中消毒20 min后,用无菌蒸馏水冲洗3~5次,晾干表面水分,均匀放置于铺有3层无菌滤纸的直径为9 cm的培养皿中,每个培养皿40粒种子。并加入10 mL浓度分别为0(CK)、50、100、150、200 mmol/L的已灭菌NaCl溶液(1/2Hoagland营养液配置),封口膜封口后,置于光照培养箱中。培养条件为25℃,光周期为光照12 h/d。每处理设3个重复。
1.2.2 发芽指标和幼苗生长指标的测定 以胚根突破种皮2 mm作为发芽标准。播种次日起每天9时统计发芽种子数,连续统计7 d。在第8 d,每个培养皿随机挑选5株幼苗,用游标卡尺测量幼苗株高和主根长;用万分之一天平称量地上部分和根鲜重;然后置于50℃烘箱中烘干至恒重,用万分之一天平称重。
按照如下公式计算各项指标:
发芽势(%)=第3 d时发芽种子数/供试种子数×100 ;
发芽率(%)=第7 d时发芽种子数/供试种子数×100 ;
发芽指数=∑(Gt/Dt),式中Gt为发芽种子数,Dt为对应的发芽天数 ;
活力指数=发芽指数×株高 。
1.3 NHX基因表达量的检测
由于200 mmol/L NaCl胁迫下胡麻幼苗生长受到严重抑制,无法长出子叶,因此本研究利用荧光定量PCR法检测了0、50、100、150 mmol/L NaCl胁迫下萌发第8 d胡麻幼苗叶片和根中NHX基因的相对表达情况。各处理组随机挑选10株幼苗用无菌去离子水冲洗3次后控干表面水分,用TaKaRa MiniBEST Plant RNA Extraction Kit(TaKaRa公司)提取各组样品的总RNA,用PrimeScriptTM1st Strand cDNA Synthesis Kit(TaKa-Ra公司)进行反转录合成cDNA第1条链。选用文献报道的亚麻NHX基因[17]及亚麻β-Actin内参基因[18]的引物,引物序列见表1,由上海生工生物工程有限公司合成。利用CFX96 Real-Time Detection System进行PCR扩增,设置反应体系为20μL,其中cDNA模板2μL,2×TB Green Premix Ex Taq 10μL,10μmol/L上、下游引物各0.5μL,ddH2O 7μL。扩增程序:95℃预变性30 s;95℃5 s,60℃30 s,40个循环。根据测得的Ct值,采用2-ΔΔCt方法[19]计算目的基因NHX的相对表达量。每个样品做3次重复。
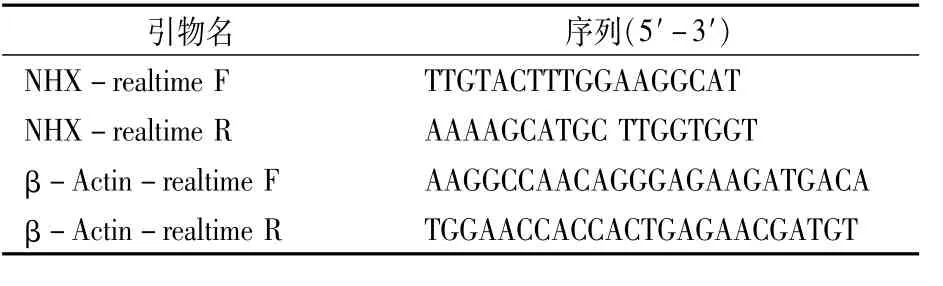
表1 引物及引物序列
1.4 数据统计与处理
采用Microsoft Excel 2007对试验数据进行处理,用SPSS 20.0对数据进行统计分析,不同小写字母表示数据在P<0.05水平下差异显著。
2 结果与分析
2.1 不同浓度NaCl对胡麻种子发芽势的影响
随着NaCl浓度升高,胡麻种子发芽势呈现逐渐下降的趋势。各浓度NaCl胁迫下发芽势与对照差异显著。100 mmol/L以下NaCl胁迫的胡麻种子发芽势仍在85%以上,但当NaCl浓度达到150 mmol/L后发芽势大幅度下降,150、200 mmol/L NaCl胁迫下胡麻种子的发芽势分别比对照下降了89.37%和98.48%(图1)。
2.2 不同浓度NaCl对胡麻种子发芽率的影响
胡麻种子发芽率与NaCl浓度呈负相关关系,即NaCl浓度越高,发芽率越低(图2)。NaCl胁迫浓度超过50 mmol/L后胡麻种子发芽率显著下降,但150 mmol/L NaCl胁迫下发芽率仍能达到85%以上,说明胡麻种子有较强的耐盐能力。
2.3 不同浓度NaCl对胡麻种子发芽指数的影响
胡麻种子发芽指数随NaCl浓度增加逐渐降低,各浓度间均达到显著差异。50~200 mmol/L NaCl胁迫下胡麻种子发芽指数分别为78.05、66.10、48.33和10.68,与对照相比,分别下降了16.30%、29.12%、48.17%和88.55%(图3)。
2.4 不同浓度NaCl对胡麻种子活力指数的影响
NaCl浓度越高,胡麻种子活力指数越低。50 mmol/L NaCl处理的活力指数与对照差异不显著,之后显著降低,与对照相比,100~200 mmol/L NaCl胁迫下胡麻种子活力指数分别下降了53.38%、78.33%和97.71%(图4)。
2.5 不同浓度NaCl对胡麻幼苗生长的影响
50 mmol/L NaCl处理增加了胡麻幼苗的株高和根长,且根长显著高于其他处理。100~200 mmol/L NaCl胁迫显著降低了胡麻幼苗的株高和根长,且浓度越高,降幅越大,与对照相比,株高分别降低了33.80%、58.24%和79.30%,根长分别降低了26.64%、53.43%和77.57%(图5A)。
50 mmol/L NaCl胁迫时,胡麻幼苗地上部和根部鲜、干重均增加,其中地上部鲜重和干重显著高于其他处理,根部鲜重和干重与对照差异不显著,但显著高于其它浓度NaCl处理。NaCl浓度达到100 mmol/L时地上部和根部干重和鲜重均显著降低,且随NaCl浓度升高,地上部和根部的鲜、干重均逐渐降低,且处理间差异达显著水平(图5 B、C)。
2.6 不同浓度NaCl对胡麻幼苗叶片和根中NHX表达量的影响
由图6可知,胡麻幼苗叶片和根中NHX基因的相对表达量与NaCl浓度正相关。50、100、150 mmol/L NaCl胁迫下胡麻幼苗叶片和根中NHX基因的相对表达量均显著高于CK,其中,叶中的相对表达量分别是CK的3.48、6.41、7.53倍,根中的相对表达量分别是CK的5.82、12.76、19.67倍。
3 讨论与结论
种子能否迅速、整齐地萌发,幼苗能否健壮地长成,是植物在逆境中能否定植成苗的关键,并直接影响植物后期的生长发育和产量[20]。发芽率、发芽势、发芽指数、活力指数分别反映种子的发芽能力、速度、整齐度和活力,是综合评价种子发芽能力的重要指标[21]。盐胁迫下种子的发芽能力与植物的抗盐能力呈正相关关系,因此可在一定程度上反映植物的抗盐性[22]。本研究结果表明,胡麻种子的发芽率、芽势、发芽指数和活力指数与盐胁迫程度负相关,但受盐胁迫影响的程度不同。NaCl胁迫浓度在150 mmol/L时发芽率仍高于85%,而当浓度达到200 mmol/L时发芽率大幅下降至33.75%,表明胡麻种子在一定浓度盐胁迫下仍有较强的发芽能力。发芽势在NaCl胁迫浓度低于100 mmol/L时高于85%,150 mmol/L时急剧下降至10.50%,说明胡麻种子在100 mmol/L NaCl胁迫下仍然保持了较高的发芽速度,但NaCl浓度继续升高发芽速度则急剧降低。发芽指数和活力指数在100 mmol/L NaCl胁迫下大幅下降,说明100 mmol/L NaCl胁迫严重影响了胡麻种子发芽的整齐度和活力。综合分析各项发芽指标可见,胡麻种子具有较强的抗盐性,在100 mmol/L NaCl胁迫下发芽能力和速度仍能保持较高的水平,但会影响发芽的整齐度和种子活力。这与郭媛等[14]的研究结果一致。
由于生长的固着性,在遭受逆境胁迫时,植物会在植株形态和生长方面产生相应的变化以适应逆境[23]。本研究中,50 mmol/L NaCl胁迫下胡麻幼苗的株高、根长及地上部和根部鲜、干重均高于对照组,说明适宜的低浓度NaCl可刺激胡麻幼苗的生长。这与于晓丹[24]、赵玮[25]、孙海博[26]等的研究结果类似,分析原因可能是一方面一定浓度范围的盐离子可刺激呼吸酶的活性,另一方面,低浓度盐胁迫可能会提升幼苗细胞膜的渗透调节作用[27]。当NaCl胁迫达到200 mmol/L时,由于严重的渗透胁迫和离子毒害,胡麻幼苗的生长受到严重抑制,并最终难以成苗。
许多研究表明,植物NHX基因有组成型表达和诱导型表达两种形式[28]。拟南芥、大豆、水稻、玉米、茶树、桑树的部分NHX基因家族成员属于组成型表达[29-31]。本研究结果显示,NaCl胁迫下胡麻NHX基因在叶片和根中的相对表达量均显著增加,表明在NaCl胁迫下,胡麻幼苗叶片和根中的NHX基因表达均受到显著诱导,且NaCl胁迫浓度越高,受诱导的程度越大,这与茶树[30]、桑树[31]、冰叶日中花[32]、互花米草[13]等植物的研究结果一致。胡麻幼苗根部NHX基因受诱导上调的幅度较叶片更大,可能是由于胡麻幼苗根部最先受到NaCl胁迫,这与苜蓿MtNHX6基因[33]的表达模式一致。
综上所述,胡麻种子在萌发和幼苗生长时期具有一定的耐盐性。100 mmol/L NaCl胁迫会影响胡麻种子发芽的整齐度和活力;200 mmol/L NaCl胁迫下种子仍可萌发,但难以成苗;50 mmol/L NaCl可促进胡麻幼苗的生长。NaCl胁迫使胡麻NHX基因表达量显著上调,根中NHX基因上调程度高于叶片。本研究对胡麻在土壤盐渍区育种和栽培具有现实的理论指导意义。本研究仅针对胡麻萌发期和幼苗期对一定浓度NaCl胁迫的响应设计试验,长期盐胁迫对胡麻整个生育期的影响以及NHX基因在不同时间点的表达情况仍需要进一步探究。
