左西孟旦治疗脓毒症心肌抑制的疗效及对心功能的影响
2020-08-29刘红娟耿静何志红郎哲孟文格胡晓宁
刘红娟 耿静 何志红 郎哲 孟文格 胡晓宁
脓毒症是因感染诱发的全身性炎症应激反应导致宿主体内稳态紊乱、并发多器官功能障碍的一种疾病。 脓毒症可发展为重症脓毒症、脓毒性休克而引起多器官功能障碍和衰竭[1-2]。脓毒性休克发生后的6 h 内约有20%患者出现左心室功能障碍[3],1 ~3 d 内左心室功能障碍的发生率可升高至约60%[4]。左西孟旦(LEV)具有增强心肌收缩能力的作用,我们为了评估其治疗脓毒症心肌抑制的疗效开展本次研究,现报道如下。
对象与方法
1.对象:2017 年1 月 ~2019 年 12 月我院收治的脓毒症心肌抑制患者,从96 例接受LEV 治疗的患者中随机选取60 例作为LEV 组,从98 例接受多巴酚丁胺(Dob)治疗的患者中随机选取60 例作为Dob 组,诊断标准参照《国际严重脓毒症及脓毒性休克诊疗指南》[5]。 纳入标准:(1)左心室射血分数(LVEF)液体复苏前>45%,复苏后≤45%;(2)心电图、心肌肌钙蛋白I(cTnI)均异常。 排除标准:(1)合并冠心病、慢性心力衰竭及其他心脏疾病如先天性心脏疾病,心肌病;(2)合并急性肺栓塞;(3)有心肺复苏史;(4)合并严重肝、肾功能不全;(5)对本研究用药过敏。 其中 LEV 组男 39 例,女 21 例,年龄 46 ~ 78 岁,平均年龄(63.06 ±7.03)岁,序贯器官衰竭(SOFA)评分16 ~20 分,平均SOFA 评分(19.01 ±1.69)分,原发疾病中肢体感染坏死5 例,胰腺炎 13 例,腹膜炎 10 例,肺炎 32 例;Dob 组男 39 例,女21 例,年龄 45 ~76 岁,平均年龄(62.15 ± 6.98)岁,SOFA 评分16 ~20 分,平均 SOFA 评分(18.71 ±1.62)分,原发疾病中肢体感染坏死6 例,胰腺炎14 例,腹膜炎9 例,肺炎31 例。 两组患者性别、年龄、SOFA 评分及原发疾病比较差异均无统计学意义(P>0.05)。 本研究经我院伦理委员会审核批准,所有患者或家属均知情同意。
2.方法
(1)治疗方法:两组患者均给予常规治疗,包括早期液体复苏、给氧辅助通气、抗感染、免疫调节、应用去甲肾上腺素维持血压、镇静、镇痛及对症治疗等。 LEV 组患者在此基础上给予LEV,初始剂量为6 ~12 μg/kg(视患者血压而定),静脉注射时间10 min 以上,负荷剂量为 0.1 μg·kg-1·min-1 持续静脉泵注。 Dob 组患者在常规治疗基础上给予Dob 5 μg·kg-1·min-1持续静脉泵注。 两组患者静脉泵注均维持24 h,用药后监测患者血压、心率等生命体征,据此调节药物泵入速度和剂量,7 d后可重复治疗,剂量视患者病情增减。
(2)观察指标:治疗7 d 时,采用急性生理与慢性健康评估(APACHEⅡ)评分评估两组患者的临床疗效,APACHEⅡ评分越高表示患者病情越危重,死亡风险越高。 观察治疗前和治疗7 d 时两组患者心功能指标[包括左心室收缩期末容积指数(LEVSI)、左心室舒张期末容积指数(LEVDI)、LVEF]、血清心肌抑制因子[包括内皮素(ET)-1、白三烯(LT)、高迁移率族蛋白B(HMBG)-1]、心肌损伤指标[包括cTnI、氨基末端脑钠肽前体(NT-proBNP)、降钙素原(PCT)]及血乳酸(LAC)水平的变化。 于入住ICU 后28 d 时统计两组患者的临床转归情况和ICU 入住时间。
3.统计学处理:应用SPSS 20.0 软件进行统计分析。 计量资料以表示,两组间比较采用独立样本t检验,同组治疗前后比较采用配对t检验;计数资料以例数表示,两组间比较采用 χ2检验。 以P<0.05 为差异有统计学意义。
结 果
1.两组患者治疗前后心功能指标比较:治疗前两组患者心功能各项指标比较差异均无统计学意义(P>0.05);治疗后两组患者LEVSI 和LEVDI 均低于同组治疗前,LVEF 均高于同组治疗前,且 LEV 组患者 LEVSI 和 LEVDI 均低于 Dob 组,LVEF高于 Dob 组(P<0.05)。 见表 1。
表1 两组患者治疗前后心功能指标比较()

表1 两组患者治疗前后心功能指标比较()
注:与同组治疗前比较,aP <0.05;与对照组治疗后比较,bP <0.05
组别 例数 LEVSI(ml/m2) LEVDI(ml/m2) LEVF(%)Dob 组 治疗前 60 50.56 ±6.49 76.72 ±6.91 36.05 ±4.65治疗后 60 43.99 ±6.53a 67.60 ±4.98a 41.85 ±4.52a LEV 组 治疗前 60 51.18 ±7.33 77.50 ±7.45 35.16 ±4.59治疗后 60 31.42 ±5.64ab 58.42 ±5.60ab 47.65 ±5.00ab
2.两组患者治疗前后血清心肌抑制因子水平比较:治疗前两组患者血清各项心肌抑制因子水平比较差异均无统计学意义(P>0.05);治疗后两组患者血清 ET-1、LT、HMBG-1 水平均低于同组治疗前,且 LEV 组均低于 Dob 组(P<0.05)。 见表2。
3.两组患者治疗前后血清心肌损伤指标及LAC 水平比较:治疗前两组患者血清cTnI、PCT、NT-proBNP 及LAC 水平比较差异均无统计学意义(P>0. 05);治疗后两组患者血清 cTnI、PCT、NT-proBNP 及 LAC 水平均低于同组治疗前,且 LEV 组均低于 Dob 组(P<0.05)。 见表 3。
表2 两组患者治疗前后血清心肌抑制因子水平比较()

表2 两组患者治疗前后血清心肌抑制因子水平比较()
注:与同组治疗前比较,aP <0.05;与对照组治疗后比较,bP <0.05
组别 例数 ET-1(pg/ml) LT(pg/ml) HMBG-1(μg/L)Dob 组 治疗前 60 70.49 ±8.98 27.93 ±8.38 15.31 ±2.04治疗后 60 56.68 ±9.05a 22.23 ±5.47a 12.23 ±1.69a LEV 组 治疗前 60 71.48 ±12.87 28.36 ±9.03 16.19 ±2.54治疗后 60 38.85 ±6.47ab 10.79 ±4.01ab 8.34 ±1.35ab
表3 两组患者治疗前后血清心肌损伤指标及LAC 水平比较()
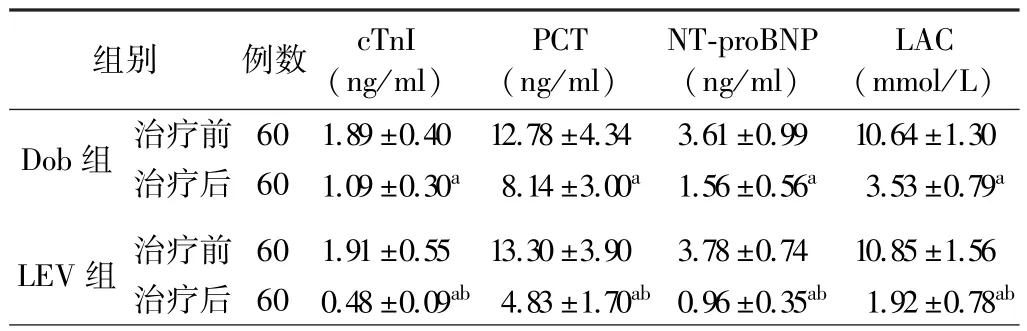
表3 两组患者治疗前后血清心肌损伤指标及LAC 水平比较()
注:与同组治疗前比较,aP <0.05;与对照组治疗后比较,bP <0.05
组别 例数 cTnI(ng/ml)PCT(ng/ml)NT-proBNP(ng/ml)LAC(mmol/L)Dob 组 治疗前 60 1.89±0.40 12.78±4.34 3.61±0.99 10.64±1.30治疗后 60 1.09±0.30a 8.14±3.00a 1.56±0.56a 3.53±0.79a LEV 组 治疗前 60 1.91±0.55 13.30±3.90 3.78±0.74 10.85±1.56治疗后 60 0.48±0.09ab 4.83±1.70ab 0.96±0.35ab 1.92±0.78ab
4.两组患者治疗前后APACHEⅡ评分及入住ICU 时间、预后比较:Dob 组和LEV 组患者治疗前APACHEⅡ评分比较差异无统计学意义[(21.58 ±4.49)分比(22.24 ±4.67)分,P>0.05],治疗后两组患者APACHEⅡ评分均低于同组治疗前,且LEV 组低于 Dob 组[(15.16 ±3.79)分比(17.48 ±3.86)分,P<0.05]。LEV 组患者入住ICU 时间和入住ICU 28 d 内死亡率均低于Dob组[(15.27 ± 5.23)d 比(20.16 ± 6.78)d,23.33%(14/60) 比41.67%(25/60),P均 <0.05]。
讨 论
脓毒症以全身性炎症反应、代谢功能紊乱、组织细胞缺血缺氧等为主要表现,心肌抑制为其常见并发症。 目前,脓毒症诱发心肌抑制的机制多认为与全身炎症反应诱发的心肌细胞过度凋亡、细胞内钙稳态失衡、线粒体功能障碍、心肌抑制因子过度释放等因素相关[6]。 心肌抑制为脓毒症不良预后的预测指标,可导致患者死亡风险增加[7]。 脓毒症患者体循环中多种心肌抑制活性物质表达升高[8]。 ET-1 为血管收缩因子,其表达水平异常升高提示血管内皮功能损伤。 LT 可辅助肿瘤坏死因子(TNF)-α 等炎症因子发挥促进炎症反应作用,并与诱生型一氧化氮合酶产生协同作用,增加心肌负性肌力。 HMGB-1 由心肌细胞分泌,为内毒素发挥致死效应过程中的炎症介质之一,全程参与脓毒症的脏器功能损害并发挥促进作用,HMGB-1 在脓毒症发生时大量合成,其作为晚期炎症因子参与全身性炎症反应,血液中可见其过高表达,使心肌细胞受损,抑制心肌细胞功能,同时被损伤的心肌细胞亦可进一步大量释放HMGB-1,从而导致心肌进一步抑制,心功能进一步损伤。 NT-proBNP 是心肌损伤标志物之一。 脓毒症患者血清NT-proBNP 水平升高,其升高幅度与患者的死亡率呈正相关,因此,其不仅可反映脓毒症患者的心肌损伤程度,亦可作为脓毒症病情与预后评估的重要指标[9]。 PCT 是反映细菌感染的重要标志物之一,在脓毒症患者血清中呈高表达[10]。 cTnI 为心肌损伤的常用标志物,其水平与各种原因所致的心肌损伤程度呈正相关。
Dob 为临床上常用的正性肌力药物,为脓毒症的首选药物,但由于其可形成Ca2+持续内流效应使膜反应性降低,易诱发快速性心律失常等不良反应。 LEV 为Ca2+增敏类药物,具有强心与扩张血管作用,且无Ca2+内流效应的持续增强作用。 LEV 可结合肌钙蛋白,从而稳定心肌纤维蛋白的空间结构,加强心肌收缩力,且不升高细胞内Ca2+浓度,对于心肌耗氧量、心率的不良影响较小;LEV 通过发挥细胞膜超极化有效抑制Ca2+的细胞内流效应,同时可降低细胞内Ca2+浓度;能够在降低心脏前负荷的同时加强心肌收缩力,改善血供。 此外,LEV 大剂量应用时可发挥正性肌力效应。
本研究结果显示,治疗后两组患者APACHEⅡ评分均降低,且LEV 组低于Dob 组,提示LEV 治疗脓毒症心肌抑制的疗效更佳。 治疗后两组患者LEVSI 和LEVDI 均低于同组治疗前,LEVF 均高于同组治疗前,且LEV 组患者LEVSI 和LEVDI 均低于Dob 组,LEVF 高于Dob 组,提示LEV 在改善脓毒症心肌抑制患者心功能方面具有更显著的疗效与田兆兴等[11]的研究结果一致。 本研究中,治疗后两组患者血清 ET-1、LT、HMBG-1 水平均低于同组治疗前,且LEV 组均低于Dob 组,提示LEV 可更有效地降低脓毒症心肌抑制患者心肌抑制因子水平,从而发挥减轻心肌抑制的作用。 治疗后两组患者血清cTnI、PCT、NT-proBNP及LAC 水平均低于治疗前,且LEV 组患者均低于Dob 组,提示LEV 能更有效地减轻脓毒症心肌抑制患者的心肌损伤程度,并通过增强心功能、改善心肌血供等方式部分逆转心肌损伤。LEV 组患者入住ICU 时间和入住ICU 28 d 内死亡率均明显低于Dob 组,提示LEV 治疗脓毒症心肌抑制患者起效速度更快,并可有效降低死亡风险。
综上所述,LEV 治疗脓毒症心肌抑制能够更有效地改善患者心功能,增加心肌血供,从而实现部分逆转心肌损伤,降低死亡率,并具有起效速度更快的优势。
