支气管肺泡灌洗液中辅助性T 淋巴细胞17 和调节性T 淋巴细胞相关细胞因子与稳定期慢性阻塞性肺疾病患者临床表型的相关性
2020-08-29李霞荣庆娜江丽娟王欢
李霞 荣庆娜 江丽娟 王欢
慢性阻塞性肺疾病(COPD)是一种以渐进性气流受限为特征的慢性持续性气道炎症性疾病,在临床表现、影像学特征、病程发展、治疗反应等方面存在明显的个体差异性[1]。 因此,单纯依靠肺功能分级并不能完全反映患者的临床状态和异质性。2010 年 Han 等[2]提出“COPD 表型”的概念,依据一系列可观察且与临床预后相关的结构和功能特征对患者进行个体化治疗,包括影像学特征分型、病程时机分型、多维指标分型等。 但由于COPD 表型分类众多,且缺乏统一的分型标准,探讨与表型相关的生物学标志物具有重要临床意义。 辅助性T 淋巴细胞17(Th17)和调节性T 淋巴细胞(Treg)免疫失衡是COPD 的重要发病机制之一[3]。 我们通过比较不同病程时期、肺功能分级、影像学表型的稳定期COPD 患者支气管肺泡灌洗液(BALF)中Th17 及 Treg 相关细胞因子白细胞介素(IL)-17A、IL-6、IL-10、转化生长因子(TGF)-β1、干扰素(IFN)-γ 水平,旨在为协助诊断、指导个体化治疗和及判断预后提供参考。
对象与方法
1.对象:选取2018 年7 月 ~2019 年5 月于我科就诊的稳定期COPD 患者52 例作为稳定期COPD 组,同期于我院体检的健康者50 例作为对照组。 纳入标准:(1)COPD 患者符合《慢性阻塞性肺疾病诊治指南(2013 年修订版)》[4]关于COPD 的诊断和稳定期的分期标准;(2)对照组受试者年龄、性别与COPD患者相匹配。 排除标准:(1)存在纤维支气管镜检查禁忌证;(2)标本收集前1 个月有全身或呼吸道感染史;(3)合并活动性肺结核、支气管扩张、肺炎、肺癌、肺间质纤维化等非COPD 肺部疾病;(4)合并恶性肿瘤、免疫系统疾病、糖尿病、严重心脑血管疾病。 其中稳定期 COPD 组男 32 例,女 20 例,年龄 43 ~ 80 岁,平均年龄(62.73 ±12.76)岁,BMI(23.58 ±2.81)kg/m2,有吸烟史者 20 例;对照组男 25 例,女 25 例,年龄 40 ~80 岁,平均年龄(63.46 ± 13.18)岁,BMI(24. 12 ± 3. 10)kg/m2,有吸烟史者18 例。两组受试者年龄、性别、吸烟史较差异均无统计学意义(P>0.05)。依据《慢性阻塞性肺疾病诊治指南(2013年修订版)》,采用过去1 年COPD 急性加重次数作为风险评估标准,若<2 次或因急性加重住院<1 次则为低风险,若≥2 次或因急性加重住院≥1 次则为高风险;采用改良版英国医学研究委员会呼吸问卷(mMRC)分级作为症状评估标准,<2 级为症状轻,≥2 级为症状重。 根据风险分级和症状严重程度将52 例稳定期 COPD 患者分为 4 组:A 组:低风险,症状轻,23 例;B 组:低风险,症状重,14 例;C 组:高风险,症状轻,9 例;D 组:高风险,症状重,6 例。 依据胸部高分辨率电子计算机断层扫描(HRCT)结果,将52 例稳定期COPD 患者分为气管炎型19 例、肺气肿型17 例、混合型16 例。 根据慢性阻塞性肺疾病全球倡议(GOLD)分级将52 例稳定期 COPD 患者分为 GOLD 1 级12 例、GOLD 2 级 20 例、GOLD 3 级 14 例、GOLD 4 级 6 例。 本研究经我院伦理委员会审核批准,所有受试者均签署知情同意书。
2.方法
(1)肺功能检查:采用意大利科时迈PonyFX 型便携式肺功能测试仪检测稳定期COPD 患者的肺功能,包括第1 秒用力呼气容积(FEV1)、用力肺活量(FVC)及FEV1/FVC。 每次测试均重复≥3 次,选取图形最好的1 次作为最终结果。 根据FEV1占预测值的百分比(FEV1%pred)进行GOLD 分级,GOLD 1 级:FEV1%pred ≥80%;GOLD 2 级:FEV1% pred 为 50% ~ 79%;GOLD 3 级:FEV1%pred 为 30% ~ 49% ;GOLD 4 级:FEV1%pred<30%。
(2)BALF 中Th17 和Treg 相关细胞因子水平检测:经纤维支气管镜采集两组受试者肺段或肺亚段BALF,自活检孔快速灌注20ml 生理盐水,并立即负压吸回灌洗液,重复5 ~6 次,总灌洗液量达100 ~120 ml,以1 500 r/min 离心10 min,取上清液,保存于-20 ℃冰箱中备用。 取血清复溶后,将待测样本加入反应板中,再加入 IL-17A、IL-6、IL-10、TGF-β1、IFN-γ 抗体,反应1 h 后终止,采用酶标仪检测450 nm 吸收波长处的吸光度值。
3.统计学处理:应用SPSS 17.0 软件进行统计分析。 计量资料以表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,两两比较采用LSD-t检验;计数资料以例数表示,组间比较采用χ2检验。 以P<0.05 为差异有统计学意义。
表1 稳定期COPD 组和对照组受试者BALF 中Th17 和Treg 相关细胞因子水平比较()
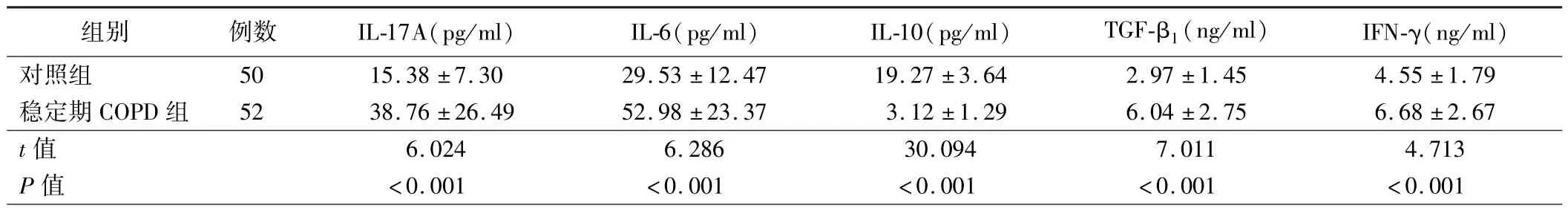
表1 稳定期COPD 组和对照组受试者BALF 中Th17 和Treg 相关细胞因子水平比较()
组别 例数 IL-17A(pg/ml) IL-6(pg/ml) IL-10(pg/ml) TGF-β1(ng/ml) IFN-γ(ng/ml)对照组 50 15.38 ±7.30 29.53 ±12.47 19.27 ±3.64 2.97 ±1.45 4.55 ±1.79稳定期 COPD 组 52 38.76 ±26.49 52.98 ±23.37 3.12 ±1.29 6.04 ±2.75 6.68 ±2.67 t 值 6.024 6.286 30.094 7.011 4.713 P 值 <0.001 <0.001 <0.001 <0.001 <0.001
表2 A、B、C、D 组稳定期COPD 患者BALF 中Th17 和Treg 相关细胞因子水平比较()
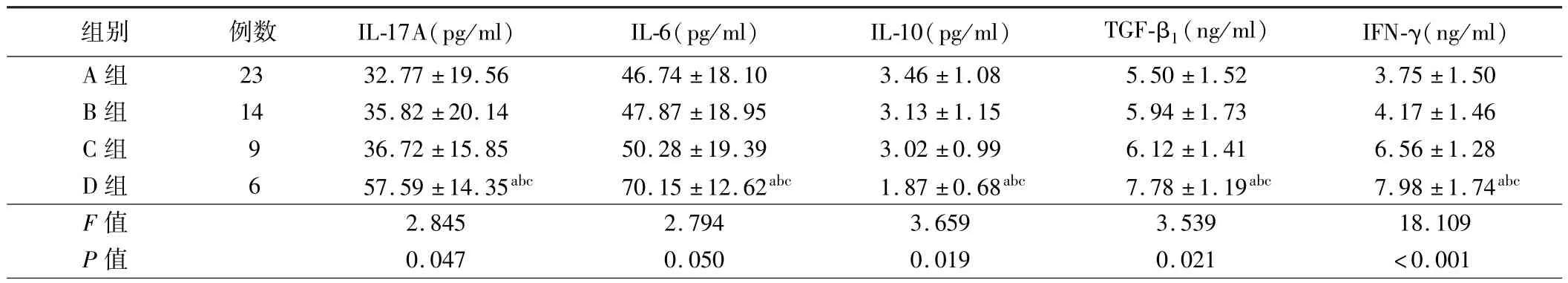
表2 A、B、C、D 组稳定期COPD 患者BALF 中Th17 和Treg 相关细胞因子水平比较()
注:与 A 组比较,aP <0.05;与 B 组比较,bP <0.05;与 C 组比较,cP <0.05
组别 例数 IL-17A(pg/ml) IL-6(pg/ml) IL-10(pg/ml) TGF-β1(ng/ml) IFN-γ(ng/ml)A 组 23 32.77 ± 19.56 46.74 ± 18.10 3.46 ± 1.08 5.50 ± 1.52 3.75 ± 1.50 B 组 14 35.82 ± 20.14 47.87 ± 18.95 3.13 ± 1.15 5.94 ± 1.73 4.17 ± 1.46 C 组 9 36.72 ± 15.85 50.28 ± 19.39 3.02 ± 0.99 6.12 ± 1.41 6.56 ± 1.28 D 组 6 57.59 ± 14.35abc 70.15 ± 12.62abc 1.87 ± 0.68abc 7.78 ± 1.19abc 7.98 ± 1.74abc F 值 2.845 2.794 3.659 3.539 18.109 P 值 0.047 0.050 0.019 0.021 <0.001
表3 不同胸部HRCT 分型稳定期COPD 患者BALF 中Th17 和Treg 相关细胞因子水平比较()
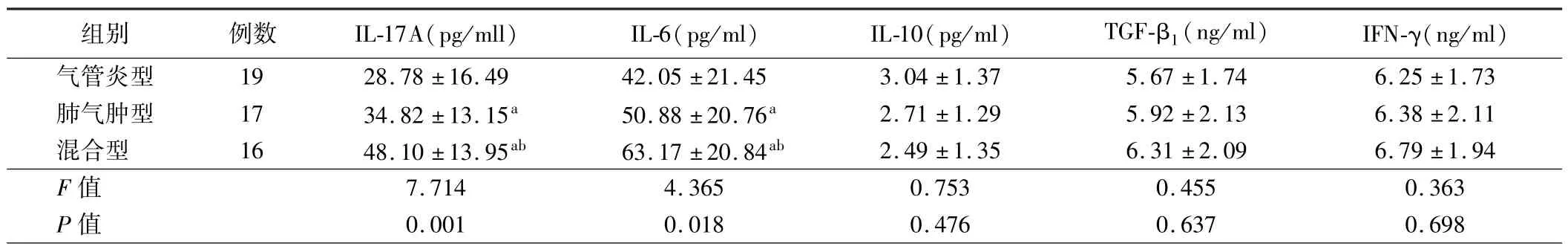
表3 不同胸部HRCT 分型稳定期COPD 患者BALF 中Th17 和Treg 相关细胞因子水平比较()
注:与气管炎型比较,aP <0.05;与肺气肿型比较,bP <0.05
组别 例数 IL-17A(pg/mll) IL-6(pg/ml) IL-10(pg/ml) TGF-β1(ng/ml) IFN-γ(ng/ml)气管炎型 19 28.78 ±16.49 42.05 ±21.45 3.04 ±1.37 5.67 ±1.74 6.25 ±1.73肺气肿型 17 34.82 ±13.15a 50.88 ±20.76a 2.71 ±1.29 5.92 ±2.13 6.38 ±2.11混合型 16 48.10 ±13.95ab 63.17 ±20.84ab 2.49 ±1.35 6.31 ±2.09 6.79 ±1.94 F 值 7.714 4.365 0.753 0.455 0.363 P 值 0.001 0.018 0.476 0.637 0.698
表4 不同GOLD 分级稳定期COPD 患者BALF 中Th17 和Treg 相关细胞因子水平比较()
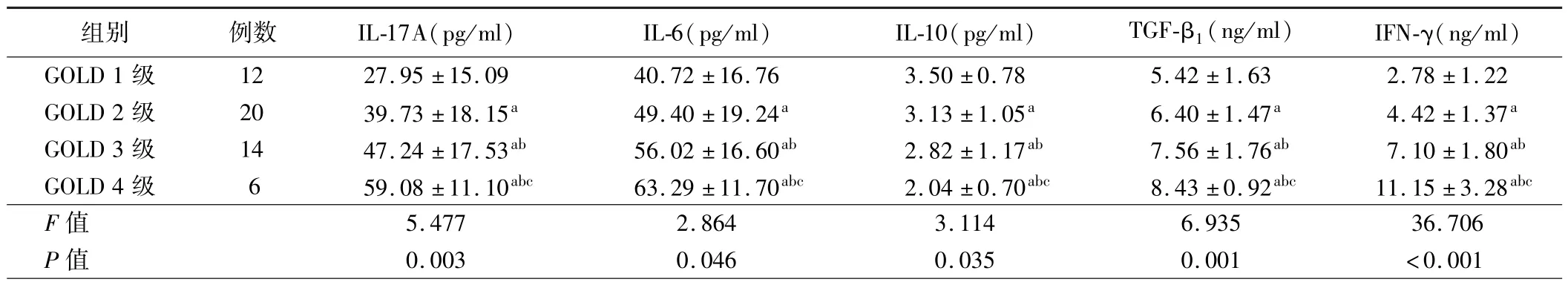
表4 不同GOLD 分级稳定期COPD 患者BALF 中Th17 和Treg 相关细胞因子水平比较()
注:与 GOLD 1 级比较,aP <0.05;与 GOLD 2 级比较,bP <0.05;与 GOLD 3 级比较,cP <0.05
组别 例数 IL-17A(pg/ml) IL-6(pg/ml) IL-10(pg/ml) TGF-β1(ng/ml) IFN-γ(ng/ml)GOLD 1 级 12 27.95 ± 15.09 40.72 ± 16.76 3.50 ± 0.78 5.42 ± 1.63 2.78 ± 1.22 GOLD 2 级 20 39.73 ± 18.15a 49.40 ± 19.24a 3.13 ± 1.05a 6.40 ± 1.47a 4.42 ± 1.37a GOLD 3 级 14 47.24 ± 17.53ab 56.02 ± 16.60ab 2.82 ± 1.17ab 7.56 ± 1.76ab 7.10 ± 1.80ab GOLD 4 级 6 59.08 ± 11.10abc 63.29 ± 11.70abc 2.04 ± 0.70abc 8.43 ± 0.92abc 11.15 ± 3.28abc F 值 5.477 2.864 3.114 6.935 36.706 P 值 0.003 0.046 0.035 0.001 <0.001
结 果
1.稳定期COPD 组和对照组受试者BALF 中 Th17 和Treg相关细胞因子水平比较:稳定期COPD 组患者BALF 中IL-17A、IL-6、TGF-β1、IFN-γ 水平均高于对照组,IL-10 水平低于对照组(P<0.05)。 见表 1。
2.A、B、C、D 组稳定期 COPD 患者 BALF 中 Th17 和 Treg 相关细胞因子水平比较:D 组稳定期COPD 患者BALF 中IL-17A、IL-6、TGF-β1、IFN-γ 水平均高于 A、B 及 C 组,IL-10 水平均低于A、B 和 C 组(P< 0.05)。 A、B、C 稳定期 COPD 患者 BALF 中IL-17A、IL-6、IL-10、TGF-β1及 IFN-γ 水平比较,差异均无统计学意义(P>0.05)。 见表 2。
3.不同胸部HRCT 分型稳定期 COPD 患者 BALF 中Th17和Treg 相关细胞因子水平比较:气管炎型、肺气肿型、混合型稳定期COPD 患者BALF 中IL-17A、IL-6 比较,差异有统计学意义(P<0.05),而 3 组患者 BALF 中 IL-10、TGF-β1、IFN-γ 水平比较,差异均无统计学意义(P>0.05)。 肺气肿型和混合型稳定期COPD 患者BALF 中IL-17A、IL-6 水平均高于气管炎型,混合型稳定期COPD 患者BALF 中IL-17A、IL-6 水平均高于肺气肿型(P<0.05)。 见表 3。
4. 不同 GOLD 分级稳定期 COPD 患者 BALF 中 Th17 和Treg 相关细胞因子水平比较:随着 GOLD 分级增高,稳定期COPD 患者 BALF 中 IL-17A、IL-6、TGF-β1、IFN-γ 水平逐渐升高,而IL-10 水平逐渐降低,各组间比较差异均有统计学意义(P<0.05)。见表 4。
讨 论
持续性气道炎症反应和气流受限是COPD 的两大基本特征,但不同患者的临床表现、病情进展、治疗效果等均存在一定个体差异性,单纯依靠肺功能检查结果作为临床治疗的依据并不完全可靠。 由于COPD 的发病机制尚未完全明确,目前尚未找到能够取代FEV1/FVC 成为疾病诊断、管理及预后评估更理想的指标。
从已知的发病机制角度出发,COPD 属于一类气道慢性炎症反应性疾病,而这种炎症反应主要由T 淋巴细胞介导,因此有学者提出了COPD“自身免疫应答”假说[5]。 Treg 和Th17 是由初始T 淋巴细胞分化的两大细胞亚群,二者相互遏制,共同维持机体内环境的免疫平衡。 2005 年Harrington 等[6]和Park等[7]同时发现Th17 细胞亚群的存在,证实IL-17、IL-6 是其分泌的特征分子。 IL-17 是一种前炎症细胞因子,主要由Th17 分泌,另外CD8+T 淋巴细胞、CD3+CD4-CD8-T 淋巴细胞等也可以少量分泌,其中临床和文献中检测的IL-17 多为IL-17A[8]。IL-17A广泛表达于呼吸道上皮细胞,通过诱导IL-6 的产生,加重炎症反应,并参与气道重构。 本研究结果显示,稳定期COPD组患者BALF 中IL-17A 和 IL-6 水平均高于对照组,推测Th17在COPD 发病过程中发挥着重要作用,与既往文献报道基本一致。 凌燕君[9]的研究证实 Th17 相关细胞因子 IL-23、IL-1β、IL-17A、IL-17F 均参与COPD 的发生和发展,且急性期各指标水平与BODE 指数和GOLD 分级呈正相关。 汪露等[10]的研究也发现,外周血Th17 水平及相关细胞因子IL-17、IL-6 与COPD 患者的肺功能指标有较好的相关性,在判断预后方面具有一定的参考价值。 本研究中,随着GOLD 分级增高,稳定期COPD 患者BALF 中 IL-17A、IL-6、TGF-β1、IFN-γ 水平逐渐升高,而 IL-10 水平逐渐降低,表明Th17 相关细胞因子水平在一定程度上反映了COPD 患者肺功能下降程度,考虑与IL-17A、IL-6 的促炎反应机制有关,二者通过分泌基质金属蛋白酶等促进血管内皮损伤,破坏支气管结构,加重肺功能恶化。
本研究中,肺气肿型和混合型稳定期COPD 患者BALF 中IL-17A、IL-6 水平均高于气管炎型,混合型稳定期 COPD 患者BALF 中IL-17A、IL-6 水平均高于肺气肿型。 肺气肿型、气管炎型、混合型是临床上COPD 最经典的影像学分型,肺气肿型患者主要表现为呼吸困难和运动耐量降低,且常伴过度通气体征。Casanova 等[11]通过收集5 年的随访数据发现,肺气肿型患者的肺功能和预后更差,且肺过度充气程度与生存率呈负相关。O’Donnell等[12]发现肺气肿型COPD 患者痰液中多数可分离出独立潜在的病原微生物,且较非肺气肿型患者合并症的发生率更高。 有研究结果显示,气道病理变化、肺气肿及气流受限是相互独立又彼此影响的3 个病理过程[13]。 与气管炎型比较,肺气肿型发病机制更复杂,慢性炎症、氧化应激、免疫失衡等均可能参与其中。 IL-17 是免疫反应和炎症反应的交汇点,具有促进炎症和趋化免疫细胞的作用,可募集并诱导肺组织内中性粒细胞的聚集、成熟和分化,从而进一步加重炎症反应,促进肺实质损伤,导致肺气肿的发生。 这也解释了本研究中肺气肿型和混合型稳定期COPD 患者BALF 中IL-17A、IL-6 水平均高于气管炎型的原因。
除了Th17 诱导的炎症反应外,Th17/Treg 免疫失衡也是COPD 发病的重要机制之一。 IL-10 属于Treg 分化相关细胞因子,可促使初始T 淋巴细胞向Treg 分化,同时Treg 又可分泌IL-10,进而抑制T 淋巴细胞介导的病理性免疫应答[14]。 而IL-6可抑制初始T 淋巴细胞向Treg 分化,甚至可促使已经分化的Treg 向 Th17 细胞转化。 Th17 可通过分泌 IL-17A、IL-6 等促炎因子参与COPD 的发病机制,并抑制Treg 分化,而Treg 可通过免疫抑制和炎症抑制作用降低有害物质对肺组织的损伤。TGF-β1由气道上皮细胞和巨噬细胞等合成并分泌,可促进炎症反应的发生。 本研究中,稳定期COPD 组患者BALF 中IL-10 低于对照组,TGF-β1和 IFN-γ 水平均高于对照组,而根据《慢性阻塞性肺疾病诊治指南(2013 年修订版)》分组的A、B、C 组稳定期 COPD 患者 BALF 中 TGF-β1、IFN-γ 水平比较差异均无统计学意义,且气管炎型、肺气肿型、混合型稳定期COPD 患者BALF 中 IL-10、TGF-β1、IFN-γ 水平比较差异均无统计学意义,提示Th17 和Trey 相关细胞因子可能并不能评估稳定期COPD患者的预后相关风险程度,且不能依据炎症反应程度鉴别肺气肿型、气管炎型、混合型稳定期COPD 患者。
综上所述,Th17 和Trey 相关因子与稳定期COPD 患者的预后相关风险程度的相关性不明显,但Th17 相关因子可能可作为肺气肿型稳定期COPD 患者的异质性标志物,为临床个体化治疗提供一定的理论依据。
