蛋白酪氨酸激酶2/信号传导与转录激活因子3 信号通路在大鼠肾脏移植慢性排斥反应中的作用机制
2020-08-29蒋欣曲青山房军梁韶峰孙东
蒋欣 曲青山 房军 梁韶峰 孙东
肾脏移植是肾病终末期最有效的治疗手段。 随着新型免疫抑制剂的不断出现及组织配型、器官保存技术的不断提高,移植肾1 年存活率已提高至90%以上,而远期存活率并无明显变化,10 年存活率不到50%[1-2]。移植肾慢性排斥反应是导致其远期功能丧失的主要原因,但目前临床上缺乏明确有效的防治方法[3]。 间质纤维化、肾小管萎缩和累积内膜的血管壁增厚等损伤主要是由移植肾的慢性排斥反应所致。 炎症是移植肾排斥反应至慢性移植物功能丧失的重要病理生理因素[4]。 蛋白酪氨酸激酶(JAK)是一类非跨膜型的酪氨酸激酶。 信号传导与转录激活因子(STAT)在信号转导和转录激活上有重要作用[5]。 有研究显示JAK 和STAT 在正常肾小管上皮细胞中表达水平较低,而在肾脏移植患者肾小管上皮细胞中表达水平相对较高[6]。JAK/STAT 通路对肾间质纤维化和肾小管上皮细胞的损伤具有一定调控作用,并对病理性活化有一定促进作用[7]。 本研究在JAK/STAT 通路调控肾小管上皮细胞损伤作用的基础上探讨JAK2/STAT3 通路在大鼠肾脏移植慢性排斥反应中的作用机制。
材料与方法
1.材料:8 ~12 周龄无特定病原体雄性近交系大鼠60 只购自郑州大学药物研究所[许可证号SCXK(豫)2018-0004],体质量 200 ~ 250 g。 AMD3100 拮抗剂购自Sigma-Aldrich 公司;α 平滑肌肌动蛋白(a-SMA)抗体、JAK2 抗体、转化生长因子(TGF)-β1抗体、果蝇母性DPP 同1 原蛋白3(Smad3)蛋白抗体均购自英国Cambridge 公司;BH2 显微镜购自日本OLYMPUS 公司。
2.方法
(1)实验分组方法:将60 只大鼠分为3 组,空白对照组[供鼠(10 只)、受鼠(10 只)均为 Lewis 大鼠]、阳性对照组[供鼠(10 只)为F344 大鼠,受鼠(10 只)为Lewis 大鼠 ]和STAT3 拮抗组[供鼠(10 只)为F344大鼠,受鼠(10 只)为 Lewis 大鼠]。 3 组大鼠均在手术当天至术后10 d 皮下注射低剂量环孢素A,剂量为1.5 mg·kg-1·d-1;STAT3 拮抗组大鼠注射环孢素A后给予AMD 3 100 mg·kg-1·d-1尾静脉注射。
(2)肾脏移植手术:3 组大鼠均在手术后12 周麻醉处死并取材。 参考文献[8]将所有大鼠麻醉后,供体大鼠固定剖开腹腔,分离其动、静脉,采用10/0 尼龙线将供体左肾动、静脉带瓣分别与受体腹主动脉和下腔静脉行端-侧吻合,采用7/0 尼龙线将供体输尿管末端的膀胱肌瓣与受体膀胱肌顶部吻合,取出供体左肾。受体大鼠的手术方法和供体大鼠一致,供体和受体大鼠肾脏移植手术同时进行,手术完毕后给予所有大鼠庆大霉素150 mg/kg 肌肉注射,预防感染。
(3)肾功能测定:分别抽取所有大鼠术前和术后12 周的尾静脉血2 ml,冻存于-80 ℃冰箱中,用于检测血肌酐(SCr)及尿素氮(BUN)水平。
(4)肾脏组织病理学检测:于术后第12 周处死大鼠,迅速将肾脏组织固定、脱水、石蜡包埋后切片,进行苏木素-伊红(HE)染色。 每个样本在400 倍镜下随机观测5 个视野进行评价。 采用慢性移植物损伤指数(CADI)评分标准对3 组大鼠肾脏样本进行慢性排斥反应病理评分。 该评分标准包括肾间质炎症、肾间质纤维化、肾小管萎缩、基底膜基质增多、肾小球硬化、动脉内膜增生6 个部分,每个部分分值为0 ~3 分,CADI评分即为六者总和。
(5)免疫组化检测 TGF-β1/Smad3 和 α- SMA 纤维化指标:取肾脏组织以3 %过氧化氢封闭内源性过氧化物酶后,放置柠檬缓冲液中,以98 ℃加热15 min,取出冷却至室温进行修复抗原。 滴加一抗于4 ℃孵育过夜,用磷酸盐缓冲液(PBS)漂洗5 min,共漂洗3 次。每张切片滴加50 μml 辣根过氧化物酶标记的链霉亲和素,37 ℃下孵育 30 min,PBS 冲洗 3 次。 每张切片滴加二氨基联苯胺(DAB)显色液,镜下观察控制显色反应,自来水洗终止,复染核后用中性树胶封片。
(6)蛋白质印记法(Western blot)检测 TGF-β1、α-SMA、JAK2 和 STAT3 蛋白的表达:从 -80 ℃冰箱取出3 组大鼠的肾脏组织加入裂解液和蛋白酶抑制剂充分匀浆,4 ℃以12 000 r/min 离心15 min 取上清液,每组取30 mg 蛋白电泳并电转至聚偏二氟乙烯(PVDF)膜上,室温10 %脱脂奶粉封闭1 h,加入一抗4 ℃下孵育过夜,加入二抗室温孵育1 h。 应用Odyssey 红外荧光扫描成像系统对膜上蛋白质进行检测并行定量分析。
3.统计学处理:应用SPSS 13.0 软件进行统计分析。 符合正态分布的计量资料以表示,组间比较采用t检验,多组间比较采用单因素方差分析;计数资料比例和百分比表示组间比较采用χ2检验,不同时间点比较采用重复测量方法分析。 以P<0.05 为差异有统计学意义。
结 果
1.3 组大鼠存活率及肾脏移植前后肾功能比较:术后12 周内空白对照组(12/16,75%)、阳性对照组(6/13,46%)及 STAT3 拮抗组(10/15,67%)大鼠存活率比较差异无统计学意义,术前3 组大鼠血清SCr 及BUN 水平比较差异均无统计学意义(P>0.05)。 术后12 周空白对照组和 STAT3 拮抗组大鼠血清 SCr 及BUN 水平均低于阳性对照组(P<0.05)。 见表1。
表1 3 组大鼠肾脏移植前后血清SCr 及BUN 水平比较()

表1 3 组大鼠肾脏移植前后血清SCr 及BUN 水平比较()
注:与空白对照组比较,aP <0.05;与阳性对照组比较,bP <0.05
组别 例数 SCr(μmol/L)手术前 术后12 周BUN(mmol/L)手术前 术后12 周空白对照组 16 127.28±15.62 153.87±17.04 6.19±0.11 7.95±0.26阳性对照组 13 133.25±15.83 186.25±18.31a 7.23±0.18 10.42±0.51a STAT3 拮抗组 15 129.45±15.76 159.42±17.28b 6.68±0.17 8.57±0.29b
2.3 组大鼠肾脏移植后的肾脏组织病理学变化和CADI 评分结果比较:肾脏移植12 周后,HE 染色结果发现空白对照组和STAT3 拮抗组大鼠肾脏组织肾小球硬化、肾小管萎缩扩张变形、炎症细胞浸润及间质纤维化等慢性排斥反应的病理表现较轻,阳性对照组大鼠肾脏组织弥漫性炎症细胞浸润的病理表现较为明显,见图1。 阳性对照组大鼠CADI 评分[(7.92±0.86)分]明显高于STAT3 拮抗组[(3.82 ±0.41)分]和空白对照组[(3.24±0.33)分],差异有统计学意义(P<0.05)。空白对照组和STAT3 拮抗组大鼠CADI 评分比较差异无统计学意义(P>0.05)。
3.3 组大鼠免疫组化检测结果比较:阳性对照组大鼠肾小管中可见大量TGF-β1及Smad3 阳性细胞,肾间质和肾小管中可见大量α-SMA 阳性细胞;而在空白对照组和 STAT3 拮抗组中 TGF-β1、Smad3 和 α-SMA阳性细胞明显减少。 见图2。
4.3 组大鼠肾脏组织中JAK2/STAT3 及纤维化指标表达水平比较:空白对照组和STAT3 拮抗组大鼠肾脏组织中 JAK2、STAT3、TGF-β1及 α-SMA 蛋白表达水平明显低于阳性对照组(P<0.05),上述蛋白水平表达在空白对照组和STAT3 拮抗组间比较差异均无统计学意义(P>0.05)。 见图3。
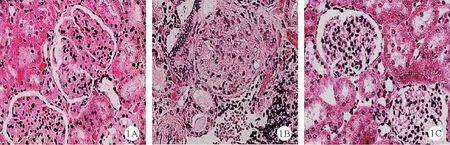
图1 3 组大鼠移植后的肾脏组织病理学变化[A:空白对照组;B:阳性对照组;C:STAT3 拮抗组;HE 染色,×400]

图2 3 组大鼠免疫组化检测结果比较[链霉菌抗生物素蛋白-过氧化物酶连结(SP)染色,×400]

图3 3 组大鼠肾脏组织中JAK2/STAT3 及纤维化指标表达水平比较
讨 论
慢性排斥反应进程由多种因子共同作用导致,临床上大多表现为肾小球滤过率下降、出现蛋白尿和高血压等。 在慢性排斥反应引起的移植肾损伤发生发展过程中,非免疫因素也起着至关重要的作用,其中包括缺血再灌注损伤、急性肾小管坏死、高血压等。 本研究结果显示,术后12 周空白对照组和STAT3 拮抗组大鼠血清SCr 及BUN 水平均低于阳性对照组,证明了使用ADM3100 拮抗剂能延缓肾脏移植慢性排斥导致的肾损伤。 既往研究结果也显示AMD3100 对移植肾损伤的保护主要是通过其免疫调节作用,可在炎症早期降低炎症趋化因子水平,减轻炎症损害[9]。
在慢性排斥反应导致的移植肾损伤发展过程中,炎症细胞浸润产生了大量包括表皮生长因子、胰岛素样生长因子、血小板源生长因子(PDGF)和TGF-β1等细胞因子,目前认为 TGF-β1与肾纤维化最为密切。TGF-β1可通过Smad3 依赖的信号通路直接激活或诱导成纤维细胞向肌成纤维细胞(MF)的转化[10]。 本研究中免疫组化检测结果显示,阳性对照组大鼠肾脏组织肾小管中可见大量TGF-β1及Smad3 阳性细胞,在肾间质和肾小管中可见大量的α-SMA 阳性细胞;而在空白对照组和 STAT3 拮抗组中 TGF-β1、Smad3 和α-SMA阳性细胞明显减少。 由此可见,STAT3 拮抗对肾纤维化有一定的抑制作用。 α-SMA 是肾固有细胞转分化和肾脏纤维化的重要环节和标志[11]。 在正常的肾脏组织中,α-SMA 只在血管中层平滑肌细胞表达,在TGF-β1等促纤维因子的刺激下,可以激活肾脏固有细胞的α-SMA 基因,使细胞表达α-SMA 并分化为MF 或类MF 细胞[12]。 MF 细胞和类MF 细胞是肾脏细胞外基质的主要来源,是肾脏纤维化的主要原因。 本研究结果发现 TGF-β1、α-SMA、JAK2 和 STAT3 蛋白表达水平在空白对照组和STAT3 拮抗组均低于阳性对照组,由此可见,STAT3 拮抗可明显降低JAK2 和 STAT3 的表达水平,且JAK2/STAT3 在大鼠移植肾慢性排斥反应模型的肾脏中高表达,STAT3 拮抗可有效保护肾功能,延缓慢性排斥反应的进程,减轻肾脏组织中炎症细胞浸的润,从而减少TGF-β1/Smad3 通路的激活,抑制α-SMA 的表达,最终减轻肾脏纤维化[13]。
综上所述,STAT3 的特异性抑制剂可在肾脏移植慢性排斥反应中抑制JAK2/Smad3 信号通路所引起的炎性反应,对肾脏移植起到一定的保护作用。 由于时间、人力等问题,本实验存在一定的不足,未对各组大鼠术后不同时间点的SCr、BUN、血压及磷酸化JAK2、STAT3 等进行检测,在以后的研究中应进一步充实实验内容,为以后肾脏移植慢性排斥的研究提供依据。
