植物蚜虫及其抗性研究进展
2020-08-28范元兰陈敏王其刚张颢邱显钦
范元兰 陈敏 王其刚 张颢 邱显钦


摘要:蚜虫是植物主要的害虫之一,对植物的危害非常严重,同时对农业生产造成巨大的经济损失。目前用于防治蚜虫的手段,主要有化学防治和培育抗蚜新品种,其中化学防治较为普遍,但培育植物抗蚜新品种更具有长远价值,物理防治、农业防治、天敌防治可作为植物防治蚜虫的辅助措施,植物基因工程防治将是一条有效的防治蚜虫途径。对植物蚜虫特征、危害症状、发生条件及规律、危害机制、防治措施、植物抗蚜性及抗蚜鉴定、抗蚜基因及其表达等方面研究情况进行概述,可为植物抗蚜相关研究提供理论依据,为植物抗蚜分子育种提供科学参考。
关键词:蚜虫;防治措施;抗蚜机制;抗蚜鉴定;抗蚜基因
中图分类号: S433.39 文献标志码: A
文章编号:1002-1302(2020)14-0033-12
蚜虫对植物的危害非常严重,一方面蚜虫通过刺吸植物汁液或释放有毒物質直接危害植物,影响植物的正常生理代谢活动及生长发育;另一方面蚜虫是植物病原体的传播媒介,植物极其常见的病毒病害大部分是由蚜虫传播的,因此极大地加强了蚜虫对植物的危害[1]。蚜虫虫害的肆虐发生,极大地影响观赏植物的应用价值,造成农林经济的严重损失;因此,加强对蚜虫的防治极其重要。目前防治蚜虫的方法多样,主要有化学防治、物理防治、农业防治、天敌防治等。化学防治应用普遍,但存在污染环境、使蚜虫产生抗药性等问题,而其他防治方法虽然环保,但不能高效准确地防治蚜虫。植物转基因技术的发展为植物从根本上防治蚜虫提供了条件,高抗蚜品种的培育具有更长远的价值。
伴随着基因组、转录组等技术的发展,高抗蚜品种选育、抗蚜基因挖掘、转基因植物抗蚜虫鉴定等方面的研究得以推进,但广谱稳定的高抗蚜基因还有待发掘。植物抗蚜基因工程面临许多问题,如抗蚜基因的高效转化及稳定遗传等,同时,蚜虫产生新的生物型及抗性,从而导致植物抗蚜性的丧失,因此,对植物抗蚜育种的研究还须继续开展下去。本研究从植物蚜虫特征及其危害、侵染机制、防治措施、植物抗蚜机制、抗蚜基因及表达等方面研究进行概述,旨在为植物抗蚜的研究提供理论基础。
1 植物蚜虫概况
1.1 蚜虫分类及特征
1.1.1 蚜虫分类
蚜虫,别称腻虫或蜜虫,属于节肢动物门(Arthropoda)昆虫纲(Insecta)半翅目(Hemiptera)[原为同翅目(Homoptera)]胸喙亚目(Sternorrhyncha),分为球蚜总科(Adegoidea)和蚜总科(Aphidoidea)2个大类,有13个科500多属,目前世界上已知近5 000种蚜虫种类,我国现已发现 1 000 余种[2-3]。
1.1.2 蚜虫形态及其特征
蚜虫为刺吸式昆虫,常以其刺吸式口器刺吸植物韧皮部汁液,以维持正常的生长发育。蚜虫体型小,体长0.5~10.0 mm,身体柔软,多为绿色、淡黄色、白色、红色、黑色等,虫体多为椭圆形,少数为长纺锤形或扁椭圆形等[4-5]。
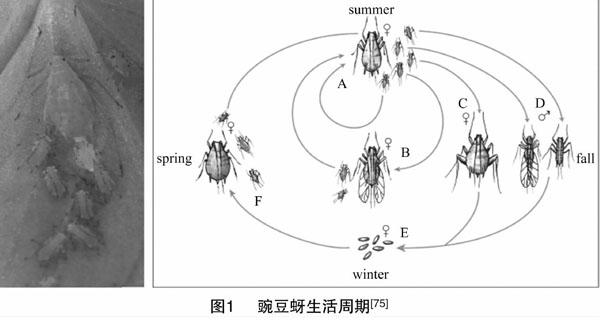
蚜虫有着复杂的生活史,卵生或卵胎生,存在全周期与不全周期。不全周期主要进行孤雌生殖、全周期孤雌生殖、有性生殖世代交替。孤雌生殖世代,蚜虫繁殖速率快,种群增长快,同时世代更替快,易产生耐受性,对植物危害极大。有性生殖世代雌雄蚜虫通过遗传物质重组,既保持了种的特征,同时又产生变异,出现种群内的分化,对环境条件的适应性更强[6]。豌豆蚜在夏天常进行孤雌生殖,后代为无翅孤雌蚜(A)或有翅孤雌蚜(B);秋季时,豌豆蚜进行孤雌生殖(C)或有性生殖(D);冬季时,豌豆蚜产卵越冬(E);春季时,卵发育成无翅孤雌蚜继续进行孤雌生殖(F)(图1)。
同时,蚜虫与寄主植物协同进化,可产生不同的生物型以适应生长发育,同种蚜虫产生不同群体,生活在特定寄主上,表现出不同的生存和发育能力[7]。蚜虫形态特征特化或退化,出现复杂的多型现象及多态现象,每个种不全周期至少具有2个型,全周期有5或6个型:干母、干雌、有翅孤雌型、无翅孤雌型、性母(雌性母和雄性母)、性蚜(雌性蚜、雄性蚜)、卵,可进行转主寄生,有翅蚜迁飞[2,8]。蚜虫还存在多样化的虫瘿、行为分化等特征,有些蚜虫的虫瘿可作药用,如倍蚜;兵蚜有防御进攻行为、利他扩散、虫瘿修复、清洁行为等社会性行为的分化[9]。
蚜虫种类多、分布广、体型小,具有复杂的生活史、多型现象、多态现象以及兵蚜行为分化等特征,使蚜虫能够适应环境,快速繁殖,对植物的危害相当大。
1.2 蚜虫危害特性及影响
1.2.1 蚜虫危害的特异性及广谱性
蚜虫对植物的危害具有特异性或广谱性,即一种蚜虫可危害特定植物或多种植物。蚜虫数量大、种类多,取食存在特异性与非特异性,某些蚜虫只在特定物种(一个科或近缘物种等)上取食,如豌豆蚜(Acyrthosiphon pisum)只能在豆科植物上繁殖,而一些蚜虫是杂食性的,其食谱广泛,可在多科植物上取食,如桃蚜(Myzus persicae)可以在超过400种植物上取食,尤其在双子叶植物上,它可以危害超过40个科的植物,取食范围广泛,造成危害极大[10]。
同时,蚜虫危害的植物范围十分广泛。蚜虫的寄主植物种类繁多,涉及267科2 120属,尤其以蔷薇科、禾本科、豆科、伞形科、兰科、壳斗科、杨柳科等植物为主[1]。蚜虫危害的植物主要包括农业经济作物(如粮食作物、瓜果蔬菜等)以及园林观赏植物(如花卉)等,如大豆(Glycine max)[7]、棉花(Gossypium hirsutum)[11]、烟草(Nicotiana tabacum)[12-15]、油菜(Brassica napus)[16-17]、马铃薯(Solanum tuberosum)[4]、玉米(zea mays)[18]、高粱(Sorghum bicolour)[19-20]、小麦(Triticum aestivum)[13,21-25];危害瓜类,如西瓜(Citrullus lanatus)、黄瓜(Cucumis sativus)、甜瓜(Cucumis melo)[26-29];危害果树,如桃(Prunus persica)[3]、杏(Armeniaca vulgaris)[30];危害蔬菜,如大白菜(Beassica pekinensis)[31]、辣椒(Capsicum Annuum)[32];危害花卉,如菊花(Chrysanthemum morifolium)[33-35]、百合(Lilium spp.)[36]、玫瑰(Rosa rugosa)[37]、月季(Rosa hybrida)[38-41];危害苜蓿(Medicago truncatula)[42-43]等。
1.2.2 蚜虫危害的多样性
危害植物的蚜虫具有多样性,即特定或某一种植物遭受多种蚜虫的危害。蔷薇科上寄生蚜虫种类很多,我国寄生在蔷薇科植物上的蚜虫涉及31属60多种,仅蔷薇属上寄生的蚜虫就有60多种,玫瑰一种植物上寄生的蚜虫种类就有10多种,在月季、玫瑰、桃、杏、李(Prunus salicina)等蔷薇科花卉植物上寄生的蚜虫就有26属40多种[44]。常见的危害花卉的蚜虫有月季长尾蚜(Longicaudus trirhodus)、蔷薇长管蚜(Macrsiphum rosae)、月季长管蚜(Macrosiphum rosivorum)、棉蚜(Aphis gossypii)、桃蚜(Myzus persicae)等[12,45-48]。危害高粱的蚜虫主要包括高粱蚜(Melanaphis sacchari)、麦二叉蚜(Schizaphis graminum)和玉米蚜(Rhopalosiphum maidis)[49]。危害大麦及小麦的有麦长管蚜(Sitobion awenae)、麦二叉蚜(Schizaphis grarninam)、禾谷缢管蚜(Rhopalosiphum padi)、俄罗斯麦蚜(Diuraphis noxia)等[13,23-25,50]。
1.2.3 蚜虫危害部位及症状
蚜虫是植食性昆虫,对寄主植物的危害遍布植物的根、茎、叶、花、果实等部位,其中以植物幼嫩部位为蚜虫主要取食的部位。月季品种滇红的嫩叶(图2-A)、嫩茎(图2-B)、嫩枝、嫩梢、花蕾(图2-C、图2-D)等部位常密布蚜虫。
蚜虫常聚集在这些幼嫩部位,通过取食作用,以其刺吸式口器大量地吸取植物的汁液、破坏植物组织、利用唾液毒害植物等,引起植物出现斑点、卷叶、黄叶、缩叶、虫瘿等多种症状,从而造成植物黄化、枯萎、畸形生长甚至死亡;同时,蚜虫分泌的蜜露覆盖在植物表面,严重影响植物的呼吸作用和光合作用,蜜露中糖分干燥后浓缩产生较高渗透压,使植物细胞发生质壁分离,蜜露还会吸引蚂蚁共同危害植物,引起霉菌孳生诱发植物黑霉病或产生煤污病等;另外,蚜虫除了吸食植物汁液及分泌蜜露对植物造成直接危害外,还传播多种植物病毒,传播病毒危害远超过蚜虫本身对植物造成的危害,对农业生产造成的损失更为严重[51-54]。
1.2.4 蚜虫危害引起病害
蚜虫侵染增加了植物的感病率[55]。蚜虫是植物病毒的主要传播载体,居世界传病毒昆虫之首,蚜虫传播的病毒约占昆虫传播病毒种类的50%,例如桃蚜是超过110种植物病毒的载体[4,6,56],麦二叉蚜传播大麦黄矮病毒(barley yellow dwarf virus,简称BYDV)[22,57],大豆蚜虫(Aphis glycines)传播麻花叶病以及甜菜花叶病[7],棉蚜传播番木瓜环斑病毒(papaya ring spot virus,简称PRSV)、西瓜花叶病毒(watermelon mosaic virus,简称WMV)、西瓜花叶病毒2(WMV2)、小西葫芦黄花叶病毒(zucchini yellow mosaic virus,简称ZYMV)和黄瓜花叶病毒(cucumber mosaic virus,简称CMV)等[28,58-59]。蚜虫常对庄稼、果树、蔬菜等多种农作物造成危害,致使其产量下降,品质降低;同时,蚜虫危害园艺植物,破坏环境美观或导致观赏及应用价值降低,造成严重的经济损失。
1.3 蚜虫发生条件及规律
蚜虫广布于北半球温带亚热带地区,对高温敏感[60],气候变暖可使蚜虫呈减弱趋势,导致蚜虫由低海拔地区向高海拔地区迁移危害[61]。蚜虫的发生有季节性[3],1年发生10~30代,以卵在枝梢、芽腋和树皮裂缝等处越冬,3月中旬开始危害,4—5月危害最严重[62]。4—5月和9—10月是兰州地区蚜虫的2个高发期,气候干燥,气温在 20 ℃ 时适宜蚜虫的繁殖扩散;土壤干旱缺水、植株生长势弱、叶色浅绿的月季品种易发生蚜虫的危害[63]。月季长管蚜4月开始繁殖,5月、10月中下旬大量繁殖[64]。
蚜虫有性繁殖和无性繁殖的交替发生依赖于温度、光周期、寄主植物等多种环境因素,不同温度条件下蚜虫基因的表达存在差异,从而影响其生殖机制[65]。蚜虫表皮蛋白基因(cuticular protein gene,简称CP基因)感知季节性光周期,并推动蚜虫从无性系向有性世代的转变[66]。蚜虫春夏季常进行无性繁殖,秋季日照缩短,温度降低,进行有性繁殖或直接产卵越冬[10]。月季管蚜、桃蚜等通常春夏季为孤雌生殖,秋季为两性生殖产卵越冬,露地栽培时以早春和初夏为多发期,温室常常年发生[67]。蚜虫的生命周期中存在无性繁殖(孤雌生殖)阶段,在此阶段蚜虫的群体增长发展迅速,危害程度增强。蚜虫出生后,在适合的温度条件下,经过4 d左右即可发育为成虫,成虫进行孤雌生殖,而且生殖期长达 2~3 个月,蚜虫成虫繁殖量大,在适合的温度下1 d就可以产10多头[5]。
2 蚜虫危害机制
2.1 蚜虫刺吸并侵染植株
蚜虫是刺吸式昆虫,与咀嚼式昆虫相比,对植物的机械损伤较小,主要采用高度特异化的取食方式(细胞间口针穿透和韧皮部汁液的吸取),刺吸植物韧皮部,以水状唾液及凝胶状唾液注入韧皮部及口器经过周围,以适应寄主植物[10]。蚜虫复杂的唾液蛋白及其体内解毒酶有利于其取食寄主植物,通过唾液产生效应子来调控植物的抗虫防御反应,唾液浓缩植物蛋白阻碍植物防御[25,30,68-69]。蚜虫侵染过程中,蚜虫唾液蛋白ME10被传递到植物细胞内,从而增强了蚜虫对番茄的毒力,ME10还与番茄(Solanum lycopersicum)蚜虫抗性相关的14-3-3亚型TFT7相互作用[70]。
蚜虫与病原菌的侵染信号通路存在着相似性,但具體的侵染分子机制还不清楚。蚜虫与内共生菌存在互作[71-73],内共生和非共生性状维持蚜虫基因家族扩增[74-75]。在自然条件下,与蚜虫种群相关的细菌群落具有多样性[76],且内共生菌能帮助蚜虫扩大生态位,为蚜虫提供了更好的防御病原体、捕食者和寄生虫的能力[77]。
2.2 增强蚜虫危害的机制
蚜虫可通过嗅觉反应定位植株进行迁移危害。马铃薯蚜(Macrosiphum euphorbiae)、绿桃蚜(Myzus persicae)、沙棘蚜(Aphis nasturtii)等3种蚜虫可在植株间裸地上迁移,携带病毒传播,迁移距离约 1.80 m,其中马铃薯蚜移动性最强,蚜虫存在某种定位植株的机制[78]。蚜虫可通过嗅觉反应定位寄主植物,其气味结合蛋白可识别植物蚜虫报警信息素主要成分[反]-β-法尼烯[(E)-β-farnesene,简称EβF],进而选择特定植物进行危害[79]。除了准确定位植株,迁移危害并破坏植物防御,蚜虫还通过自我保护或驱避天敌,进而加强对植物的危害。
蚜虫分泌一层蜡质覆盖于体表,药物难以渗入;豌豆蚜变成绿色不易被瓢虫识别吃掉;释放强烈的芥末油气味,吓跑天敌;蚜虫产生兵蚜进行防御和进攻[5,80]。此外,蚜虫分泌物吸引蚂蚁共同危害植物,蚜虫与蚂蚁存在互惠互利的关系,蚂蚁常消耗蚜虫分泌的蜜露,作为回报,保护蚜虫免受天敌的侵害,即使在没有天敌的情况下,蚜虫也受益于蚂蚁的抚育,蚂蚁可促进蚜虫种群增长,增强对植物的危害[81]。
3 植物蚜虫的防治措施
3.1 农药防治
农药防治可分为化学农药防治、微生物农药防治、植物源农药防治[52]。
目前化学农药仍在蚜虫防治中占主要地位,化学农药有有机磷类、拟除虫菊酯类、新烟碱类等[6,11,52],如氟啶虫酰胺。氟啶虫胺腈属第4代新烟碱类药剂,亚致死剂量的氟啶虫胺腈能够显著抑制F0及F1代桃蚜的寿命和繁殖力[17]。
微生物农药防治也有一定效果。利用真菌、细菌、病毒等病原性微生物,如白僵菌对蚜虫的防治效果显著[82-83]。一定浓度的链格孢菌菌株提取物能够影响蚜虫嗅觉反应,明显抑制蚜虫活性而不伤害植物[37]。
植物源农药防治对植物造成的危害较小,它的有效成分一般都是植物产生的次生代谢物质,如生物碱、酚类、黄酮类等,这些物质对昆虫具有不同程度上的毒杀、驱避或抑制等作用[11,84]。薄荷、麝香草、薰衣草和迷迭香等植物的提取物通过释放水杨酸甲酯来实现对蚜虫的防治[52]。
农药防治的优点是使用方便、见效快、可以减轻害虫对农作物的危害,但广泛、大量和长期使用化学农药,除了使害虫产生抗性外,还会带来一系列的问题,如危害哺乳动物及蚜虫天敌,破壞了生态平衡,污染环境,带来了农药残留、抗药性等。因此,化学防治不论是化学杀虫剂防治、微生物农药防治还是植物源农药防治,防治周期越长带来的问题越大。
3.2 物理防治
物理防治蚜虫具有环境污染小、无残留、不产生抗性等特点,但其准确度较低,操作不方便。蚜虫有趋光性、趋黄性等习性,可采用铺银灰色膜和田间及温室通风口处挂银灰色膜条驱避蚜虫,利用黑光灯与荧光灯在夜间进行蚜虫诱捕,也可用黄色黏胶板诱粘有翅蚜[85]。静电喷雾技术也可应用于蚜虫的防治,微波电磁场杀蚜虫率高,还能促进农作物的生长和开花结果[6]。温度、湿度、光照等气候物理因子直接影响蚜虫的生长发育及繁殖,在生产实践中可适当控制这些因子以达到防治效果。
3.3 农业防治
农业防治作为蚜虫防治的辅助措施,可在实施其他防治措施时结合使用。农业防治即选择抗蚜品种、合理耕种、合理施肥灌溉、加强管理等,以增强作物抗蚜力,改善生境,达到防治蚜虫的目的。农业防治主要关注生态系统整体的调控,达到可持续发展。
修剪、除草、松土、灌溉等农业措施对蚜虫的防治有一定的效果。蚜虫非寄主植物孔雀草、韭菜与月季混栽对月季长管蚜种群调控起一定作用[40]。同时,施肥对蚜虫也有一定的防治效果,如通过调控矿质元素的水平可改变寄主植物的挥发性次生物质,从而产生抗虫性[41]。Saska等研究了草甘膦类除草剂对麦无网长管蚜(Metopolophium dirhodum)的亚致死效应,除草在一定程度上可以减少虫源,但施用除草剂对种群参数有显著的负面影响,且这种负面影响随着除草剂浓度的增加,效果逐渐增强,带来一系列问题[86]。因此,农业防治过程中需采用合理且可持续的措施。
3.4 天敌防治
蚜虫的天敌种类很多,主要有捕食性和寄生性2类,捕食性的天敌包括瓢虫、食蚜蝇、草蛉等;寄生性天敌主要是寄生蜂[87-88]。利用天敌进行防治蚜虫,可以有效地避免植物蚜虫抗(耐)药性的产生。在生产实践过程中,注意保护蚜虫天敌,可对植物蚜虫的防治起到一定作用。天敌对蚜虫种群数量有显著的影响[47],同时蚜虫天敌对不同种类蚜虫的捕食力存在差异[89]。
利用天敌防治蚜虫不易产生抗性问题,但由于受到一定环境条件的限制,天敌防治效果不稳定,易受自然条件影响,见效较慢,存在局限性,难以大规模使用[52-53]。因此,结合其他方法进行综合防治,同时提高植物自身的抵抗力来减少蚜虫对植物的危害是非常重要的。
4 植物抗蚜性及抗蚜鉴定
4.1 植物抗蚜机制
4.1.1 植物对蚜虫的抗性
通过对植物抗蚜机制和抗蚜基因的了解,可以针对性地提高植物的抗蚜虫能力。植物与蚜虫存在互作关系,植物性状的变异直接或间接地与抗虫机制有关[90-91]。当植物受到蚜虫胁迫,植物开启特异的防卫系统进行防御。植物对蚜虫的抗性通常可以分为3类:驱避性(antixenosis)、耐害性(tolerance)、抗生性(antibiosis)。趋避性表现为植物对蚜虫的不选择性;耐害性主要表现为植物的组成型防御,能够在一定程度上抵抗蚜虫的危害;抗生性常表现为植物产生对蚜虫的抵抗力,影响蚜虫生长发育或致其死亡[49]。
4.1.2 植物防御蚜虫的机制
植物防御蚜虫的机制分为2类:组成型防御(constitutive defense)和诱导型防御(induced defense)。组成型防御为直接防御,指蚜虫侵袭前植物自身所具有的防御特性阻碍蚜虫取食,例如植物表面的刺、蜡质、毛状体、细发状体、腺毛,以及叶色、外部形状等特征影响蚜虫的取食行为,木质素的积累使细胞壁加厚,形成层超木质化,对昆虫的取食构成机械障碍[16,26,33]。
诱导型防御指植物在遭受蚜虫进攻后所表现出来的一种防御特性,可分为直接防御和间接防御。诱导型间接防御是蚜虫或其他胁迫信号诱导植物产生挥发性物质吸引寄生性天敌和捕食性天敌进行防御;诱导型直接防御是蚜虫取食诱导植物生理生化的改变直接防御蚜虫,如植保素直接抑制蚜虫的消化(图3)。
此外,当植物遭受蚜虫胁迫,植物还通过酶活性变化(超氧化物歧化酶SOD、过氧化氢酶CAT、过氧化物酶POD、多酚氧化酶PPO等),植物激素水平变化(水杨酸SA、脱落酸ABA、茉莉酸JA等),植物自身营养物质改变,产生有毒次生物质(生物碱类、木质素、类黄酮、单宁等)、防御蛋白(苯丙烷类代谢途径酶、蛋白酶抑制剂、病程相关蛋白等)等进行自我防御[28,68,92-93]。
活性氧簇(reactive oxygen species,简称ROS)是植物胁迫反应时重要的信号分子[94-95]。在植物与蚜虫的互作过程中,蚜虫效应因子可以启动活性氧的产生和胼胝质沉积,诱导植物的防御反应[96]。植物激素在植物防御中起重要作用,脱落酸和茉莉酸有助于提高大豆对蚜虫的耐受性[97]。ABA可调节活性氧水平来提高菊花的抗蚜性[34]。脂肪酸去饱和酶(fatty acid desaturases,简称FADs)影响植物蚜虫互作,其功能的丧失使植物以依赖水杨酸SA的方式增强了抗蚜性[98]。[反]-β-法尼烯[(E)-β-farnesene,EβF]是绝大多数蚜虫报警信息素的主要成分,可使蚜虫产生骚动,从植株上脱落,并吸引蚜虫天敌,有效控制蚜虫危害[56],如EβF能够引起豌豆蚜的气味结合蛋白(OBP3、OBP7)与豌豆蚜嗅觉受体(ApisOR5)及共受体(ApisOrco)的反应,从而使豌豆蚜逃离植株或掉落,同时EβF吸引豌豆蚜天敌进行防御(图4)。
4.1.3 植物免疫反应系统
植物防御依赖2个免疫反应系统,一是跨膜模式识别受体PRRs响应病原菌关联分子模式诱导PAMP(pathogen associated molecular patterns)激活免疫反应PTI(PAMP triggered immunity),二是核苷酸结合位点区-亮氨酸重复序列区(Nucleotide binding site-leucine rich repeat,简称NBS-LRR)膜受体识别激活效应因子免疫反应ETI(effector triggered immunity)[100]。病原相关的分子模式(microbial-associated molecular patterns,简称MAMPs)具有特殊的受体识别机制,植食性昆虫相关的分子模式(herbivore-associated molecular patterns,简称HAMPs)类似于MAMPs,具有与特殊受体结合的特异性防御机制,植物可以通过R基因(resistance genes)对蚜虫取食活动进行识别以激发下游的调控形成防御应答[101]。蚜虫与病原菌的侵染信号通路存在相似,但植物抗蚜性可能具有专一性[42],不同或同一植物对不同来源的蚜虫抗性可能具有不同的遗传机制,目前对植物抗蚜的分子机制还不清楚。
4.2 抗蚜鉴定与评价
在生产实践中对抗蚜品种的筛选鉴定尤为重要。目前,关于植物蚜蟲的抗性鉴定与评价取得了一定的进展。植物抗蚜性主要通过人工接种蚜虫进行鉴定,也可通过自然感蚜进行鉴定[20]。鉴定对象主要是野生种质资源、转基因植物等。植物接种蚜虫需培养1~2龄若虫或成虫,温度为20~28 ℃,相对湿度为55%~85%,光—暗周期多为16 h—8 h或14 h—10 h或18 h—6 h,用毛笔接种蚜虫至植株,为防止蚜虫逃逸使用透光透气罩[14,70,102-104]。
何俊平等对32份切花菊品种进行鉴定,得到10份高抗蚜品种[33]。周俐宏等对31份野生百合品种进行抗蚜虫鉴定,人工接种棉蚜2龄若虫,根据蚜量比值法,获得13份高抗蚜品种[36]。王仕伟等连续2年对222份玉米自交系在自然发病的条件下进行蚜虫抗性鉴定和评价,利用发病率、蚜情指数、最大危害度和危害度等4个指标对玉米进行蚜虫抗性评价,表明以危害度为指标进行抗蚜虫鉴定可较好地衡量抗、感差异,筛选出15份高抗蚜玉米自交系[105]。
Chen等通过植物抗蚜性的高通量表型分析,在筛选5 160个突变株系的过程中,鉴定出9个蚜虫抗性增强的株系[106]。利用电子刺探图谱技术EPG可以定位植物对蚜虫表达抗性的组织部位[107]。赵曼等利用刺吸电位EPG技术,以E和Np波作为评价抗性强弱的指标,鉴别蚜虫对植物的取食差异,从而筛选抗蚜品种[108]。蚜虫取食过程中造成的机械损伤和化学信号都会使得植物总叶绿素和类胡萝卜素产生波动,因此,这也成为一种鉴定抗感品种的新方法[10]。
5 植物抗蚜分子水平研究
5.1 抗蚜基因
5.1.1 抗蚜基因分类
目前,已经克隆得到的抗虫基因有很多种,一方面根据其来源可以分为3大类:第1类是从细菌中分离出来的抗虫基因,如苏云金杆菌(Bacillus thuringiensis)Bt基因;第2类是从植物组织中分离出来的抗虫基因,如蛋白酶抑制剂基因;第3类是从动物体内分离到的毒素基因,如蜘蛛毒素基因[109]。Bt基因对鳞翅目和鞘翅目害虫有很强的毒杀作用,但对蚜虫等同翅目害虫防治效果不明显,制约了Bt基因在植物抗蚜分子育种中的应用[56]。目前研究比较广泛的是从植物中获得的抗蚜虫基因,如来源于番茄的抗马铃薯蚜的Mi-1,2基因,来源于甜瓜的抗棉蚜的Vat基因,来源于大豆的抗大豆蚜虫的Rag基因(表1)。
另一方面,根据抗蚜虫基因的特性,抗蚜基因大体可分为2类:一类是特异性抗蚜基因,另一类是广谱性抗蚜基因。特异性抗蚜基因的抗蚜虫谱窄,只作用于特定的植物与蚜虫,而广谱性抗蚜基因抗蚜虫能力却不高,安全性也有待提高。
特异性抗蚜基因,如抗甜瓜棉蚜的Vat、只对苹果红圆尾蚜(Dysaphis devecta)生物Ⅰ型和Ⅱ型起作用的Sd1、抗大豆蚜虫(Aphis glycines)的Rag(3)、从野生莴苣(Lactuca sativa)中分离的对莴苣蚜虫(Nasonovia ribisnigr)具有专一抗性的的Nr、番茄中抗马铃薯蚜虫(Myzus persicae)的Mi-1,2、大麦中的Rdn(2)、高梁中的Ssg(9)、小麦中的Dn(10)等抗蚜基因,该类基因抗蚜机制与植物对病原菌的专一性抗性机制类似,抗性基因与来自昆虫的无毒基因相互识别,相互作用导致寄主植物抗性发生[4,10,51,110-111]。
另一类是广谱性抗蚜基因,如植物凝集素基因、蛋白酶抑制剂基因PI、细胞分裂素基因IPT等。植物中3大类蛋白酶抑制剂:丝氨酸蛋白酶抑制剂、巯基蛋白酶抑制剂、金属蛋白酶抑制剂,植物蛋白酶抑制剂是广泛存在于植物界的一类天然抗虫物质,具有抗虫谱广、对人畜无副作用等优点,但对半翅目的蚜虫作用不明显[80,109,112-113]。但也有研究表明,蛋白酶抑制剂对桃蚜繁殖力有一定的抑制作用[114]。细胞分裂素基因编码异戊烯基转移酶,为细胞分裂素合成的关键酶,IPT对虫的作用没有专一性,通过影响蚜虫的吸收及其生理代谢,干扰蚜虫生长发育[52]。
目前发现的抗蚜基因大都属于R基因家族,携带卷曲螺旋核苷酸结合位点及胞内富含亮氨酸重复受体蛋白(coiled coil-nucleotide binding site-leucine rich repeat,简称CC-NBS-LRR)结构域,如Vat基因是一种CC-NBS-LRR基因,可编码CC-NBS-LRR蛋白[54,58]。抗性基因R基因通常介导的是垂直抗性[56],这些NBS-LRR抗蚜基因和植物抗病基因有可能具有相似的作用机制,抗性基因识别蚜虫效应蛋白后激发信号级联反应,快速激活植物对蚜虫的防御反应[6]。
5.1.2 植物凝集素基因
目前,对植物凝集素基因的研究是基因工程的热点。植物凝集素的分类多样,根据其在细胞中存在的部位可以分为可溶性凝集素和膜结合凝集素;根据植物凝集素亚基的结构特征,植物凝集素被分成4种类型:部分凝集素、全凝集素、嵌合凝集素、超凝集素;根据凝集素专一识别的糖类的不同,可以分为6个组别:岩藻糖组、半乳糖/N-乙酰半乳糖胺组、N-乙酰葡萄糖胺组、甘露糖组、唾液酸组、复合糖组;根据结合糖的特异性,可将植物凝集素分为7个家族:葫芦科韧皮部凝集素家族、2-型核糖体失活蛋白家族、豆科类凝集素家族、木菠萝凝集素家族、苋菜凝集素家族、几丁质结合凝集素家族、单子叶结合甘露糖凝集素家族等7个蛋白质家族[11,15,51,109]。植物凝集素的甘露糖特异结合性以及昆虫体内的糖基化模式决定了植物凝集素对同翅目昆虫具有较高的杀虫效果[24]。
植物凝集素中研究比较广泛的是雪花莲凝集素(Galanthus nivalis agglutinin,简称GNA)基因,雪花莲凝集素来自石蒜科雪花莲属,结合甘露糖,对蚜虫有很强的抑制作用,对哺乳动物的毒性很低,可作抗蚜基因候选对象,但对蚜虫天敌对生存有一定的影响;尾穗苋凝集素ACA基因是一类比GNA抗蚜活性更高的凝集素,结合糖时无需金属离子参与,对哺乳动物安全,一定情况下抗性比GNA高,是潜在的抗蚜基因;三叶半夏凝集素PTA和掌叶半夏凝集素PPA基因,结构和作用机制与GNA相似,特异地识别并结合昆虫消化道表面的甘露糖残基,对哺乳动物的毒性较低;伴刀豆凝集素ConA最初从蓖麻中分离得到,能特异地结合半乳糖和甘露糖,ConA通过改变蚜虫氨基酸的代谢过程来实现对蚜虫的抗性;除此之外,植物凝集素还有大蒜凝集素(Allium sativum leaf agglutinin,简称ASAL)基因、苋菜凝集素(amaranth lectins,简称AHA)基因、麦胚凝集素(wheat germ agglutinin,简称WGA)基因、豌豆凝集素(P-Lec)基因、海芋凝集素(Alocasia macrorrhiza lectin,简称AML)基因等[4,15,53,109]。
5.2 抗蚜基因的定位与分析
陈青等运用RAPD技术,在F2代群体中采用混合分组分析法(bulked segregant analysis,简称BSA)进行分子标记研究,找到一个与辣椒抗蚜性基因连锁的标记OPA18600,并在杂种后代F2群体和供试抗、感品种中得到了验证[32]。王成等利用SSR分子标记监测到一个与高粱抗蚜性相关的QTL,位于标记Xcup29与Sam61581之间[20]。张南南等利用单核苷酸多态性SNP标记定位桃抗蚜性状的基因,得到52个候选基因[3]。Liang等通过黄瓜抗蚜相关差异表达筛选鉴定49个基因,这些基因涉及黄瓜蚜虫抗性相关的信号转导、植物-病原体相互作用、类黄酮生物合成、氨基酸代谢、糖代谢等途径,其中有8个基因可能与蚜虫抗性有关,通过选择表达的基因与标签测序分析结果基本一致[115]。
5.3 抗蚜基因的克隆与表达
目前已經克隆得到大量的抗蚜虫相关基因,通过转基因技术将一些抗蚜虫基因转入了植物中,并在提高外源基因的表达方面取得了一定的进展。
杨广东等通过农杆菌介导法将雪花莲外源凝集素基因GNA导入了大白菜自交系282,经分子检测和抗虫试验表明,GNA基因已整合进大白菜基因组,转基因植株有一定的抗蚜虫能力[31]。眭顺照等从蜡梅花cDNA文库中克隆到了一个蜡梅凝集素基因CpLEC,转基因植株有效抑制蚜虫群体增长率[103]。段晓亮人工合成了雪花莲凝集素基因sGNA与中国水仙凝集素基因sNTL,并通过RT-PCR获得了半夏凝集素基因PTA,得到转基因小麦抗蚜效果好[24]。安聪等克隆了菊花中苯丙氨酸解氨酶基因(PAL),其在菊花的根中表达量最高,蚜虫胁迫和茉莉酸甲酯(MeJA)可诱导CmPAL基因的表达,水杨酸(SA)、独角金内酯类似物GR24则抑制CmPAL的表达,表明该基因可能参与多种胁迫防御反应和激素应答[35]。
不同表達载体对抗蚜虫基因转化效率有一定的影响。裴东明等将携带抗蚜虫基因蚜虫报警信息素EβF的表达载体pNCX和pBJ40分别转入玉米愈伤组织,以pNCX为载体的基因转化效果较好[116]。张彦等利用特异性表达启动子水稻Rubisco构建异天南星基因aha表达载体,通过基因枪法与携带BAR基因的PAHC20载体共转化到小麦品种科农199中,得到转基因抗蚜虫小麦[23]。Yuan等通过结合使用韧皮部特异性启动子,以及用定点突变方法改良的雪花莲凝集素GNA前体蛋白DNA序列编码基因,提高GNA的表达水平,使GNA转基因植物获得更高的抗蚜性[12]。Duan等从掌叶半夏中克隆出一个新的潜在凝集素基因,掌叶半夏凝集素(Pinellia pedatisecta agglutinin,PPA)基因与半夏凝集素(Pinellia ternata agglutinin,PTA)基因具有9269%的核苷酸相似性和94%的氨基酸相似性,使用韧皮部特异性组成型启动子核酮糖二磷酸羧化酶小亚基因rbcs构建pBAC-rbcs-ppa表达载体转化小麦,得到的转PPA基因植株在室内及田间试验中均有抗蚜性,PPA可能是生产抗蚜虫小麦的强有力的抗蚜候选基因[117]。
6 展望
蚜虫种类繁多、数量庞大、危害严重,随着转录组学、基因组学、分子标记及高通量测序等技术的发展,植物转基因技术日趋成熟,抗蚜基因工程成为防治植物蚜虫的一条有效途径。植物抗蚜的根本在于提高植物自身的抗蚜性,其次在于对蚜虫针对性的防治,还须考虑植物与蚜虫之间的互作。
6.1 抗蚜基因的高表达
在基因工程防治蚜虫的过程中,可以采用一些必要的策略:调控抗蚜基因表达部位,选择合适的表达载体及启动子;利用基因编辑技术改造抗蚜基因;利用基质结合区提高抗蚜基因表达;利用定位信号(如绿色荧光蛋白GFP、报告基因GUS等)提高抗蚜基因表达;联合使用2种以上的抗蚜基因增加表达量。
与单基因抗蚜品种相比,聚合多基因抗蚜品种对大豆蚜具有更持久的抗性,聚合抗性基因具有加强抑制蚜虫种群和提高抗性基因耐用性的潜力[118-120]。但多基因共转化转基因植株高代分离明显,纯合的转基因后代抗蚜虫显著[121]。因此,使用多个纯合基因,有利于提高品系的抗蚜性。
6.2 目的基因的沉默
在抗蚜基因工程中除了通过提高植物抗蚜基因表达量,还可通过RNA干扰技术沉默蚜虫目的基因,进而达到植物抗蚜的目的。RNA干扰(RNAi)是由dsRNA介导的一种序列特异性转录后基因沉默机制,能够特异性地抑制目的基因的表达。转录后基因沉默机制RNA干扰(RNAi)是一种潜在的作物保护策略[122]。
王晖等利用RNA干扰技术显著降低麦长管蚜与桃蚜体内细胞色素P450表达水平,导致目的基因沉默,蚜虫死亡[13]。宿主介导的重要昆虫基因的RNAi被认为是发展作物抗虫害能力的潜在途径,针对蚜虫表皮蛋白基因(cuticular protein gene,CP基因)的宿主介导的RNAi损害了桃蚜的繁殖力,与其他转基因策略相比,RNAi介导的抗性预计更持久[66]。除了饲喂蚜虫dsRNA[123],还可直接注射dsRNA达到沉默蚜虫相关基因的目的,同时,注射dsRNA的剂量及时间对蚜虫基因沉默的效率有一定的影响[124]。
此外,利用GFP追踪绿桃蚜对dsRNA的摄取可有效评价靶基因敲除[125]。Fan等从麦长管蚜中克隆一个嗅觉共受体[olfactory receptors (ORs) co-receptors,Orco]基因SaveOrco,利用RNA干扰(RNAi)使蚜虫SaveOrco的表达降低到34.11%,影响蚜虫的嗅觉定位植物的行为,导致蚜虫对植物蚜虫报警信息素(E-β-farnesene,EβF)和其他挥发物的反应减弱[126]。目前鉴定出的能显著致死或抑制蚜虫生长的靶标基因较少,而且植物和蚜虫体内的核酸酶可降解外源dsRNA[56]。因此,利用RNAi技术培育抗蚜作物的关键在于选择合适的靶基因和植物细胞中产生足够量的dsRNA,且能通过蚜虫的取食进入其体内而不被降解[127]。
6.3 蚜虫的快速鉴定
选育高抗蚜品种能够有效防治蚜虫,同时,DNA条形码可快速鉴定蚜虫,为精准有效地防治蚜虫提供有力条件。DNA条形编码(DNA bar coding)即应用单一片段基因序列差异来快速区分、鉴定物种的方法,常用线粒体基因CO[QX(Y15]Ⅰ[QX)]序列作为昆虫系统发育的标记[44,128]。
参考文献:
[1]方 燕,乔格侠,张广学. 蚜虫寄主植物与取食部位的多样性[J]. 动物分类学报,2006,31(1):31-39.
[2]姜立云,乔格侠,张广学,等. 东北农林蚜虫志:昆虫纲、半翅目、蚜虫类[M]. 北京:科学出版社,2011:1-14.
[3]张南南,鲁振华,崔国朝,等. 基于SNP标记桃抗蚜性状的基因定位[J]. 中国农业科学,2017,50(23):4613-4621.
[4]郑光宇. 基因工程防治蚜虫研究进展[J]. 喀什师范学院学报,2006,27(3):54-60.
[5]马亚玲,刘长仲. 蚜虫的生态学特性及其防治[J]. 草业科学,2014,31(3):519-525.
[6]唐平华,陈国平,朱明库,等. 蚜虫防治技术研究进展[J]. 植物保护,2013,39(2):5-12.
[7]肖 亮,武天龙. 大豆抗蚜虫研究进展[J]. 中国农学通报,2013,29(36):326-333.
[8]张广学. 西北农林蚜虫志:昆虫纲、同翅目、蚜虫类[M]. 北京:中国环境科学出版社,1999:1-88.
[9]黄晓磊,乔格侠. 蚜虫学研究现状与学科发展趋势[J]. 昆虫学报,2006,49(6):1017-1026.
[10]陈超权,刘盛兰嘉,孔李俊,等. 植物抗蚜生理及分子机制的研究进展[J]. 植物保护,2018,44(2):11-21.
[11]张海娜,钱玉源,刘 祎,等. 蚜虫防治研究概况及在棉花上的应用[J]. 农学学报,2015,5(8):36-39.
[12]Yuan Z Q,Zhao C Y,Zhou Y,et al. Aphid-resistant transgenic tobacco plants expressing modified gna gene[J]. Acta Botanica Sinica,2001,43(6):592-597.
[13]王 晖,张 珉,张小红,等. 利用RNAi技术沉默麦长管蚜与桃蚜细胞色素P450[J]. 中国农业科学,2012,45(17):3463-3472.
[14]张 勇,范 佳,赵兴延,等. 植物防御信号物质JA/SA对桃蚜解毒酶谷胱甘肽-S-转移酶及唾液腺基因C002表达诱导反应[J]. 中国科学:生命科学,2016,46(5):665-672.
[15]刘 玎,陈 劲,刘 志,等. 掌叶半夏凝集素基因PPA2抗蚜功能分析[J]. 生物技术通报,2016,32(10):180-187.
[16]李海林,赵德刚. 转IPT基因油菜提高抗蚜虫能力[J]. 分子植物育种,2011,9(3):343-349.
[17]王泽华,范佳敏,陈金翠,等. 氟啶虫胺腈亚致死浓度对桃蚜生长和繁殖的影响[J]. 中国农业科学,2017,50(3):496-503.
[18]武德功,王 俊,张露雨,等. 抗、感玉米幼苗玉米蚜为害后不同时间的生理响应[J]. 江苏农业学报,2018,34(3):493-502.
[19]李金梅,赵威军,张福耀,等. 高粱抗蚜虫研究综述[J]. 杂粮作物,2006,26(5):363-365.
[20]王 成,罗 峰,高建明,等. 高粱抗蚜QTL定位[J]. 河南农业科学,2014,43(7):80-84.
[21]徐琼芳,李连城,马有志,等. 用天花粉蛋白基因转化小麦获得转基因植株[J]. 遗传,2001,23(2):135-137.
[22]徐琼芳,田 芳,陈 孝,等. 转GNA基因小麦新株系的分子检测和抗蚜虫性鉴定[J]. 麦类作物学报,2005,25(3):7-10.
[23]张 彦,喻修道,唐克轩,等. 用基因枪法获得转异天南星基因aha抗蚜虫小麦[J]. 作物学报,2012,38(8):1538-1543.
[24]段晓亮. 三种植物凝集素基因在转基因小麦中的表达及其抗蚜效果分析[D]. 北京:中国农业大学,2013.
[25]李时荣,葛朝虹,刘德广,等. 寄主植物对不同基因型麦长管蚜解毒酶活性的影响[J]. 西北农业学报,2018,27(2):283-293.
[26]任 佳,周福才,陈学好,等. 黄瓜叶片物理性状对黄瓜抗蚜性的影响[J]. 中国生态农业学报,2014,22(1):52-57.
[27]刘亚丽,马荣金,胡丽丽,等. 无毛黄瓜抗蚜性与挥发性物质的关系[J]. 中国农学通报,2014,30(22):270-275.
[28]陈敏炀,梁郸娜,陈学好. 瓜类作物抗蚜研究进展[J]. 分子植物育种,2017,15(9):3803-3810.
[29]Gonzalez V M,Aventin N,Centeno E,et al. Interspecific and intraspecific gene variability in a 1-Mb region containing the highest density of NBS-LRR genes found in the melon genome[J]. BMC Genomics,2014,15(1):1131.
[30]劉 林. 蚜虫取食对杏叶片细胞分化、果枝节间伸长和花芽形成量的影响[J]. 园艺学报,2012,39(4):749-756.
[31]杨广东,朱 祯,李燕娥,等. 雪花莲外源凝集素基因在大白菜中的表达和抗蚜性遗传分析[J]. 园艺学报,2003,30(3):341-342.
[32]陈 青,张银东. 与辣椒抗蚜性基因连锁的RAPD标记[J]. 园艺学报,2003,30(6):737-738.
[33]何俊平,陈发棣,陈素梅,等. 不同菊花品种抗蚜虫性鉴定[J]. 生态学杂志,2010,29(7):1382-1386.
[34]张 瓒,王萃铂,房伟民,等. ABA喷施提高菊花抗蚜性及其生理机理[J]. 植物生理学报,2014,50(12):1857-1862.
[35]安 聪,张 一,张皖皖,等. 菊花CmPAL基因的克隆及表达分析[J]. 南京农业大学学报,2019,42(1):73-80.
[36]周俐宏,张惠华,吴天宇,等. 不同百合品种抗蚜虫性鉴定[J]. 北方园艺,2018,42(11):85-88.
[37]李贝贝,陈玉惠,赵 宁,等. 链格孢菌0845菌株粗提物对月季长管蚜的抑制活性[J]. 贵州农业科学,2013,41(4):89-91.
[38]马洪兵,刘 玉,姜淑霞,等. 阿维菌素和士达防治月季长管蚜及黄杨绢野螟试验[J]. 山东林业科技,2006,35(2):50-51.
[39]李 莉,杨 斌. 链格孢菌粗毒素对月季的伤害及对月季长管蚜影响[J]. 北方园艺,2011,35(4):169-171.
[40]赵 宁,冯 丹,杨 斌. 非寄主植物与月季混栽对月季长管蚜种群的影响[J]. 广东农业科学,2012,39(7):97-99.
[41]赵 宁,王大伟,冯小飞,等. 外施矿质元素对月季长管蚜嗅觉行为的影响[J]. 江苏农业科学,2015,43(10):183-185.
[42]Gao L L,Klingler J P,Anderson J P,et al. Characterization of pea aphid resistance in Medicago truncatula[J]. Plant Physiol,2008,146(3):996-1009.
[43]武德功. 豌豆蚜地理种群遗传多样性及其种群调控机制研究[D]. 兰州:甘肃农业大学,2011.
[44]温 娟,陈 睿,姜立云,等. 基于DNA条形码对北京地区蔷薇科花卉上蚜虫的快速鉴定[J]. 应用昆虫学报,2013,50(1):29-40.
[45]赵晓萌,曾召海. 骆驼蓬植物的不同提取物杀虫活性研究[J]. 中国农学通报,2005,21(4):278-279.
[46]白海燕,马建列,陈毅仁. 附子浸渍液对花卉蚜虫的毒力测定及药效试验[J]. 中国农学通报,2006,22(2):323-325.
[47]周夏芝,音正兵,叶志军. 月季园蚜虫及其天敌类群相互关系分析[J]. 安徽农学通报,2008,14(3):108-109.
[48]Alford L,Marley R,Dornan A,et al. Assessment of neuropeptide binding sites and the impact of biostable kinin and CAP2b analogue treatment on aphid (Myzus persicae and Macrosiphum rosae) stress tolerance[J]. Pest Management Science,2019,75(6):1750-1759.
[49]刘国庆,杜瑞恒,侯升林,等. 高粱抗蚜研究进展[J]. 植物学报,2012,47(2):171-187.
[50]郑爱泉,张宝林. 小麦抗麦蚜基因工程的研究进展[J]. 贵州农业科学,2015,43(9):11-14.
[51]郭洪年,侯漢娜,欧阳青,等. 抗蚜基因及其转基因植物[J]. 中国生物工程杂志,2008,28(6):118-124.
[52]苗猛猛,王旭静,唐巧玲,等. 抗蚜基因工程研究进展[J]. 生物技术进展,2012,2(2):104-109.
[53]陈 劲,刘 志,朱生伟. 抗蚜基因及其转基因作物研究进展[J]. 生物技术通报,2014,29(10):1-7.
[54]Boissot N,Thomas S,Chovelon V,et al. NBS-LRR-mediated resistance triggered by aphids:viruses do not adapt; aphids adapt via different mechanisms[J]. BMC Plant Biology,2016,16(18):25.
[55]Drakulic J,Ajigboye O,Swarup R,et al. Aphid infestation increases Fusarium langsethiae and T-2 and HT-2 mycotoxins in wheat[J]. Applied and Environmental Microbiology,2016,82(22):6548-6556.
[56]贾殿勇,高世庆,段鹏飞,等. [反]-β-法尼烯合成酶基因在植物抗蚜分子育种中的应用[J]. 生物工程学报,2018,34(1):12-23.
[57]徐琼芳,田 芳,陈孝侯,等. 转基因抗虫小麦中sgna基因的遗传分析及抗虫性鉴定[J]. 作物学报,2004,30(5):475-480.
[58]Dogimont C,Chovelon V,Pauquet J,et al. The Vat locus encodes for a CC-NBS-LRR protein that confers resistance to Aphis gossypii infestation and A. gossypii-mediated virus resistance[J]. The Plant Journal,2014,80(6):993-1004.
[59]Shi X,Gao Y,Yan S,et al. Aphid performance changes with plant defense mediated by cucumber mosaic virus titer[J]. Virology Journal,2016,13(1):70.
[60]Zhang K,Pan Q,Yu D,et al. Systemically modeling the relationship between climate change and wheat aphid abundance[J]. Science of the Total Environment,2019,674:392-400.
[61]霍治国,李茂松,王 丽,等. 气候变暖对中国农作物病虫害的影响[J]. 中国农业科学,2012,45(10):1926-1934.
[62]孟彦贞. 月季主要病虫害发生规律及防治措施[J]. 现代农业科技,2012,40(3):228-236.
[63]杨春兰,杨永花,陆 娟,等. 兰州地区月季主要病虫害及其防治措施[J]. 甘肃农业科技,2017,44(1):78-82.
[64]蒋雪勤,陆华兵,黄雷芳,等. “红帽子”月季病虫害综合防治技术[J]. 上海农业科技,2010,39(6):108.
[65]Liu P,Yang Z X,Chen X M,et al. RNA-Seq-based transcriptome and the reproduction-related genes for the aphid Schlechtendalia chinensis (Hemiptera,Aphididae)[J]. Genetics and Molecular Research,2017,16(1):gmr16019448.
[66]Bhatia V,Bhattacharya R. Host-mediated RNA interference targeting a cuticular protein gene impaired fecundity in the green peach aphid Myzus persicae[J]. Pest Management Science,2018,74(9):2059-2068.
[67]嚴桂华,曹 萍. 月季主要病虫害及其防治[J]. 现代农业科技,2007,35(22):94,97.
[68]禹海鑫,叶文丰,孙民琴,等. 植物与植食性昆虫防御与反防御的三个层次[J]. 生态学杂志,2015,34(1):256-262.
[69]de Vos M,Jander G. Myzus persicae (green peach aphid) salivary components induce defence responses in Arabidopsis thaliana[J]. Plant Cell & Environment,2009,32(11):1548-1560.
[70]Chaudhary R,Peng H C,He J,et al. Aphid effector Me10 interacts with tomato TFT7,a 14-3-3 isoform involved in aphid resistance[J]. New Phytologist,2019,221(3):1518-1528.
[71]Lv N,Wang L,Sang W,et al. Effects of endosymbiont disruption on the nutritional dynamics of the pea aphid Acyrthosiphon pisum[J]. Insects,2018,9(4):161.
[72]Nakabachi A,Ishida K,Hongoh Y,et al. Aphid gene of bacterial origin encodes a protein transported to an obligate endosymbiont[J]. Current Biology,2014,24(14):R640-R641.
[73]Shigenobu S,Watanabe H,Hattori M,et al. Genome sequence of the endocellular bacterial symbiont of aphids Buchnera sp. APS[J]. Nature,2000,407(6800):81-86.
[74]Duncan R P,Feng H,Nguyen D M,et al. Gene family expansions in aphids maintained by endosymbiotic and nonsymbiotic traits[J]. Genome Biology and Evolution,2016,8(3):753-764.
[75]Richards S,Gibbs R A,Gerardo N M,et al. Genome sequence of the pea aphid Acyrthosiphon pisum[J]. Plos Biology,2010,8(2):e1000313.
[76]Haynes S,Darby A C,Daniell T J,et al. Diversity of bacteria associated with natural aphid populations[J]. Appl Environ Microbiol,2003,69(12):7216-7223.
[77]Ramirez-Caceres G E,Moya-Hernandez M G,Quilodran M,et al. Harbouring the secondary endosymbiont Regiella insecticola increases predation risk and reproduction in the cereal aphid Sitobion avenae[J]. Journal of Pest Science,2019,92(3):1039-1047.
[78]Alyokhin A,Sewell G. On-soil movement and plant colonization by walking wingless morphs of three aphid species (Homoptera:Aphididae) in greenhouse arenas[J]. Environmental Entomology,2003,32(6):1393-1398.
[79]Fan J,Xue W,Duan H,et al. Identification of an intraspecific alarm pheromone and two conserved odorant-binding proteins associated with (E)-β-farnesene perception in aphid Rhopalosiphum padi[J]. Journal of Insect Physiology,2017,101:151-160.
[80]杨振立,李 旸,吴志明,等. 观赏植物抗蚜虫新途径分析[J]. 河北农业科学,2018,22(3):47-49.
[81]Rice K B,Eubanks M D. No enemies needed cotton aphids(Hemiptera:Aphididae) directly benefit from red imported fire ant(Hymenoptera:Formicidae)tending[J]. Florida Entomologist,2013,96(3):929-932.
[82]Yanar D,Yanar Y,Belguzar S,et al. In vitro effects of entomopathogenic beauveria bassiana isolates against rose aphids (Macrosiphum rosae L. Hemiptera:aphididae)[J]. Fresenius Environmental Bulletin,2019,28(2A):1443-1447.
[83]Sayed S M,Ali E F,Al-Otaibi S S. Efficacy of indigenous entomopathogenic fungus,Beauveria bassiana (Balsamo) Vuillemin,isolates against the rose aphid,Macrosiphum rosae L. (Hemiptera:Aphididae) in rose production[J]. Egyptian Journal of Biological Pest Control,2019,29(1):19.
[84]Ikbal C,Pavela R. Essential oils as active ingredients of botanical insecticides against aphids[J]. Journal of Pest Science,2019,92(3):971-986.
[85]刘学香. 月季花病虫害防治技术[J]. 新农村,2012,4(6):61-62.
[86]Saska P,Skuhrovec J,Luká J,et al. Treatment by glyphosate-based herbicide alters life history parameters of the rose-grain aphid Metopolophium dirhodum[J]. Scientific Reports,2016,6(1):27801.
[87]Shrestha G,Enkegaard A. The green lacewing,chrysoperla carnea:preference between lettuce aphids,nasonovia ribisnigri,and western flower thrips,Frankliniella occidentalis[J]. Journal of Insect Science,2013,13(94):1-10.
[88]Saeed M M,Raza A B M,Afzal M,et al. Presence of less-preferred hosts of the aphid parasitoids Aphidius ervi and Praon volucre reduces parasitism efficiency[J]. Phytoparasitica,2018,46(1):89-96.
[89]Arshad M,Khan H A A,Hafeez F,et al. Predatory potential of Coccinella septempunctata L. against four aphid species[J]. Pakistan Journal of Zoology,2017,49(2):623-627.
[90]Broekgaarden C,Snoeren T A,Dicke M,et al. Exploiting natural variation to identify insect-resistance genes[J]. Plant Biotechnology Journal,2011,9(8):819-825.
[91]Smith C M,Chuang W P. Plant resistance to aphid feeding:behavioral,physiological,genetic and molecular cues regulate aphid host selection and feeding[J]. Pest Management Science,2014,70(4):528-540.
[92]張海静,严 盈,彭 露,等. 韧皮部取食昆虫诱导的植物防御反应[J]. 昆虫学报,2012,55(6):736-748.
[93]Koch K G,Chapman K,Louis J,et al. Plant tolerance:a unique approach to control hemipteran pests[J]. Front Plant Science,2016,7(33):1363.
[94]Lei J,A F S,Salzman R A,et al. BOTRYTIS-INDUCED KINASE1 modulates arabidopsis resistance to green peach aphids via PHYTOALEXIN DEFICIENT4[J]. Plant Physiology,2014,165(4):1657-1670.
[95]Van-Chung M,Ba-Hoanh N,Duc-Dien N,et al. Nostoc calcicola extract improved the antioxidative response of soybean to cowpea aphid[J]. Botanical Studies,2017,58(1):55.
[96]Jaouannet M,Rodriguez P A,Thorpe P,et al. Plant immunity in plant-aphid interactions[J]. Front Plant Sci,2014,5:663.
[97]Chapman K M,Marchi-Werle L,Hunt T E,et al. Abscisic and jasmonic acids contribute to soybean tolerance to the soybean aphid (Aphis glycines Matsumura)[J]. Scientific Reports,2018,8(1):15148.
[98]Avila C A,Arévalo-Soliz L M,Jia L,et al. Loss of function of FATTY ACID DESATURASE7 in tomato enhances basal aphid resistance in a salicylate-dependent manner[J]. Plant Physiology,2012,158(4):2028-2041.
[99]Zhang R,Wang G,Wang B,et al. Molecular basis of alarm pheromone detection in aphids[J]. Current Biology,2017,27(1):55-61.
[100]袁 亮,郭慧娟,孙玉诚,等. 蚜虫诱导的植物免疫反应[J]. 应用昆虫学报,2015,52(1):23-31.
[101]顾小辉,魏建和,王国全,等. 虫害诱导植物合成防御性次生代谢产物的研究进展[J]. 生命科学研究,2017,21(5):458-465.
[102]Digilio M C,Corrado G,Sasso R,et al. Molecular and chemical mechanisms involved in aphid resistance in cultivated tomato[J]. New Phytology,2010,187(4):1089-1101.
[103]眭顺照,李琳莉,祝钦泷,等. 蜡梅凝集素基因克隆及其對蚜虫、蛞蝓抗性分析[J]. 中国农业科学,2011,44(2):358-368.
[104]Coleman A D,Wouters R H,Mugford S T,et al. Persistence and transgenerational effect of plant-mediated RNAi in aphids[J]. Journal Exp Bot,2015,66(2):541-548.
[105]王仕伟,李晓鹏,陈甲法,等. 玉米抗蚜虫种质资源的鉴定[J]. 玉米科学,2018,26(2):156-160.
[106]Chen X,Vosman B,Visser R G,et al. High throughput phenotyping for aphid resistance in large plant collections[J]. Plant Methods,2012,8(1):33.
[107]郭素敏. 蒺藜苜蓿抗蚜虫的遗传分析[D]. 南京:南京林业大学,2011.
[108]赵 曼,田体伟,李为争,等. 玉米蚜在8个玉米品种(系)上取食行为的比较分析[J]. 中国农业科学,2015,48(8):1538-1547.
[109]陈红梅,李昆志,陈丽梅. 植物来源抗虫基因的研究进展[J]. 中国生物工程杂志,2008,28(11):116-121.
[110]Hesler L S,Chiozza M V,ONeal M E,et al. Performance and prospects of Rag genes for management of soybean aphid[J]. Entomologia Experimentalis et Applicata,2013,147(3):201-216.
[111]Puterka G J,Nicholson S J,Brown M J,et al. Characterization of eight Russian wheat aphid (Hemiptera:Aphididae) biotypes using two-category resistant-susceptible plant responses[J]. Journal of Economic Entomology,2014,107(3):1274-1283.
[112]柳武革,薛庆中. 蛋白酶抑制剂及其在抗虫基因工程中的应用[J]. 生物技术通报,2000,15(1):23-28.
[113]江汉民,宋文芹,刘莉莉,等. 抗虫相关基因KTI对青花菜的转化及其对小菜蛾抗性的分析[J]. 园艺学报,2013,40(3):498-504.
[114]Losvik A,Beste L,Mehrabi S,et al. The protease inhibitor CI2c gene induced by bird cherry-Oat aphid in barley inhibits green peach aphid fecundity in transgenic Arabidopsis[J]. Int J Mol Sci,2017,18(6):1317.
[115]Liang D,Liu M,Hu Q,et al. Identification of differentially expressed genes related to aphid resistance in cucumber (Cucumis sativus L.)[J]. Scientific Rports,2015,5(1):9645.
[116]裴东明,杜光玲,李海霞,等. 不同表达载体对玉米抗蚜虫基因转化效率的影响[J]. 河南农业大学学报,2012,46(3):237-241.
[117]Duan X,Hou Q,Liu G,et al. Expression of Pinellia pedatisecta lectin gene in transgenic wheat enhances resistance to wheat aphids[J]. Molecules,2018,23(4):748.
[118]Jun T H,Rouf M M,Michel A P. Genetic mapping of three quantitative trait loci for soybean aphid resistance in PI 567324[J]. Heredity (Edinb),2013,111(1):16-22.
[119]McCarville M T,ONeal M E,Potter B D,et al. One gene versus two:a regional study on the efficacy of single gene versus pyramided resistance for soybean aphid management[J]. Journal of Economic Entomology,2014,107(4):1680-1687.
[120]da Silva Queiroz O,Hanson A A,Potter B D,et al. Impact of single gene and pyramided aphid-resistant soybean on movement and spatial pattern of soybean aphid (Hemiptera:Aphididae)[J]. Journal of Economic Entomology,2018,111(6):2946.
[121]刘贤雯,王 彪,姚陆铭,等. 大豆高代抗虫转基因后代分子检测与抗蚜虫鉴定分析[J]. 大豆科学,2011,30(3):455-458.
[122]Christiaens O,Smagghe G. The challenge of RNAi-mediated control of hemipterans[J]. Current Opinion in Insect Science,2014,6:15-21.
[123]Pitino M,Coleman A D,Maffei M E,et al. Silencing of aphid genes by dsRNA feeding from plants[J]. PLoS One,2011,6(10):e25709.
[124]Ye C,An X,Jiang Y,et al. Induction of RNAi core machinerys gene expression by exogenous dsRNA and the effects of pre-exposure to dsRNA on the gene silencing efficiency in the pea aphid (Acyrthosiphon pisum)[J]. Frontiers in Physiology,2019,9:1906.
[125]Bilgi V,Fosu-Nyarko J,Jones M G. Using vital dyes to trace uptake of dsrna by green peach aphid allows effective assessment of target gene knockdown[J]. Intect Journal Mology Science,2017,18(1):80.
[126]Fan J,Zhang Y,Francis F,et al. Orco mediates olfactory behaviors and winged morph differentiation induced by alarm pheromone in the grain aphid,Sitobion avenae[J]. Insect Biochem Mol Biol,2015,64:16-24.
[127]羅晓丽,张安红,肖娟丽,等. 棉蚜腺苷三磷酸酶E亚基基因RNAi载体的构建及其抗蚜性分析[J]. 棉花学报,2018,30(5):353-362.
[128]王剑峰,乔格侠. DNA条形编码在蚜虫类昆虫中的应用[J]. 动物分类学报,2007,32(1):153-159.
收稿日期:2019-07-30
基金项目:国家重点研发计划(编号:2018YFD1000402);国家科技支撑计划(编号:2015BAD10B01);云南省中青年学术技术带头人后备人才培养项目(编号:2015HB078);云岭产业技术领军人才。
作者简介:范元兰(1994—),女,贵州普安人,硕士研究生,主要从事月季抗蚜遗传育种研究。E-mail:fanyuanlan@hotmail.com。
通信作者:张 颢,硕士,研究员,主要从事月季遗传育种研究,E-mail:zhanghao7898@sina.com;邱显钦,博士,研究员,主要从事月季抗病遗传育种研究,E-mail:xianqin711@hotmail.com。
