褪黑素浸枝对葡萄扦插苗镉积累的影响
2020-08-28王均王进刘继廖明安林立金
王均,王进,刘继,廖明安,林立金*
褪黑素浸枝对葡萄扦插苗镉积累的影响
王均1,王进2,刘继3,廖明安1,林立金2*
(1.四川农业大学园艺学院,四川 成都 611130;2.四川农业大学果蔬研究所,四川 成都 611130;3.成都市农林科学院,四川 成都 611130)
通过盆栽试验,研究不同浓度(50、100、150、200 μmol/L)褪黑素浸枝对葡萄扦插苗镉积累的影响。结果表明:褪黑素浸枝能提高镉胁迫下葡萄扦插苗的生物量及镉含量;随着褪黑素浓度的增加,葡萄扦插苗根系及地上部生物量均呈先增后降的趋势,用150 μmol/L褪黑素浸枝,葡萄扦插苗根系及地上部生物量分别较对照提高20.78%和57.62%;根系及地上部镉含量则呈增加的趋势,用200 μmol/L褪黑素浸枝,根系及地上部镉含量分别较对照提高559.53%和113.27%;褪黑素浸枝可提高葡萄扦插苗的光合色素含量和抗氧化酶活性。褪黑素浸枝虽可促进葡萄的生长,但也造成葡萄镉的积累,不宜用于镉污染区的葡萄生产。
葡萄;扦插苗;褪黑素;镉;浸枝
褪黑素(N–乙酰基–5–甲氧基色胺)是色氨酸的吲哚衍生物[1],早期被认为仅存在于动物体内,与动物个体的发育、生殖有密切关系;之后发现它还存在于土豆、黄瓜、苹果、水稻、小麦等植物体中[2–3],其在植物体内的作用逐渐被人们所认知[4]。由于褪黑素的合成途径与生长素(IAA)有些类似,最早有人推测它们的功能也相似,都可以调控植物生长[5]。近年来,越来越多的研究发现,褪黑素不仅能调控植物生长,还在植物逆境调控中起重要作用。外源添加适量褪黑素,能够提高植物对逆境如干旱、高温、低温、盐、重金属等胁迫的耐受性。有研究表明,在干旱胁迫条件下,褪黑素处理可提高黄瓜种子的萌发率,促进其根系伸长[6]。适宜的褪黑素浓度处理,可提高高温胁迫下拟南芥种子的萌发率[7]和促进冷害胁迫下拟南芥的生长[8]。狼尾草种子萌发过程中施加褪黑素,可提高狼尾草抵抗盐胁迫的能力[9]。在重金属胁迫条件下,褪黑素处理能够提高豌豆幼苗对铜胁迫和镉胁迫的耐受能力,并降低豌豆幼苗的铜和镉含量[10]。褪黑素处理促进了豌豆幼苗的生长,提高了豌豆对镉的耐性,也显著降低了豌豆幼苗的镉含量[11]。虽然不同浓度的褪黑素处理促进了萝卜的生长,且100 μmol/L和150 μmol/L的褪黑素降低了萝卜体内镉含量,但50 μmol/L和200 μmol/L的褪黑素处理却提高了萝卜体内镉含量[12]。对树番茄()的研究结果表明,低浓度(50 μmol/L)的褪黑素处理,促进了树番茄的生长,提高了其抗氧化酶活性,高浓度(大于50 μmol/L)的褪黑素处理,则抑制了树番茄的生长,但不同浓度的褪黑素均提高了树番茄的镉含量[13]。
由于农药、化肥的不合理施用及其他一些原因,导致果园土壤受到重金属(特别是镉)污染[15–16]。鉴于此,笔者针对葡萄园的土壤镉污染问题,用不同浓度褪黑素浸泡葡萄枝条,再将其扦插在镉污染的基质上,研究褪黑素对葡萄扦插苗镉积累的影响,以期筛选出能显著降低葡萄镉含量的最佳褪黑素浓度,为镉污染地区的葡萄生产提供参考。
1 材料与方法
1.1 材料
2016年12月,于四川农业大学成都校区农场果园,采集当年生葡萄‘夏黑’的充实枝条,用湿润的珍珠岩覆盖,保存于4 ℃冰箱中。供试褪黑素为Sigma–Aldrich的产品。
1.2 方法
1) 2017年3月,选择一批粗细基本一致、芽饱满的葡萄枝条,剪成长约10 cm的枝条段(顶端保留1个芽),参照文献[11–12]的方法,将枝条浸泡于50 μmol/L的褪黑素溶液中,以清水作为对照,24 h后,扦插于珍珠岩中,每3 d浇灌1次1/2 Hoagland营养液。另设加入0.1 mmol/L镉(CdCl2·2.5H2O)的1/2 Hoagland营养液的处理。试验设置4个处理:A0,对照(清水);A1,0.1 mmol/L镉处理;A2,50 μmol/L褪黑素处理;A3,50 μmol/L褪黑素+0.1 mmol/L镉处理。每个处理重复3次。每个重复20根枝条。2个月后(新枝生长长约10 cm),整株收获,分别将根系及地上部(去除老枝)清洗干净,再用去离子水冲洗3次,于110 ℃杀青15 min,75 ℃烘干至恒重,称重(测定干重生物量),粉碎,称取1.000 0 g样品,加入硝酸–高氯酸(体积比为4∶1),放置12 h后消化至溶液透明,过滤、定容至50 mL,用iCAP 6300型ICP光谱仪(Thermo Scientific)测定镉含量[17],并计算镉转运系数[18]。
2) 2017年6月,选择另一批粗细基本一致、芽饱满的枝条,剪成长约10 cm的枝条段(枝条顶端保留1个芽),分别浸泡于不同浓度的褪黑素溶液中,24 h后扦插于珍珠岩中,并用含有0.1 mmol/L镉CdCl2·2.5H2O)的1/2 Hoagland溶液浇灌,每3 d浇灌1次营养液。试验设5个处理:B0,清水对照;B1,50 μmol/L褪黑素;B2,100 μmol/L褪黑素;B3,150 μmol/L褪黑素;B4,200 μmol/L褪黑素。每个处理重复3次。每个重复20根枝条。待葡萄枝条生长2个月后(新枝生长长约10 cm),整株收获,测定葡萄叶片叶绿素a、叶绿素b、叶绿素总量和类胡萝卜素含量,测定抗氧化酶(SOD、POD和CAT)活性和可溶性蛋白含量[19]。再将根系和地上部(去除老枝)清洗干净,测定生物量(干样)和镉含量,并计算镉转运系数[18]。
1.3 数据处理
试验数据采用SPSS 20.0进行方差分析(Duncan新复极差法进行多重比较)。
2 结果与分析
2.1 褪黑素浸枝对葡萄扦插苗生物量和镉含量的影响
50 μmol/L褪黑素浸枝处理的葡萄扦插苗的生物量和镉含量测定结果列于表1。从表1可以看出,与清水对照(A0)相比,0.1 mmol/L的镉处理(A1)使葡萄扦插苗根系及地上部生物量分别降低了29.03%和17.96%,表明0.1 mmol/L镉处理抑制了葡萄扦插苗的生长;与A0相比,50 μmol/L的褪黑素处理(A2)使葡萄扦插苗根系及地上部生物量分别增加了22.10%和12.20%,表明50 μmol/L的褪黑素浸枝促进了葡萄扦插苗根系及地上部分的生长。与A1相比,A3使葡萄扦插苗根系及地上部生物量分别增加了30.87%和14.22%。镉胁迫(A1)降低了葡萄扦插苗的根冠比,但与A0的差异无统计学意义。A2提高了葡萄扦插苗的根冠比,但与A0的差异均无统计学意义。
从表1还可以看出,与A0相比,A1、A2都增加了葡萄扦插苗根系及地上部分镉含量,A2使葡萄扦插苗根系及地上部镉含量分别增加了442.36%和131.46%;与A1相比,A3使葡萄扦插苗根系及地上部镉含量分别增加了58.72%和66.25%,由此可见,褪黑素促进了葡萄扦插苗对镉的吸收与积累;与A0相比,A2减小了葡萄扦插苗的转运系数。

表1 葡萄扦插苗生物量和镉含量及镉转运系数
不同小写字母表示处理间差异显著(<0.05)。
2.2 不同浓度褪黑素浸枝对葡萄扦插苗生物量和镉含量的影响
镉胁迫下,不同浓度褪黑素浸枝对葡萄扦插苗生物量和镉含量的测定结果(表2)表明,褪黑素浸枝均提高了葡萄扦插苗的生物量。随着褪黑素浓度的增加,葡萄扦插苗根系及地上部生物量呈先增后降的趋势。与B0相比,B1对葡萄扦插苗根系和地上部生物量增加不显著;B2、B3和B4使葡萄扦插苗根系生物量分别增加了12.67%、20.78%和16.50%,使地上部生物量分别增加了47.02%、57.62%和51.66%。褪黑素降低了镉胁迫条件下葡萄扦插苗的根冠比,且随褪黑素浓度的增加而呈降低的趋势,但不同浓度褪黑素处理之间差异不显著。
从表2还可以看出,不同浓度褪黑素浸枝均提高了葡萄扦插苗根系及地上部镉含量。随着褪黑素浓度的增加,葡萄扦插苗根系及地上部镉含量均呈增加的趋势,最大值出现在B4。与B0相比,B1、B2、B3和B4使葡萄扦插苗根系镉含量分别增加了30.05%、62.85%、229.79%和559.53%,地上部镉含量分别增加了68.14%、86.73%、101.88%和113.27%。B1和B2提高了葡萄扦插苗的镉转运系数,B3和B4则降低了葡萄扦插苗的镉转运系数。
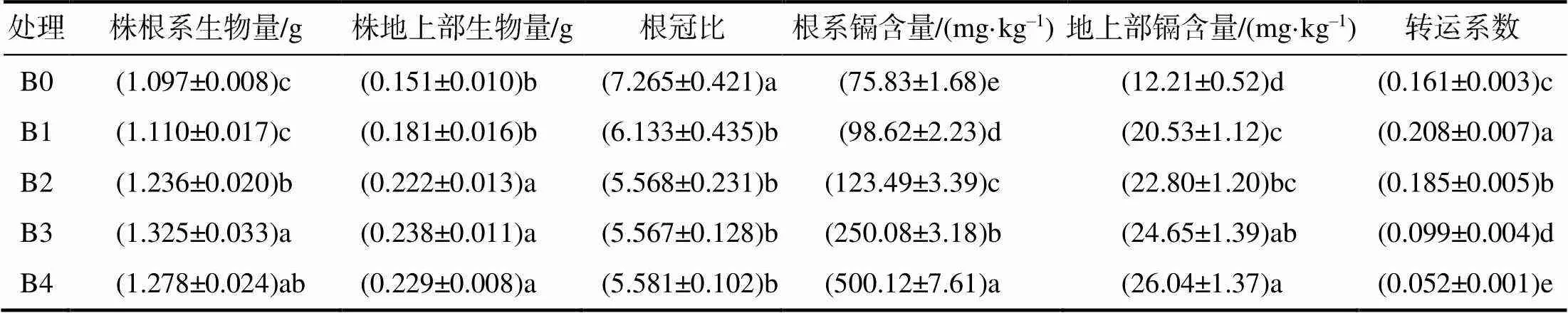
表2 镉胁迫下褪黑素浸枝的葡萄扦插苗生物量和镉含量及镉转运系数
不同小写字母表示处理间差异显著(<0.05)。
2.3 镉胁迫下褪黑素浸枝对葡萄扦插苗光合色素含量的影响
从表3可知,褪黑素浸枝提高了镉胁迫下葡萄扦插苗的光合色素(叶绿素a、叶绿素b、叶绿素总量和类胡萝卜素)含量。随着褪黑素浓度的增加,葡萄扦插苗的叶绿素a、叶绿素b、叶绿素总量和类胡萝卜素含量均呈先升高后降低的趋势,最大值出现在B3,这与生物量的变化一致。与B0相比,B1、B2、B3和B4使葡萄扦插苗叶绿素总量分别提高了17.10%、22.77%、55.18%和32.62%。与B0相比,B1、B3、B4对葡萄扦插苗的叶绿素a/叶绿素b影响不显著。

表3 镉胁迫下褪黑素浸枝的葡萄扦插苗光合色素含量
不同小写字母表示处理间差异显著(<0.05)。
2.4 镉胁迫下褪黑素浸枝对葡萄扦插苗抗氧化酶活性的影响
褪黑素浸枝提高了镉胁迫下葡萄扦插苗的抗氧化酶(SOD、POD和CAT)活性,且随着褪黑素浓度的增加而呈升高的趋势(表4)。从表4可以看出,不同浓度褪黑素浸枝提高了镉胁迫下葡萄扦插苗可溶性蛋白含量,且B1、B2、B3和B4使葡萄扦插苗可溶性蛋白含量分别较B0提高了23.48%、28.89%、30.25%和48.08%。

表4 镉胁迫下褪黑素浸枝的葡萄扦插苗的抗氧化酶活性
不同小写字母表示处理间差异显著(<0.05)。
3 讨论
有研究表明,在胁迫条件下,褪黑素能够促进植物的生长[9],但也有研究表明,低浓度的褪黑素(0.1 mmol/L)能够促进芥菜的生长,但高浓度(100 mmol/L)抑制芥菜的生长[20]。在铜胁迫下,褪黑素能够促进红球甘蓝苗的生长,也能提高豌豆对铜胁迫的耐性[10]。本试验结果表明,不同浓度的褪黑素浸枝均能提高镉胁迫下葡萄扦插苗的生物量,且随着褪黑素浓度的增加,扦插苗根系及地上部生物量呈先增后降的趋势,最大值出现在150 μmol/L的褪黑素浓度的处理,这些结果与以往研究结果[9–10,20]一致,说明低浓度的褪黑素浸枝可以促进镉胁迫下葡萄扦插苗的生长,但高浓度的褪黑素对其有一定的抑制作用。
在重金属污染条件下,褪黑素能通过提高植物的抗性而降低重金属在植物体内的积累[21]。褪黑素提高了镉富集植物牛膝菊和牛繁缕的镉积累[22]。也有研究表明,不同浓度的褪黑素提高了果树树番茄根系、茎秆及叶片的镉含量[13]。本试验结果表明,不同浓度褪黑素均不同程度地提高了葡萄扦插苗根系及地上部镉含量,且随着褪黑素浓度的增加,葡萄扦插苗根系及地上部镉含量均呈增加的趋势,最大值出现在200 μmol/L的褪黑素浓度的处理。这些结果说明褪黑素能够促进葡萄对镉的吸收与积累,这与以往的研究结果[13, 22]一致,说明褪黑素对不同植物重金属的积累,可能与植物对重金属的积累特性有关。
在胁迫条件下,植物体内的叶绿素会被降解,从而导致叶绿素含量降低[23]。在低温胁迫下,褪黑素处理能够使百慕大草叶片中的叶绿素含量维持在较高水平[24]。褪黑素能够减弱大麦叶片衰老过程中的叶绿素降解[25],但对镉胁迫下树番茄光合色素的影响不明显[13]。本试验结果表明,褪黑素浸枝提高了镉胁迫葡萄扦插苗的叶绿素a、叶绿素b、叶绿素总量和类胡萝卜素含量,这与前人的研究结果[24–25]一致,说明葡萄对褪黑素具有较高的敏感性[25]。随着褪黑素浓度的增加,葡萄扦插苗的叶绿素a、叶绿素b、叶绿素总量和类胡萝卜素含量均呈先升高后降低的趋势,最大值出现在150 μmol/L褪黑素浓度的处理,说明高浓度的褪黑素也可能抑制葡萄光合色素的合成,这与高浓度褪黑素的毒性有关[13,25]。
与其他植物激素相似,褪黑素能够通过提高植物的抗氧化酶活性和维持细胞膜稳定性来提高植物对胁迫环境的抗性[24, 26]。在镉胁迫下,较低浓度的褪黑素(50~100 μmol/L)能够提高树番茄的SOD、POD和CAT活性及可溶性蛋白含量;不同浓度的褪黑素(50~200 μmol/L)均能够提高豌豆幼苗和萝卜的SOD、POD和CAT活性及可溶性蛋白含量[11–12]。本试验结果表明,褪黑素浸枝提高了镉胁迫葡萄扦插苗的SOD、POD和CAT活性及可溶性蛋白含量,且随着褪黑素浓度的增加而呈升高的趋势,这与前人的研究[11–12, 24, 26]结果一致,说明褪黑素能够提高镉胁迫下葡萄的抗性,促进葡萄的生长。
综上,在镉胁迫条件下,褪黑素浸枝促进了葡萄扦插苗的生长,提高其生物量、光合色素含量及抗氧化酶活性,以150 μmol/L的褪黑素浓度处理的效果最佳;但褪黑素浸枝提高了葡萄扦插苗植株的镉含量,且随着褪黑素浓度的增加有增加的趋势;因此,褪黑素并不适合用于镉污染地区的葡萄生产。
[1] LERNER A B,CASE J D,TAKAHASHI Y,et al. Isolation of melatonin,the pineal gland factor that lightens melanocytes1[J].Journal of the American Chemical Society,1958,80(10):2587.
[2] ARNAO M B,HERNÁNDEZ-RUIZ J.Melatonin in plants[J].Plant Signaling & Behavior,2007,2(5):381–382.
[3] ARNAO M B,HERNÁNDEZ-RUIZ J.Melatonin:plant growth regulator and/or biostimulator during stress?[J]. Trends in Plant Science,2014,19(12):789–797.
[4] DUBBELS R,REITER R J,KLENKE E,et al.Melatonin in edible plants identified by radioimmunoassay and by high performance liquid chromatography-mass spectro- metry[J]. Journal of Pineal Research,1995,18(1):28–31.
[5] MURCH S J,SAXENA P K.Melatonin:a potential regulator of plant growth and development?[J].In Vitro Cellular & Developmental Biology-Plant,2002,38(6):531–536.
[6] ZHANG N,ZHAO B,ZHANG H J,et al.Melatonin promotes water-stress tolerance,lateral root formation,and seed germination in cucumber(L.)[J]. Journal of Pineal Research,2013,54(1):15–23.
[7] HERNÁNDEZ I G,GOMEZ F J V,CERUTTI S,et al.Melatonin inacts as plant growth regulator at low concentrations and preserves seed viability at high concentrations[J].Plant Physiology and Biochemistry,2015,94:191–196.
[8] BAJWA V S,SHUKLA M R,SHERIF S M,et al.Role of melatonin in alleviating cold stress in[J].Journal of Pineal Research,2014,56(3):238–245.
[9] 张娜,蒋庆,李殿波,等.外源施加褪黑素对NaCl胁迫下狼尾草种子萌发及相关生理指标的影响[J].中国农业大学学报,2014,19(4):54–60. ZHANG N,JIANG Q,LI D B,et al.Effect of exogenous melatonin on germination ofunder NaCl stress[J].Journal of China Agricultural University,2014,19(4):54–60.
[10] TAN D X,MANCHESTER L C,HELTON P,et al. Phytoremediative capacity of plants enriched with melatonin[J].Plant Signaling & Behavior,2007,2(6):514–516.
[11] 唐懿,任纬,刘副刚,等.褪黑素浸种对豌豆幼苗生长及镉积累的影响[J].土壤,2018,50(1):109–114. TANG Y,REN W,LIU F G,et al.Effects of melatonin soaking on growth and cadmium accumulation of pea seedlings[J].Soils,2018,50(1):109–114.
[12] 黄佳璟,林立金,陈发波,等.喷施褪黑素对萝卜生长及镉积累的影响[J].四川农业大学学报,2017,35(3):375–380. HUANG J J,LIN L J,CHEN F B,et al.Effects of spraying melatonin on growth and cadmium accumulation of radish[J].Journal of Sichuan Agricultural University,2017,35(3):375–380.
[13] LIN L J,LI J H,CHEN F B,et al.Effects of melatonin on the growth and cadmium characteristics ofseedlings[J].Environmental Monitoring and Assessment,2018,190(3):1–8.
[14] FERNÁNDEZ-MAR M I,MATEOS R,GARCÍA- PARRILLA M C,et al.Bioactive compounds in wine:resveratrol,hydroxytyrosol and melatonin:a review[J]. Food Chemistry,2012,130(4):797–813.
[15] TANG M,ZHANG J Z,ZHANG D,et al.Pollution investigation and assessment of heavy metals in orchard soil-A case study in golden orchard of Chongqing [J]. Chinese Agricultural Science Bulletin,2011,27(14):244–249.
[16] 唐结明,姚爱军,梁业恒.广州市万亩果园土壤重金属污染调查与评价[J].亚热带资源与环境学报,2012,7(2):27–35. TANG J M,YAO A J,LIANG Y H.Heavy metals pollution in the soil of Guangzhou wanmu orchard:investigation and assessment[J].Journal of Subtropical Resources and Environment,2012,7(2):27–35.
[17] 鲍士旦.土壤农化分析[M].北京:中国农业出版社,2000. BAO S D.Soil and Agricultural Chemistry Analysis[M]. Beijing:China Agricultural Press,2000.
[18] RASTMANESH F,MOORE F,KESHAVARZI B. Speciation and phytoavailability of heavy metals in contaminated soils in sarcheshmeh area,Kerman Province,Iran[J].Bulletin of Environmental Contamina- tion and Toxicology,2010,85(5):515–519.
[19] 郝再彬,苍晶,徐仲.植物生理实验[M].哈尔滨:哈尔滨工业大学出版社,2004. HAO Z B,CANG J,XU Z.Plant Physiology Experiment[M].Harbin:Harbin Institute of Technology Press,2004.
[20] CHEN Q,QI W B,REITER R J,et al.Exogenously applied melatonin stimulates root growth and raises endogenous indoleacetic acid in roots of etiolated seedlings of[J].Journal of Plant Physiology,2009,166(3):324–328.
[21] LI M Q,HASAN M K,LI C X,et al.Melatonin mediates selenium-induced tolerance to cadmium stress in tomato plants[J].Journal of Pineal Research,2016,61(3):291–302.
[22] TANG Y,LIN L J,XIE Y D,et al.Melatonin affects the growth and cadmium accumulation of Malachium aquaticum and[J].International Journal of Phytoremediation,2018,20(4):295–300.
[23] BARICKMAN T C,KOPSELL D A,SAMS C E. Abscisic acid increases carotenoid and chlorophyll concentrations in leaves and fruit of two tomato genotypes[J].Journal of the American Society for Horticultural Science,2014,139(3):261–266.
[24] FAN J B,HU Z R,XIE Y,et al.Alleviation of cold damage to photosystem II and metabolisms by melatonin in Bermudagrass[J].Frontiers in Plant Science,2015,6:925.
[25] ARNAO M B,HERNÁNDEZ-RUIZ J.Protective effect of melatonin against chlorophyll degradation during the senescence of barley leaves[J].Journal of Pineal Research,2009,46(1):58–63.
[26] 刘仕翔,黄益宗,罗泽娇,等.外源褪黑素处理对镉胁迫下水稻种子萌发的影响[J].农业环境科学学报,2016,35(6):1034–1041. LIU S X,HUANG Y Z,LUO Z J,et al.Effects of exogenous melatonin on germination of rice seeds under Cd stresses[J].Journal of Agro-Environment Science,2016,35(6):1034–1041.
Effects of melatonin soaking branches on cadmium accumulation in grape cutting seedlings
WANG Jun1, WANG Jin2, LIU Ji3, LIAO Ming’an1, LIN Lijin2*
(1.College of Horticulture, Sichuan Agricultural University, Chengdu, Sichuan 611130, China; 2.Institute of Pomology and Olericulture, Sichuan Agricultural University, Chengdu, Sichuan 611130, China; 3.Chengdu Academy of Agriculture and Forestry, Chengdu, Sichuan 611130, China)
The effects of different concentrations (50, 100, 150 and 200 μmol/L) of melatonin soaking branches on the cadmium accumulation in the grape cuttings were studied by pot experiment. The results showed that melatonin soaking branches increased the biomass and cadmium content of grape cuttings under cadmium stress. With the increase of melatonin concentration, the root and shoot biomasses of grape cuttings increased first and then decreased, and the root and shoot biomasses with 150 μmol/L melatonin increased by 20.78% and 57.62%, respectively compared with the control. Cadmium content in roots and shoots of grape cuttings showed an increasing trend, and the cadmium content in roots and shoots with 200 μmol/L melatonin was increased by 559.53% and 113.27%, respectively, compared with the control. The melatonin soaking branches also enhanced the photosynthetic pigment content and antioxidant enzyme activity of grape seedlings. Therefore, the melatonin soaking branches promoted the growth of grapes, but also promoted the cadmium accumulation of grapes, thus could be not suitable for grape production in cadmium- contaminated areas.
grape; cutting seedlings; melatonin; cadmium; soaking branch

S663.101
A
1007-1032(2020)04-0419-06
10.13331/j.cnki.jhau.2020.04.006
王均,王进,刘继,廖明安,林立金.褪黑素浸枝对葡萄扦插苗镉积累的影响[J].湖南农业大学学报(自然科学版),2020,46(4):419–424.
WANG J, WANG J, LIU J, LIAO M A, LIN L J. Effects of melatonin soaking branches on cadmium accumulation in grape cutting seedlings[J]. Journal of Hunan Agricultural University(Natural Sciences), 2020, 46(4): 419–424.
http://xb.hunau.edu.cn
2019–07–29
2020–01–08
四川省教育厅科研项目(17ZB0342)
王均(1981—),男,四川苍溪人,硕士,讲师,主要从事园艺植物资源与利用研究,4692670@qq.com;
,林立金,博士,副研究员,主要从事果树生理生态及栽培研究,llj800924@qq.com
责任编辑:罗慧敏
英文编辑:罗维
