小剂量骨化三醇联合碳酸司维拉姆延缓维持性血液透析患者血管钙化的效果观察
2020-08-28魏昌林颜怀荣蔡小月庹金丽吴柏杨
魏昌林,颜怀荣,蔡小月,庹金丽,吴柏杨
有文献报道,在成人维持性血液透析患者中,51%~93%的患者存在不同程度血管钙化,其中20%~47%的患者可发展为心脏瓣膜钙化[1]。维持性血液透析患者由于钙磷代谢紊乱,表现为血清钙、磷升高,沉积于血管壁造成血管钙化[2];同时也会引起甲状旁腺激素(PTH)分泌增加导致骨代谢紊乱[3-4]。有研究报道,随着患者血液透析时间延长,血管钙化程度越严重,患心血管疾病风险也越高[5]。现临床上通常采取口服含钙磷结合剂来调节维持性血液透析患者血清钙和磷水平,含钙磷结合剂由于价格便宜在临床应用较广,尽管其可以降低血磷水平但也会引起血钙升高,增加钙磷乘积,导致血管钙化[6]。司维拉姆是一种非含钙磷结合剂,降磷效能优于含钙磷结合剂,且不良反应较少[7]。近年临床采用小剂量骨化三醇联合碳酸司维拉姆调节维持性血液透析患者钙磷代谢,并预防肾性骨病,减少骨性营养不良,但文献报道不多。本研究回顾性分析成都市双流区第一人民医院近年收治的维持性血液透析患者的临床资料,探讨不同磷结合剂用药方案对维持性血液透析患者钙磷代谢和血管钙化的影响,现报告如下。
1 资料与方法
1.1一般资料 选取2018年1月—2019年6月成都市双流区第一人民医院收治的符合纳入及排除标准的维持性血液透析126例。根据磷结合剂用药方案不同将其分为3组,服用碳酸钙D330例作为A组,服用碳酸司维拉姆45例作为B组,服用小剂量骨化三醇联合碳酸司维拉姆51例作为C组。A组男16例,女14例;年龄48~75(63.59±6.29)岁;肾衰竭病程2~8(4.55±1.39)年;透析时间14~53(28.69±6.21)个月。B组男20例,女25例;年龄39~86(61.02±7.22)岁;肾衰竭病程3~11(5.03±1.40)年;透析时间16~48(30.11±7.46)个月。C组男31例,女20例;年龄42~80(64.27±7.67)岁;肾衰竭病程2~15(4.83±1.16)年;透析时间19~63(29.88±9.15)个月。3组性别、年龄、肾衰竭病程及透析时间比较差异无统计学意义(χ2=2.564、P=0.278,F=2.590、P=0.079,F=1.218、P=0.299,F=0.315、P=0.730),具有可比性。本研究经医院医学伦理委员会批准同意执行。
1.2纳入及排除标准 纳入标准:①所有患者均符合慢性肾衰竭5期(尿毒症期)诊断标准[8];②维持性血液透析12个月以上,透析依从性良好;③临床资料完整;④患者和(或)其家属对本研究知情同意并签署知情同意书。排除标准:①原发性甲状旁腺功能亢进症患者;②长期服用糖皮质激素患者;③透析期间使用除遵医嘱服用磷结合剂以外影响钙磷代谢药物患者。
1.3治疗方法 所有入选患者血液透析均为每周3次,透析方式为自体动静脉内瘘,使用德国贝朗透析机进行血液透析,选用碳酸盐透析液,每次透析4 h。透析期间,所有入选患者均在饮食上严格控制磷摄入,遵医嘱服用磷结合剂。A组给予碳酸钙D3口服,碳酸钙D3咀嚼片(惠氏制药有限公司生产,国药准字H10950030,每片300 mg)每次300 mg,每日3次,进餐时嚼碎口服。B组给予碳酸司维拉姆口服,碳酸司维拉姆片(爱尔兰Genzyme有限公司生产,国药准字J20130160,每片800 mg)每次800 mg,每日3次,进餐时口服。C组给予小剂量骨化三醇联合碳酸司维拉姆口服,骨化三醇软胶囊(青岛正大海尔制药有限公司生产,国药准字H20030491,每粒0.25 μg)每次0.25 μg,每日1次,睡前口服;碳酸司维拉姆用药方法及剂量等同B组。3组均治疗8周后观察效果。
1.4观察指标及方法 观察比较3组治疗前及治疗8周后血钙、磷及PTH浓度,钙磷乘积,冠状动脉和腹主动脉钙化积分,以及治疗期间药物不良反应发生情况。
1.4.1血钙、磷及PTH浓度:所有入选患者均于治疗前及治疗8周后血液透析前采血进行血钙、磷及PTH浓度检测,血钙检测采用甲基麝香草酚蓝比色法,按照试剂盒(试剂盒购于Biovision公司)说明书进行操作,调配工作液2 ml加入血样20 μl,以空白管校零,碳酸钙标准液为校准管,以612 nm波长比色,根据吸光度计算血钙浓度,参考值为2.1~2.9 mmol/L。血磷检测采用磷钼酸还原法,按照试剂盒(试剂盒购于Biovision公司)说明书进行操作,调配磷试剂和校准液,设置空白管、校准管、标本管,以340 nm波长比色,根据吸光度计算血磷浓度,参考值为0.97~1.62 mmol/L。PTH检测采用双抗体夹心法,按照试剂盒(试剂盒购于Biovision公司)说明书进行操作,将抗人PTH单抗包被于酶标板上,标准品和样品中的PTH与单抗结合,形成免疫复合物连接在板上,加入底物工作液显蓝色,最后加终止液硫酸,以450 nm波长比色,根据吸光度计算PTH浓度,参考值23~63 pmol/L。
1.4.2钙磷乘积:钙磷乘积=血钙浓度×血磷浓度。计算前需将血钙和血磷的国际单位mmol/L转换成mg/dl。钙:1 mmol/L=4.0 mg/dl,磷:1 mmol/L=3.1 mg/dl。钙磷乘积参考值为35~40 mg2/dl2[9]。
1.4.3冠状动脉和腹主动脉钙化积分:所有入选患者治疗前及治疗8周后均行冠状动脉电子束CT(Definition AS加64排128层CT,德国西门子公司生产)扫描和腰1~腰4腹主动脉多层螺旋CT(Definition AS加64排128层CT,德国西门子公司生产)扫描。钙化积分=动脉钙化面积×CT峰值系数。0分为无钙化,1分为少量钙化,2分为轻度钙化,3分为中度钙化,4分为重度钙化[10]。
1.4.4药物不良反应:治疗期间药物不良反应包括恶心、呕吐、腹胀、消化不良及便秘等消化系统反应。

2 结果
2.1血钙、磷及PTH浓度比较 治疗前,3组血钙、磷及PTH浓度总体比较差异均无统计学意义(P>0.05)。治疗8周后,A、B和C组血钙浓度较治疗前升高(t=10.915、P<0.001,t=9.972、P<0.001,t=6.955、P<0.001),血磷及PTH浓度较治疗前降低(血磷:t=2.359、P=0.022,t=7.232、P<0.001,t=9.398、P<0.001;PTH:t=2.321、P=0.024,t=4.388、P<0.001,t=8.048、P<0.001),差异均有统计学意义。治疗8周后,3组血钙、磷及PTH浓度总体比较差异均有统计学意义(P<0.01)。治疗8周后,血钙、磷及PTH浓度A组高于B组和C组(与B组比较:t=2.678、P=0.009,t=4.983、P<0.001,t=4.983、P<0.001;与C组比较:t=4.410,P<0.001,t=5.973,P<0.001,t=4.878,P<0.001),B组高于C组(t=2.667、P=0.009,t=2.138、P=0.035,t=2.373、P=0.020),差异均有统计学意义。见表1。

表1 采用不同磷结合剂用药方案的维持性血液透析3组治疗前后血钙、磷及甲状旁腺激素浓度比较
2.2钙磷乘积比较 治疗前,3组钙磷乘积总体比较差异无统计学意义(P>0.05)。治疗8周后,A组钙磷乘积较治疗前升高(t=5.994、P<0.001),B和C组钙磷乘积较治疗前降低(t=2.704、P=0.008,t=7.462、P<0.001),差异均有统计学意义。治疗8周后,3组钙磷乘积总体比较差异有统计学意义(P<0.01)。治疗8周后,钙磷乘积A组高于B组和C组(与B组比较:t=8.237、P<0.001,与C组比较:t=12.074、P<0.001),B组高于C组(t=4.637、P<0.001),差异均有统计学意义。见表2。
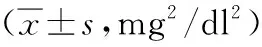
表2 采用不同磷结合剂用药方案的维持性血液透析3组治疗前后钙磷乘积比较
2.3冠状动脉和腹主动脉钙化积分比较 治疗前,3组冠状动脉和腹主动脉钙化积分总体比较差异均无统计学意义(P>0.05)。治疗8周后,A组冠状动脉和腹主动脉钙化积分较治疗前升高,差异有统计学意义(t=6.955、P<0.001,t=4.877、P<0.001);B组和C组冠状动脉和腹主动脉钙化积分与治疗前比较差异无统计学意义(B组:t=1.677、P=0.101,t=0.824、P=0.414;C组:t=0.793、P=0.431,t=1.639、P=0.107)。治疗8周后,3组冠状动脉和腹主动脉钙化积分总体比较差异均有统计学意义(P<0.01)。治疗8周后,冠状动脉和腹主动脉钙化积分A组高于B组和C组,差异有统计学意义(与B组比较:t=3.096、P=0.003,t=4.217、P<0.001;与C组比较:t=6.291、P<0.001,t=6.218、P<0.001);B组高于C组,但差异无统计学意义(t=1.025、P=0.308,t=1.203、P=0.232)。见表3。
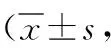
表3 采用不同磷结合剂用药方案的维持性血液透析3组治疗前后冠状动脉和腹主动脉钙化积分比较分)
2.4药物不良反应发生情况 治疗期间,3组药物不良反应发生均较少,仅A组4例、B组1例、C组1例出现恶心、呕吐、腹胀、消化不良和便秘等消化系统反应,皆症状轻微不影响治疗,且未经特殊处理好转。
3 讨论
心脑血管疾病、钙磷代谢紊乱及肾性骨病是维持性血液透析患者常见并发症,也是影响维持性血液透析患者生活质量和病死率的主要因素。维持性血液透析患者由于高钙血症,导致钙盐沉积于动脉管壁,引起一系列病理改变发生血管钙化,进而导致血管内皮功能异常、粥样硬化,造成心脏重构、左心室肥大,明显增加心血管事件风险[11-15]。有文献报道,高钙、高磷、低维生素D、骨转化异常、骨性营养不良和使用含钙磷结合剂是维持性血液透析患者血管钙化主要危险因素,血磷每升高1 mg/dl维持性血液透析患者冠状动脉钙化风险增加22%,腹主动脉钙化风险增加33%,心血管疾病死亡风险上升50%[16-18]。
为预防钙磷代谢紊乱和血管钙化,血液透析前是服用磷结合剂治疗的最佳时机,降磷治疗越早维持性血液透析患者预后越好[19]。目前临床常用的磷结合剂分为含钙和不含钙2种,含钙磷结合剂包括碳酸钙及醋酸钙等钙剂,作用机制在于提高血钙浓度,竞争性结合肠道吸收受体靶点,使钙吸收增加、磷吸收下降,从而降低血磷水平[20]。司维拉姆是一种不含钙非吸收磷酸聚合体,通过结合消化道中的磷酸根来降低血磷水平[21-23]。姜鸿等[24]和郑慧、刘智楠[25]研究报道,血液透析患者应用司维拉姆效果略好于含钙磷结合剂,结合磷的能力略高,却不会提高血钙水平,可以显著抑制钙盐在主动脉沉积,减轻主动脉中层钙化,对于延缓血管钙化有明显优势。
王喆等[26]研究表示,低水平骨化三醇是血管钙化的危险因素。骨化三醇是维生素D3的1,25-二羟代谢物,主要作用为刺激成骨细胞形成,促进骨重建,预防骨性营养不良;并可降低PTH水平,减轻血液透析患者继发性甲状旁腺功能亢进,还能促进肠道钙吸收,调节钙磷代谢。刘继红等[27]研究发现,小剂量骨化三醇可以调节血管微炎症反应,进而减少血管内皮细胞损伤,是血管钙化的保护性因素,在延缓血管钙化上有一定意义。
本研究观察比较碳酸钙D3、碳酸司维拉姆及小剂量骨化三醇联合碳酸司维拉姆对维持性血液透析患者钙磷代谢和血管钙化的影响,结果显示,治疗前,3组血钙、磷及PTH浓度,钙磷乘积,以及冠状动脉和腹主动脉钙化积分总体比较差异均无统计学意义。治疗8周后,A、B和C组血钙浓度均较治疗前升高,血磷及PTH浓度较治疗前降低;A组钙磷乘积较治疗前升高,B和C组钙磷乘积较治疗前降低;A组冠状动脉和腹主动脉钙化积分较治疗前升高,差异均有统计学意义。治疗8周后,3组血钙、磷及PTH浓度,钙磷乘积,以及冠状动脉和腹主动脉钙化积分总体比较差异均有统计学意义。治疗8周后,血钙、磷、PTH浓度及钙磷乘积A组高于B组和C组,B组高于C组;冠状动脉和腹主动脉钙化积分A组高于B组和C组,差异均有统计学意义。说明治疗8周后3组血磷浓度均较治疗前下降,其中小剂量骨化三醇联合碳酸司维拉姆降磷效果最好,碳酸钙D3降磷效果最差;而且碳酸钙D3还会增加血钙浓度,使钙磷乘积上升。钙磷乘积反映机体钙磷代谢程度,通常认为当钙磷乘积>40 mg2/dl2时血清钙和磷会以骨盐形式沉积于骨组织,并使得PTH分泌增多,1,25-二羟维生素D合成受抑制,加重心肌纤维化和血管钙化[25]。本研究结果说明维持性血液透析患者应用小剂量骨化三醇联合碳酸司维拉姆相较应用碳酸钙D3和碳酸司维拉姆降低血磷和PTH浓度效果好,且血钙浓度上升幅度最小,能够延缓血管钙化。
本研究结果还显示,治疗期间,3组药物不良反应发生均较少,仅A组4例、B组1例、C组1例出现恶心、呕吐、腹胀、消化不良和便秘等消化系统反应,且均症状轻微不影响治疗。说明3种磷结合剂用药方案用于维持性血液透析患者安全性均较好。
综上所述,维持性血液透析患者应用小剂量骨化三醇联合碳酸司维拉姆相较应用碳酸钙D3和碳酸司维拉姆降低血磷和PTH浓度效果好,且血钙上升幅度小,能够延缓血管钙化。
