基于乳腺X线图像不同区域的纹理分析鉴别乳腺肿块良恶性
2020-08-28高先聪黄栎有
高先聪,黄栎有
乳腺癌作为发病率最高的女性恶性肿瘤,近年来呈现出越来越年轻化的发病趋势,目前已成为我国45岁以下女性中死亡率最高的恶性肿瘤之一[1]。有研究表明尽早地发现和诊断可以有效提高乳腺癌患者的生存率。乳腺X线检查作为目前临床上应用最为广泛的乳腺癌筛查手段之一,具有检查费用低廉、对钙化点分辨力强等优点。但对于X线图像上表现为软组织结节、肿块的病灶,仅凭视觉主观分析很难准确鉴别其良、恶性,这也是目前临床影像诊断工作中的一个难点。
生物学异质性作为肿瘤的重要特征之一,可能与肿瘤内部血管密度不均匀、血流灌注、肿瘤细胞增殖和坏死等因素有关[2-3]。纹理分析通过提取肿瘤影像中的纹理特征参数进行定量分析,能够提供肉眼无法观察到的病灶内潜在信息,并间接反映病灶的异质性[4]。近年来纹理分析方法已经应用于脑、肺、肝脏、胰腺及乳腺等脏器的良恶性肿瘤的鉴别诊断[5-9]。Gatenby等[10]研究发现将病灶分为不同区域(如:核心和边缘)可以提高对病灶内纹理特征的显示效能。基于该研究的结果,我们试图在乳腺X线图像上将乳腺肿瘤划分为核心和边缘区,分析不同区域的纹理分析结果对鉴别乳腺肿块良恶性的价值。
材料与方法
1.研究对象
搜集2018年1月-2019年12月在本院行乳腺X线检查并经病理证实的108例患者(共计118个乳腺肿块)的病例资料。患者均为女性,年龄21~82岁,平均(50.4±12.4)岁。良性病变组(52例患者60个肿块):纤维腺瘤38例(46个),乳腺病14例(14个)。恶性病变组(56例患者共计58个肿块):浸润性导管癌51例(53个),导管内癌1例(1个),恶性分叶状瘤2例(2个),乳头状癌1例(1个),黏液腺癌1例(1个)。纳入标准:①有明确病理及临床诊断结果;②肿块内无明显钙化或坏死空洞;③肿块直径≤3 cm。
2.检查方法
使用HoLogic Inc Lorad公司Selenia型数字化乳腺X光机。摄影体位采用内外侧斜位(mediolateral oblique,MLO)和头尾位(cranial caudal,CC)。摄影条件:Auto Filter曝光模式,管电压25~30 kV,管电流75~95 mAs,图像尺寸24 cm×29 cm。
3.纹理分析方法
由2位分别具有7年和12年影像诊断经验的放射科医师对每例患者的MLO及CC图像进行比较,共同确定用于纹理分析的图像,选择完成后以bmp格式保存并导入MaZda软件中。由同一位乳腺X线诊断医师使用多边形ROI工具沿肿块外缘手动勾画其轮廓,得到每个肿块整体区域的ROI。然后,通过形态学操作侵蚀(Erosion),将肿块整体分割成两个不同区域:核心和边缘。目前对于病灶核心区和边缘区的分割方式并无统一标准,且以往基于断层图像的分割方法并不适用于乳腺X线图像。经过实验比较,我们最终规定侵蚀至肿块短径一半的区域为核心区域,然后将肿块整体区域减去核心区域得到环形的边缘区域(图1、2)。
在MaZda软件中选择μ±3σ选项对每帧图像进行灰度归一化处理来降低对比度和亮度对图像灰度值的影响。然后基于灰度共生矩阵(gray level co-occurrence matrix,GLCM)分别提取每个肿块的整体、核心及边缘三个不同区域的纹理特征。基于既往的相关研究结果[9,11-13],本研究中选择熵、总和熵、差异熵、对比度、相关度、和方差及差方差共6个纹理参数作为分析指标(表1)。

表1 各项纹理参数的意义
4.乳腺X线诊断
由本院影像科医师对每帧乳腺X线片出具诊断报告,对病变进行BI-RADS分级,其中0~4A类归为良性组,4B~6类为恶性组。
5.统计学分析
使用SPSS 22.0统计分析软件进行数据分析。首先,对每组中各项纹理特征的数据进行正态性检验,符合正态分布的数据以 表示,采用独立样本t检验进行组间比较;不符合正态分布的数据以中位数(上、下四分位数)表示,采用Mann-WhitneyU检验进行组间比较。每个纹理特征的计算取其水平、垂直、45°及135°共4个方向上的平均值,共生矩阵参数的像素间距(d)设定为1个像素。
利用受试者工作特性(receiver operation characteristic,ROC)曲线对组间差异有统计学意义的纹理特征的诊断效能进行评估,使用MedCalc.软件对比各项参数的ROC曲线下面积(area under the curve,AUC)的差异。采用二元logistic回归向后Wald步进法建立多参数联合诊断模型,并进一步分析其对乳腺病变良恶性的预测概率。以P<0.05为差异有统计学意义。
结 果
1.乳腺X线片诊断结果
良性组60个肿块中,X线诊断结果为良性者52个,恶性者8个;恶性组58个肿块中,X线诊断结果为恶性者44个,良性者14个。乳腺X线诊断的ROC曲线下面积(AUC)为0.813(图3),95%CI:0.731~0.904,检出恶性病变的敏感度和特异度分别为75.86%和86.67%。
2.不同区域纹理特征的分析结果
两组中肿块不同区域的纹理特征及组间比较结果见表2~4。整体区域和边缘区的相关性、对比度、差方差、总和熵、熵和差异熵之间的差异均具有统计学意义(P<0.05);而两组间核心区所有纹理特征的差异均无统计学意义(P>0.05)。对组间差异有统计学意义的纹理特征,建立ROC曲线并判定其诊断效能,结果见表3。AUC≥0.7的纹理特征有整体区域中的总和熵、熵,以及边缘区域的对比度、总和熵、熵和差异熵。边缘区域的纹理特征的诊断效能略高于整体区域,其中以边缘区域的总和熵的诊断效能最高,AUC值为0.756。
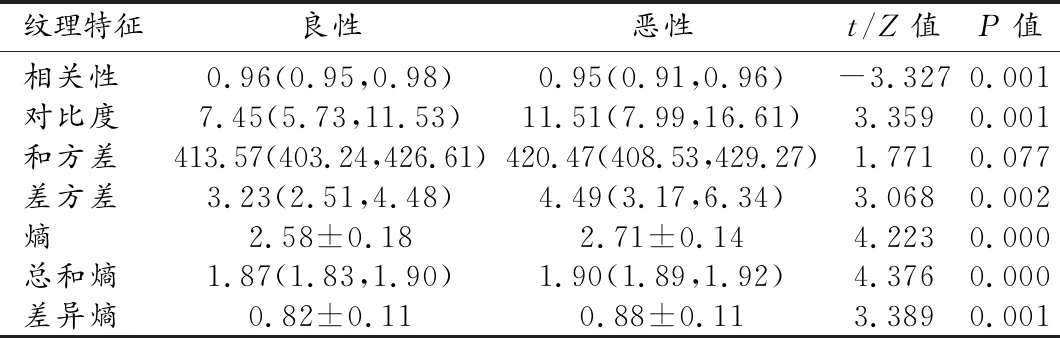
表2 两组肿块整体区域纹理特征的比较
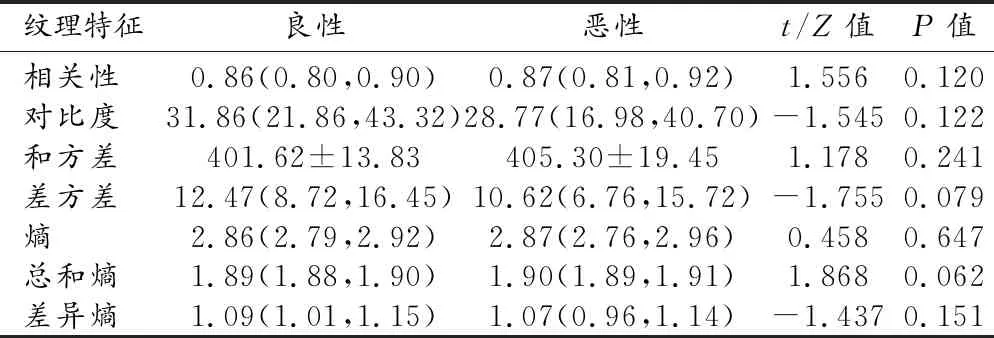
表3 两组肿块核心区域纹理特征的比较
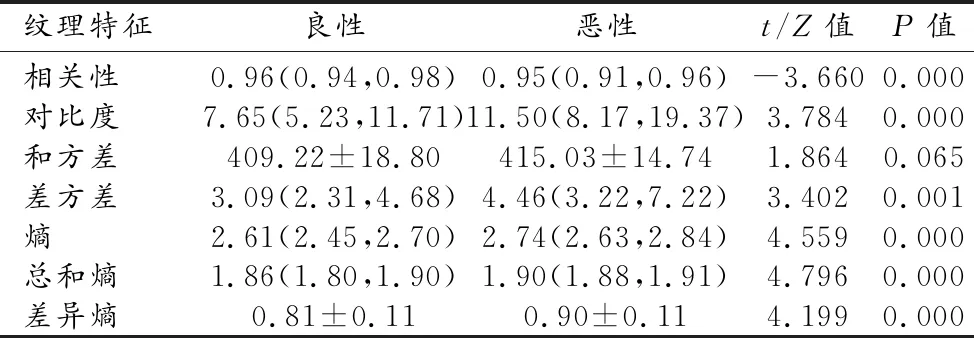
表4 两组肿块边缘区域纹理特征的比较
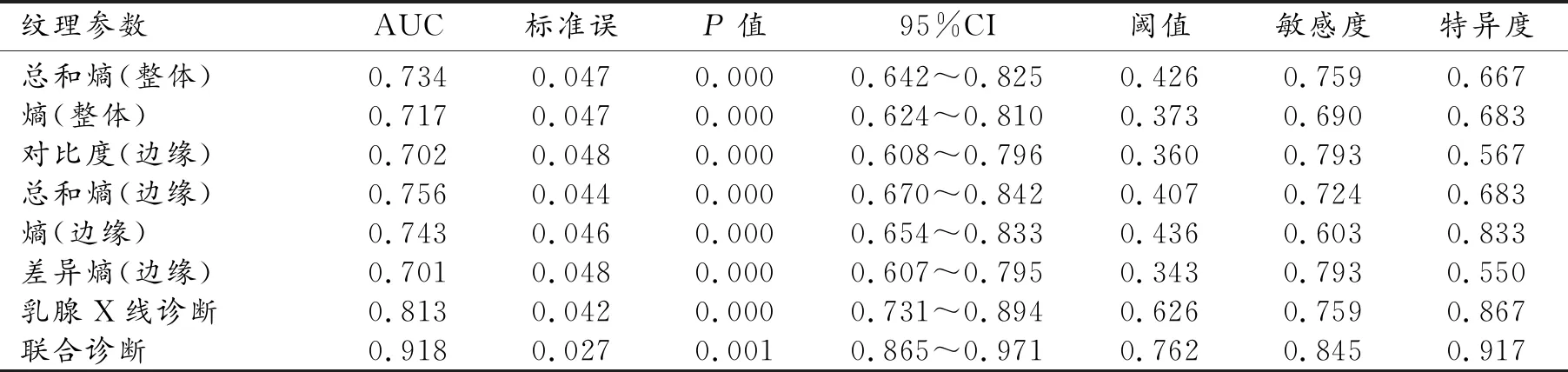
表5 各项纹理参数鉴别乳腺肿块良恶性的诊断效能
3.纹理分析联合乳腺X线的诊断结果
将组间差异有统计学意义的纹理特征及乳腺X诊断结果(良性赋值0,恶性赋值1)纳入二元logistic回归分析,最终建立的联合诊断模型为Logit(P)=31.832×总和熵(边缘)-4.19×X线诊断结果-57.057。联合诊断模型的AUC为0.918,阈值为0.762,敏感度和特异度分别为84.5%和91.7%(表5、图3)。对比单纯乳腺X线诊断,联合诊断的诊断效能(AUC)更高(P<0.05),敏感度和特异度均高于常规乳腺X线诊断,但差异均无统计学意义(χ2=1.36,P>0.05;χ2=0.78,P>0.05)。
讨 论
纹理分析可以检测图像中每个像素的细微分布和联系,在临床应用过程中能最大程度地获取图像上不同类型的信息,从而能客观、定量地评估病灶的异质性。近年来,利用纹理分析来鉴别病灶良恶性的研究越来越多。Dennie等[9]的研究结果显示熵、方差及平方和这3项纹理参数可以有效区分肺癌与肉芽肿性炎症。 任继亮等[14]利用纹理分析鉴别眼眶淋巴瘤与炎性假瘤,结果显示两者的熵值有明显差异(P<0.05)。彭文静等[15]对乳腺钼靶图像进行纹理分析,发现标准差、不均匀度和熵可有效区分良、恶性乳腺小结节。然而,目前大部分研究都是对整个病灶进行纹理分析,将病灶划分成不同区域进行纹理分析的研究还很少。
本研究基于乳腺X线图像,分析肿块不同区域纹理特征对乳腺肿块良恶性的鉴别价值,结果显示良恶性组间病灶整体区域的总和熵、熵、差异熵、差方差、相关度和对比度的差异均有统计学意义(P<0.05),与既往的研究结果相符。其中,恶性组中病灶的相关度显著低于良性组,表明恶性肿块的纹理更不规则;恶性组的对比度、差方差、总和熵、熵以及差异熵均显著高于良性组,说明恶性肿块的结构更混乱,纹理更为复杂。进一步研究显示,两组肿块间核心区域的纹理特征并无明显差异,而边缘区域具有显著差异的纹理特征与整体区域一致。且相较于整体区域,边缘区域的纹理特征显示出更好的诊断效能。以上结果提示两组肿块之间的纹理特征差异主要源于肿块的边缘区域。造成此结果的确切原因尚不确定,推测可能是由于恶性肿块内的异质性并不均匀,肿块边缘区域异质性更高所致。Biesaga等[16]研究发现恶性肿瘤的新生微血管生长活跃并多集中在肿瘤边缘,而核心区血管化不良。其研究结果也支持上述推测。
熵相关的纹理特征反映了肿块内像素分布的随机混杂程度。已有研究证实熵能够较好地反映病灶内的异质性[17-18]。本研究中,整体区域的总和熵、熵及边缘区域的总和熵、熵和差异熵均显示出了良好的诊断效能(AUC≥0.7),与既往研究结果相符。其中边缘区域的总和熵的诊断效能最高,AUC为0.756,相应的敏感度、特异度分别为72.4%和68.3%。经Logistic回归分析,在所有纹理特征中仅边缘区域的总和熵被纳入了联合诊断模型,提示其可能是鉴别乳腺肿块良恶性的最佳纹理指标。此外,相较于单纯乳腺X线诊断,联合诊断模型的诊断效能显著提高,敏感度和特异度也有所提升。表明纹理分析可以有效地帮助影像医师提高对乳腺肿块定性诊断的准确性。
本研究的局限性:①基于乳腺X线影像进行纹理分析,无法反映肿块的三维空间的纹理差异;②ROI为人工勾画,纹理分析结果可能会受到主观因素的影响。③由于某些病理类型肿瘤的样本量较小,未对不同病理类型乳腺肿瘤之间的纹理特征的差异进行研究。④为回顾性单中心分析,样本选择可能存在一定偏倚。
综上所述,对乳腺X线图像上肿块整体和边缘区域进行纹理分析,可以有效提高对乳腺肿块良恶性的鉴别诊断准确性,为临床诊断提供客观和可靠依据。
