miR-136调控FDZ4通过WNT信号通路抑制非小细胞肺癌的增殖和诱导凋亡
2020-08-27谢五菊王成存吴文汉
谢五菊 王成存 吴文汉
(海南西部中心医院呼吸内科,海南 儋州 571700)
非小细胞肺癌是肺癌的主要病理分型,其具有恶性程度高及远处转移等特点,但关于非小细胞肺癌的靶向治疗仍为目前临床治疗难点〔1〕。研究表明,非小细胞肺癌早期检测方法的缺乏是导致患者生存率降低的主要原因〔2〕。因此深入研究非小细胞肺癌发生及发展的过程对早期诊断及治疗方案的制定均具有重要意义。研究表明,微小RNA-136(miR-136)在非小细胞肺癌中呈低表达,过表达miR-136可抑制肺癌细胞增殖及迁移〔3,4〕。相关研究报道指出,miR-136可通过靶向星形胶质细胞上调基因(aEg)1和Bcl-2进而诱导胃癌细胞凋亡〔5〕。但miR-136对非小细胞肺癌细胞增殖及凋亡的研究未见报道。通过生物学信息手段检测miR-136的靶基因发现FZD4可能是miR-136的靶基因,研究表明FZD4在非小细胞肺癌组织中上调表达,并可通过Wnt/β-连环蛋白(catenin)信号通路调控肺癌细胞迁移和侵袭及EMT的发生〔6,7〕。然而,有关miR-136与FZD4在非小细胞肺癌中的研究相对较少,本研究旨在探讨miR-136在非小细胞肺癌细胞增殖及凋亡过程中的作用及其可能的作用机制。
1 材料与方法
1.1材料与试剂 人正常肺上皮细胞株BEAS-2B与人肺癌细胞株H1299、A549、SPC-A-1、NC-H446均购自中国科学院上海生命科学研究院细胞资源中心。Lipofectamine2000转染试剂购自美国Invitrogen公司;miR-136 mimic、miR-con均购自美国Ambion公司;胎牛血清与RPMI1640培养基均购自美国Gibco公司;四甲基偶氮唑蓝(MTT)试剂盒购自美国Sigma公司;Annexin V-FITC/PI细胞凋亡检测试剂盒购自南京凯基生物科技公司;FDZ4抗体与β-actin抗体均购自美国Epigentek公司;Trizol试剂购自美国Ambion公司;实时荧光定量PCR试剂盒购自美国Kapa公司;RNA反转录试剂盒购自美国GeneCopoeia公司;荧光素酶报告载体与荧光素酶活性检测试剂盒均购自美国Promega公司;十二烷基硫酸钠(SDS)购自美国Amresco公司;细胞周期蛋白依赖性激酶(CDK)4抗体购自美国CST公司;细胞周期蛋白(Cyclin)D1抗体购自美国Santa Cruz公司;兔抗含半胱氨酸的天冬氨酸蛋白水解酶(Caspase)-9、Bax、Bcl-2抗体均购自美国Epitomics公司;兔抗糖原合成酶激酶(GSK)-3β、β-catenin、c-Myc抗体均购自美国Cell Signaling Technology公司;核蛋白提取试剂盒购自美国ThermoFisher公司。
1.2细胞培养、转染及分组 人正常肺上皮细胞株BEAS-2B与人肺癌细胞株H1299、A549、SPC-A-1、NC-H446放入含有10%胎牛血清的RPMI1640培养液中,置于37℃恒温培养箱进行培养,待细胞生长融合度达到70%左右时进行传代培养。收集对数生长期SPC-A-1细胞,用胰蛋白酶消化细胞后调整细胞浓度为5×104个细胞/ml,以每孔2 ml体积的细胞接种于6孔板,置于37℃恒温培养箱培养至细胞融合度达50%左右时进行转染,转染时分别将miR-136 mimic、miR-con、anti-miR-NC、anti-miR-136转染于SPC-A-1细胞中,为明确miR-136与FDZ4的调控作用及其对SPC-A-1细胞增殖及凋亡的影响,将miR-136 mimic分别与pcDNA-FDZ4、pcDNA共转染于SPC-A-1细胞,分别为miR-136+pcDNA-FDZ4组、miR-136+pcDNA组。转染步骤:①根据Lipofectamine2000试剂盒说明书配置Lipofectamine2000与转染质粒的复合体混合液;②不含血清培养液洗涤待转染细胞并加入1 ml不含胎牛血清的RPMI1640培养基;③复合体混合液加入6孔板;④转染6 h后更换含有10%胎牛血清的RPMI 1640培养基,放入恒温培养箱继续培养48 h收集细胞。
1.3qRT-PCR检测细胞中miR-136、FDZ4 mRNA表达水平 分别收集BEAS-2B、H1299、A549、SPC-A-1、NC-H446与转染后各组SPC-A-1细胞,用Trizol试剂提取细胞总RNA,反转录合成cDNA,qRT-PCR扩增反应:配置反应体系与实时荧光定量PCR仪检测。反应体系为20 μl:SYBR Premix Ex Taq Ⅱ(2×)10 μl,cDNA 2 μl,上下游引物各0.6 μl,灭菌ddH2O 6.8 μl。PCR仪扩增程序:95℃ 3 min,95℃ 15 s,60℃ 30 s,72℃ 30 s,共40次循环。miR-136以U6为内参,FDZ4 以β-actin为内参,采用2-ΔΔCt法计算不同细胞中检测miR-136、FDZ4 mRNA的相对表达量。
1.4Western印迹检测FDZ4、CDK4、CyclinD1、Caspase-9、Bax、Bcl-2及WNT信号通路相关蛋白表达 分别收集各组细胞分别加入蛋白裂解液( 1 ml RIPA、1% PMSF、0.1% 抑肽酶)提取细胞总蛋白,另收集miR-136+pcDNA组、miR-136+pcDNA-FDZ4组SPC-A-1细胞加入核蛋白提取试剂提取细胞核总蛋白以检测细胞核内β-catenin蛋白表达,其余蛋白表达检测均选用细胞总蛋白。分别检测蛋白浓度后取等量蛋白样品进行SDS-聚丙烯酰胺凝胶电泳(PAGE)反应分离蛋白,将蛋白凝胶移至聚偏氟乙烯(PVDF)膜,用5%脱脂牛奶封闭1 h,分别加入一抗,4℃孵育24 h,TBST洗涤3次×10 min,加入二抗,室温孵育1 h,TBST洗涤3次×10 min,滴加ECL发光剂,凝胶成像分析仪检测各蛋白条带并用Image图像分析软件分析条带灰度值。
1.5MTT法检测细胞增殖 分别收集各组细胞,胰蛋白酶消化细胞后以每孔5×103个细胞接种至96孔板,每个样本均设置6个复孔,置于培养箱中培养24、48、72、96 h时在每孔加入20 μl MTT试剂,培养4 h后每孔加入150 μl二甲基亚砜(DMSO),振荡10 min后选择波长为490 nm在酶标仪上检测各孔光密度(OD)值。
1.6流式细胞术检测细胞凋亡 收集各组SPC-A-1细胞,待细胞融合度达80%左右时用磷酸盐缓冲液(PBS)洗涤细胞,1 000 r/min离心10 min,取1×106个细胞加入结合缓冲液悬浮细胞(100 μl),依次加入5 μl Annexin V-FITC与5 μl PI,混匀后避光孵育10 min,流式细胞仪检测各组SPC-A-1细胞凋亡率。
1.7双荧光素酶报告基因实验 用生物学信息学方法预测miR-136的潜在靶标,FDZ4 3′UTR与miR-136存在结合位点,将含有FDZ4 3′UTR野生序列片段(WT-FDZ4)与FDZ4 3′UTR突变序列(MUT-FDZ4)分别插入荧光素酶报告基因载体,转染前1 d收集SPC-A-1细胞,以每孔5×105个细胞的密度接种至24孔板,将WT-FDZ4、MUT-FDZ4分别与miR-136 mimic或阴性对照共转染至SPC-A-1细胞,转染48 h后根据双荧光素酶活性检测试剂盒测定细胞相对荧光素酶活性。
1.8统计学处理 采用SPSS19.0统计学软件进行t检验、单因素方差分析。
2 结 果
2.1miR-136和FDZ4在人肺癌细胞和人正常肺上皮细胞中的表达 qRT-PCR结果显示,与BEAS-2B细胞比较,miR-136在H1299、A549、SPC-A-1、NC-H446细胞中的表达均明显下调(P<0.05),其中以SPC-A-1细胞下调最为明显,而FDZ4 mRNA及蛋白表达水平均明显升高(P<0.05),其中以SPC-A-1细胞上调最为明显,见图1、表1。本研究选取SPC-A-1细胞进行后续实验。

表1 miR-136和FDZ4在人正常肺上皮细胞株BEAS-2B和人肺癌细胞株H1299、A549、SPC-A-1、NC-H446中的表达
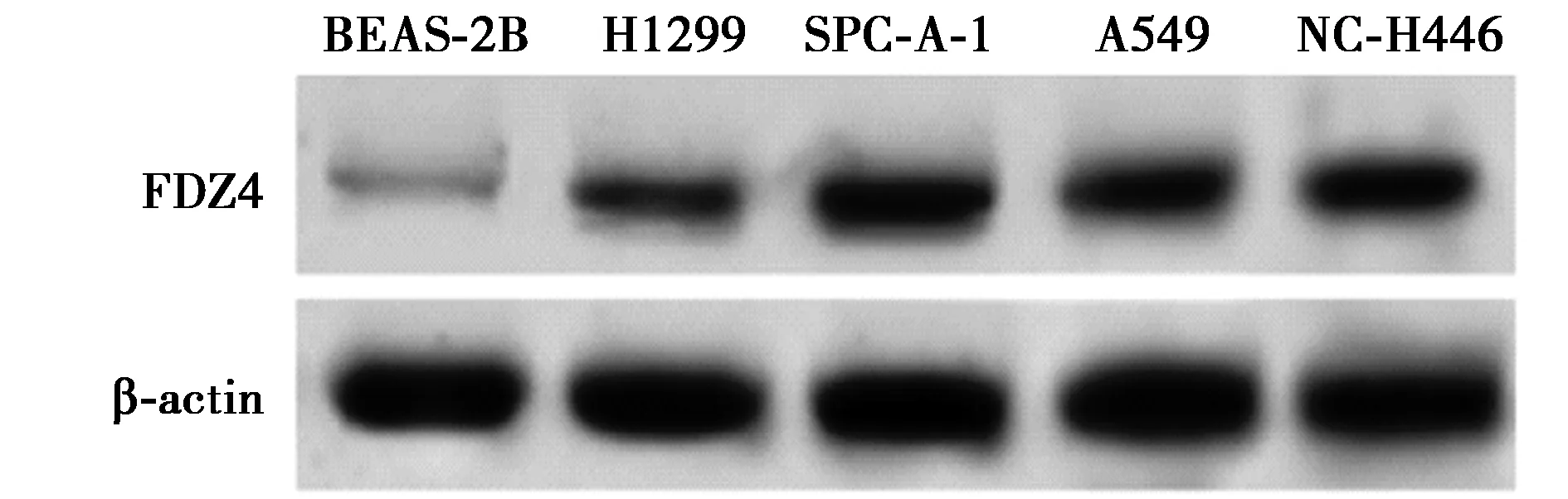
图1 检测FDZ4蛋白表达
2.2上调 miR-136表达对人肺癌细胞株SPC-A-1增殖的影响 qRT-PCR结果显示,与miR-con组比较,miR-136组SPC-A-1细胞中miR-136表达水平明显上调(P<0.05),而NC组差异无统计学意义(P>0.05)。MTT结果显示,miR-136组SPC-A-1细胞增殖能力在48、72、96 h后明显受到抑制,与miR-con组比较差异均有统计学意义(均P<0.05)。Western印迹结果显示,miR-136组CDK4、CyclinD1蛋白表达水平较miR-con组明显降低(P<0.05),见图2、表2。
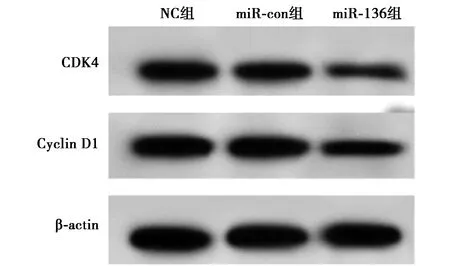
图2 检测人肺癌细胞株SPC-A-1增殖相关蛋白CDK4和Cyclin D1表达

表2 上调miR-136表达对结肠癌细胞增殖的影响
2.3上调miR-136表达对人肺癌细胞株SPC-A-1凋亡的影响 miR-136组SPC-A-1细胞凋亡率显著高于miR-con组、NC组(P<0.05)。Western印迹结果显示,相较于miR-con组,miR-136组SPC-A-1细胞中Caspase-9、Bax蛋白表达显著升高(P<0.05),而Bcl-2蛋白表达显著降低(P<0.05),见图3,图4,表3。
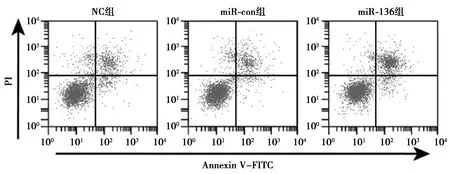
图3 人肺癌细胞株SPC-A-1凋亡率
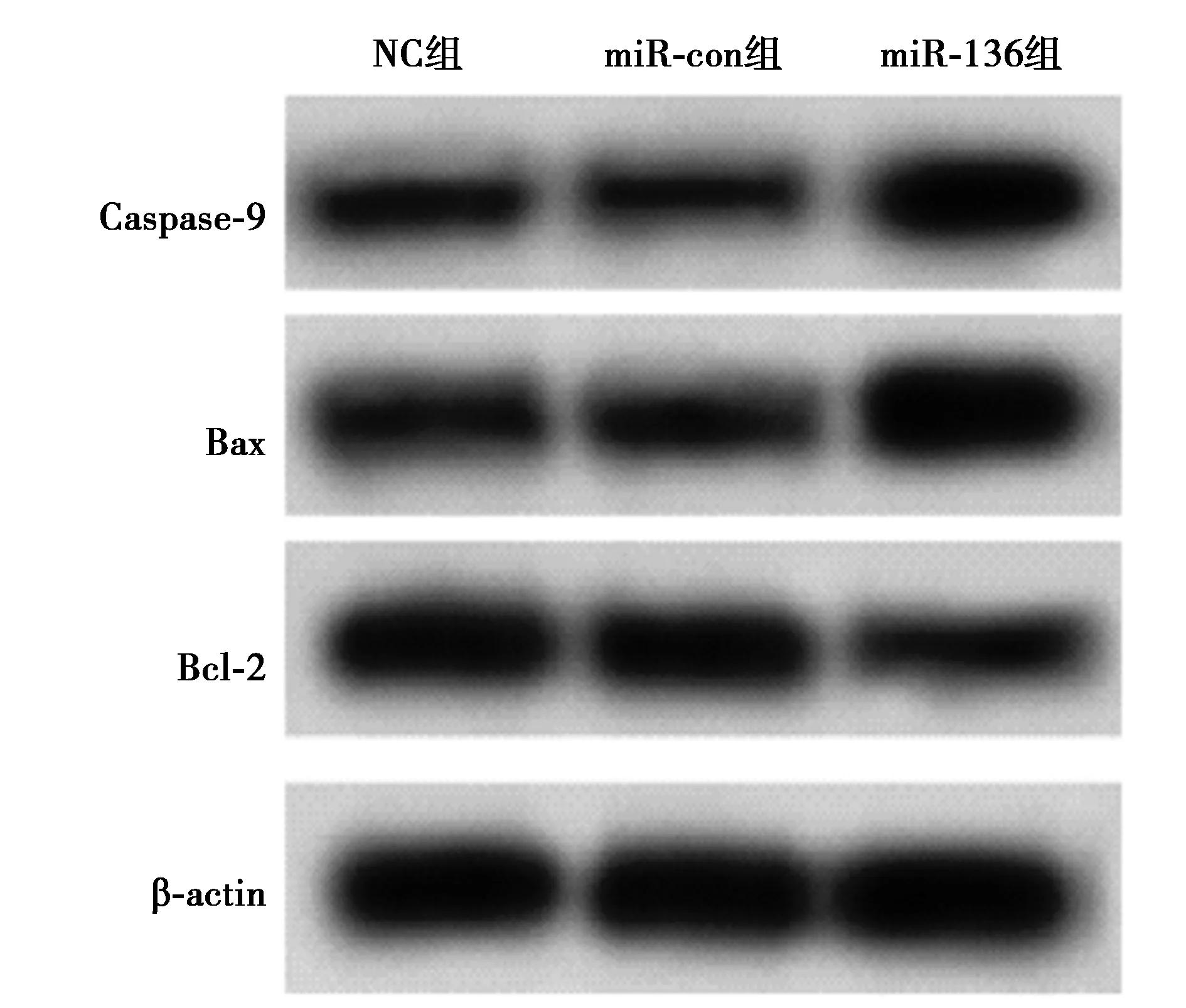
图4 Western印迹检测细胞凋亡蛋白表达

表3 上调miR-136表达对人肺癌细胞株SPC-A-1凋亡的影响
2.4miR-136靶向调控FDZ4蛋白表达 FDZ4与miR-136存在结合靶点,见图5。双荧光素酶报告基因实验结果显示,转染miR-136 mimic可显著降低WT-FDZ4的荧光素酶活性(P<0.05),而不能抑制MUT-FDZ4的荧光素酶活性(P>0.05),见表4。Western印迹结果显示,miR-136组FDZ4蛋白表达(0.28±0.04)显著低于miR-con组(0.67±0.06,P<0.05),anti-miR-136组(0.88±0.09)显著高于anti-miR-con组(0.62±0.07,P<0.05),见图6。
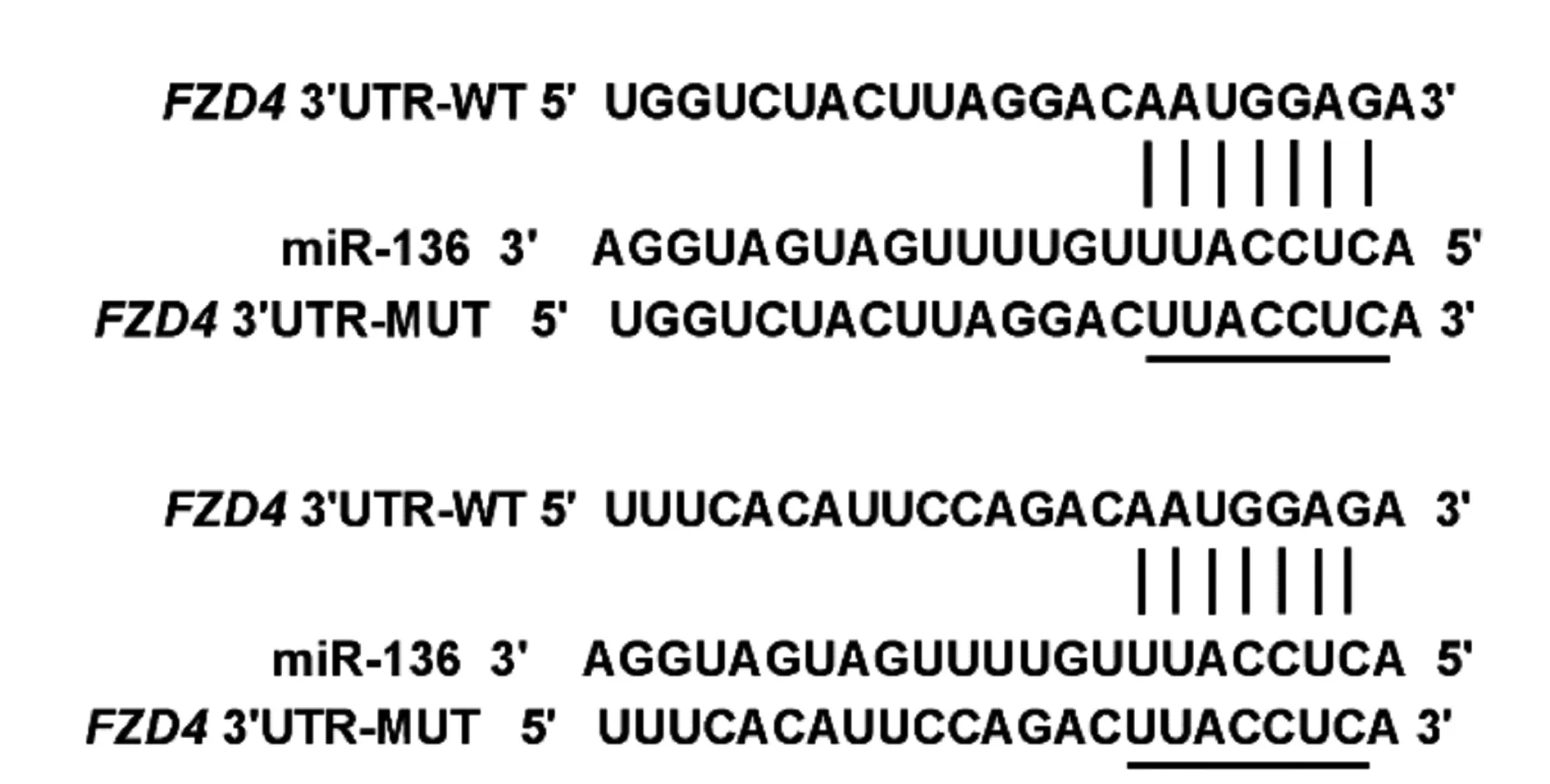
图5 FDZ4的3′UTR中含有与miR-136互补的核苷酸序列

图6 Western印迹检测miR-136对FDZ4蛋白表达的影响

表4 双荧光素酶报告实验
2.5FDZ4过表达逆转了上调miR-136抑制人肺癌细胞株SPC-A-1增殖和诱导凋亡的作用 MTT结果显示,与miR-136+pcDNA组比较,miR-136+pcDNA-FDZ4组SPC-A-1细胞增殖活性在48、72、96 h明显增强(P<0.05)。流式细胞仪检测结果显示,miR-136+pcDNA-FDZ4组SPC-A-1细胞凋亡率明显低于miR-136+pcDNA组(P<0.05),Western印迹检测结果显示,共转染miR-136 mimic与pcDNA-FDZ4后SPC-A-1细胞中CyclinD1蛋白表达明显上调(P<0.05),而Caspase-9蛋白表达明显下调(P<0.05),见表5、图7。

表5 FDZ4过表达逆转了上调miR-136抑制人肺癌细胞株SPC-A-1增殖和诱导凋亡的作用

图7 人肺癌细胞株SPC-A-1中FDZ4、CyclinD1和Caspase-9蛋白表达
2.6miR-136和FDZ4的表达对人肺癌细胞株SPC-A-1中WNT信号通路的影响 Western印迹结果显示,SPC-A-1细胞转染miR-136 mimic后GSK-3β蛋白表达水平明显升高(P<0.05),而β-catenin、c-Myc蛋白表达水平明显降低(P<0.05),共转染miR-136 mimic与pcDNA-FDZ4后SPC-A-1细胞中GSK-3β蛋白表达水平显著降低(P<0.05),而β-catenin、c-Myc蛋白表达水平均明显升高(P<0.05),见表6、图8。
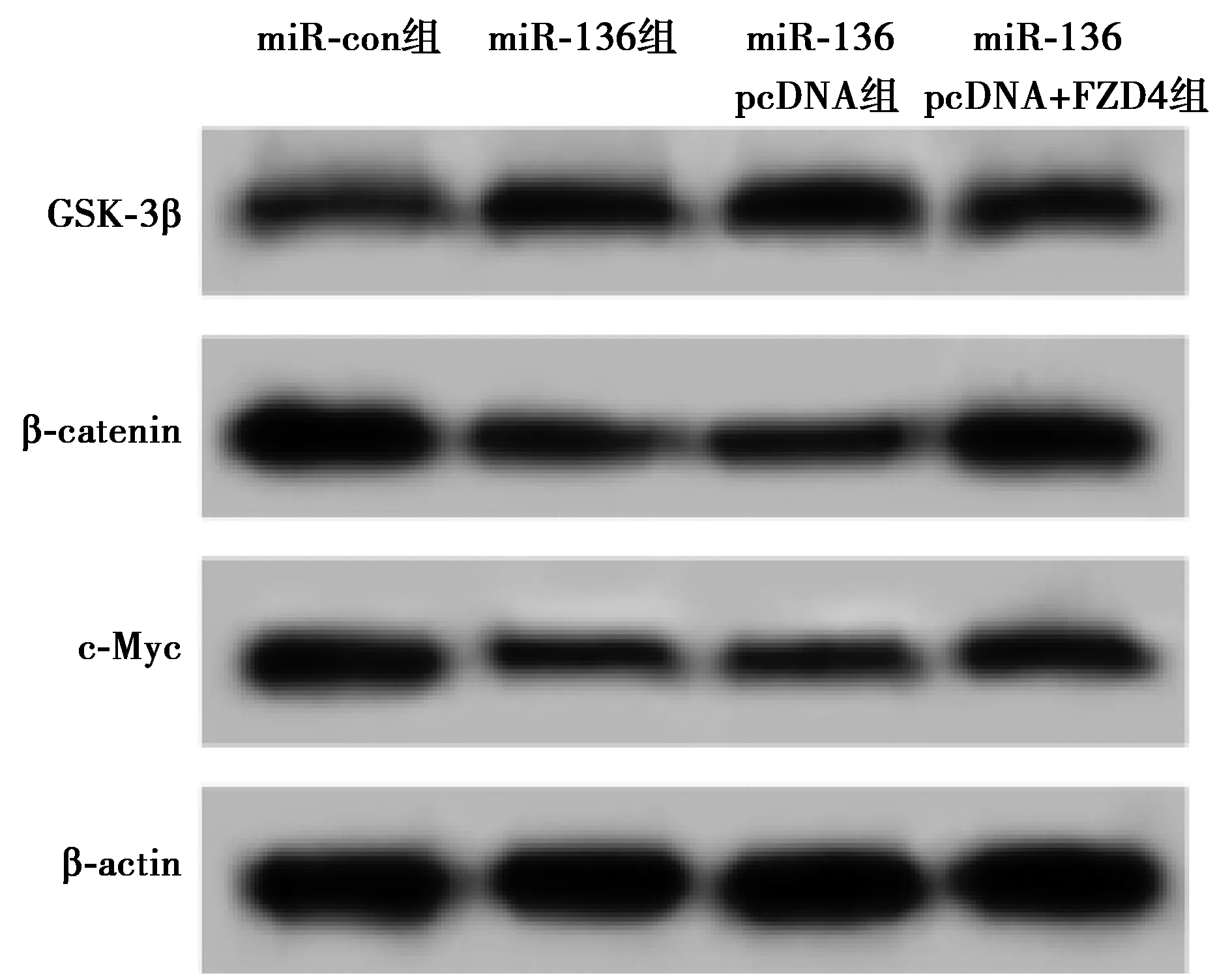
图8 检测人肺癌细胞株SPC-A-1中β-catenin、GSK-3β和c-Myc蛋白表达

表6 FDZ4过表达逆转了上调miR-136对人肺癌细胞株SPC-A-1WNT信号通路的作用
3 讨 论
非小细胞肺癌是常见的恶性肿瘤之一,由于早期患者临床症状隐匿导致确诊时已处于中晚期,目前采用手术治疗晚期患者,但治疗效果不佳且患者预后较差〔8〕。因而关于非小细胞肺癌新型生物标志物机制新型治疗靶点的探究成为热点。研究表明miRNA可调控细胞生长发育及增殖、迁移等生物学过程〔9〕。相关研究发现miR-106可通过调节靶基因表达进而影响非小细胞肺癌细胞增殖及凋亡过程〔10〕。但关于miRNA与非小细胞肺癌发生及发展的研究仍相对较少,因此积极寻找新型miRNA有助于临床早期诊断及治疗。
miR-136在乳腺癌、肺鳞癌等多种恶性肿瘤中均呈低表达,并可通过调控下游靶基因表达进而参与肿瘤发生及发展过程〔11,12〕。Guo等〔13〕研究表明,miR-136可通过调节metadherin表达进而抑制骨肉瘤发生及发展。miR-136还可通过靶向环氧合酶2进而抑制肝细胞癌细胞的恶性进展〔14〕。研究表明抗癌药物的研究多以调控细胞周期相关因子为治疗靶点,Cyclin D1作为细胞周期的启动因子可与CDK4结合进而促进细胞周期由G1期转化为S期从而促进细胞增殖〔15,16〕。提示miR-136过表达后主要通过下调CDK4、Cyclin D1水平影响细胞周期转变为S期而诱导细胞周期停滞于G1期进而抑制非小细胞肺癌细胞增殖。本研究结果表明SPC-A-1细胞中上调miR-136表达可增加细胞凋亡率。研究表明,通过抑制Caspase-9、Bax表达及促进Bcl-2表达可有效促进细胞凋亡〔17〕。提示miR-136可通过影响细胞增殖及凋亡蛋白表达进而参与非小细胞肺癌发生及发展过程。
FDZ4在胶质瘤细胞中呈高表达并可促进胶质瘤细胞增殖及侵袭〔18〕。研究报道,FDZ4可作为癌基因并通过调控WNT信号通路进而促进前列腺癌细胞发生上皮-间质转化〔19〕。本研究结果显示不同非小细胞肺癌细胞中FDZ4表达水平均显著升高,双荧光素酶报告基因实验结果发现FDZ4是miR-136的靶基因,本研究结果提示miR-136可靶向抑制FDZ4表达并通过影响细胞增殖及凋亡蛋白表达进而促进非小细胞肺癌凋亡并减弱细胞增殖能力。WNT信号通路异常激活可促进肺癌细胞增殖并抑制细胞凋亡,如何抑制WNT信号通路激活进程成为非小细胞肺癌治疗的重要辅助治疗手段〔20,21〕。GSK-3β是WNT信号通路的负性调控因子,而β-catenin是WNT信号通路的正性调控因子,研究表明GSK-3β可通过与β-catenin结合进而促使其降解导致细胞内β-catenin水平降低,若WNT信号通路异常激活导致GSK-3β水平降低,细胞质内β-catenin未被及时降解导致其进入细胞核,促进下游c-Myc等靶基因表达进而促进肿瘤发生及发展〔22,23〕。本研究结果表明上调miR-136可抑制WNT信号通路活化,但上调FDZ4表达可激活WNT信号通路。提示miR-136可靶向调节FDZ4表达并通过抑制WNT信号通路而影响细胞增殖相关因子表达进而参与非小细胞肺癌发生及发展过程。
综上,miR-136在非小细胞肺癌细胞中表达下调,而FDZ4表达上调,miR-136可通过下调FDZ4抑制非小细胞肺癌细胞增殖并诱导细胞凋亡,其可能通过抑制WNT信号通路而发挥作用,可为非小细胞肺癌靶向治疗提供理论依据。
