糜子幼胚愈伤组织的诱导及植株再生
2020-08-27吴会琴黄梦迪刘蓓蓓高小丽
吴会琴,王 娜,黄梦迪,刘蓓蓓,杨 璞,高小丽
(西北农林科技大学 农学院/旱区作物逆境生物学国家重点实验室,陕西杨凌 712100)
糜子(PanicummiliaceumL.)是禾本科最古老的1a生草本作物之一[1]。因其生育期短,抗旱能力强,是中国重要的抢险救灾作物,并被广泛用作储备作物和动物饲料[2]。糜子主要分布在中国的陕西、山西、甘肃、宁夏、内蒙等干旱半干旱地区[3],是当地重要的粮食作物和经济作物。糜子富含蛋白质和矿质营养元素,是现代健康功能食品开发的重要资源[4]。但因品种和生态环境等因素的限制,糜子的产量相对较低,在一定程度上限制了糜子产业的发展,所以,提高产量和改善品质已然是糜子育种工作的重要目标[5]。
近年来,随着生物技术的发展,通过组织培养和基因工程等手段定向改良品种已成为作物研究的一个重要方向,而通过生物技术途径进行遗传改良的首要环节就是建立稳定高效的离体培养体系。目前,已经有很多关于小麦[6]、玉米[7]、水稻[8]、高粱[9]等禾谷类作物再生体系建立的报道,其中,幼胚为应用较多且较为理想的外植体之一,并且通过幼胚诱导愈伤组织并获得再生植株,从而进行遗传转化等相关工作。但目前有关糜子再生技术体系的研究仍处于探索阶段,尚不能满足种质改良和遗传育种工作的需求。因此,本试验以‘陕糜1号’和‘陕糜2号’2种糜子的幼胚作为外植体材料,旨在通过筛选适宜糜子幼胚诱导分化的培养基及激素,建立并优化糜子幼胚愈伤组织诱导及植株再生体系,以期为糜子高效育种和遗传改良等研究奠定理论和技术基础。
1 材料与方法
1.1 试验材料
以糯性糜子品种‘陕糜1号’和粳性糜子品种‘陕糜2号’为试验材料,均由西北农林科技大学农学院小杂粮课题组提供。
1.2 试验所用培养基
如表1所示,2,4-D(2,4-二氯苯氧乙酸,2,4-Dichlorophenoxyacetic acid)、KT(激动素,Kinetin),所有培养基均添加30 g/L蔗糖和7 g/L琼脂,pH均为5.8,121 ℃高温高压灭菌20 min, 备用。
1.3 试验方法
1.3.1 外植体的培养 糜子开花后8~10 d,于每天9:00-10:00,剪下穗子,插入自来水中,用冰盒带回。置于4 ℃冰箱内对穗子进行低温预处理培养,处理时间分别为1(CK)、2、3、4、5、6、7 d,接种前将穗子在自来水下冲洗10 min,然后在超净工作台中用体积分数为75%的乙醇和质量分数为20%的次氯酸钠溶液分别消毒2 min、15 min,然后用无菌水冲洗3次,将穗子置于无菌滤纸上吸干水分,备用。
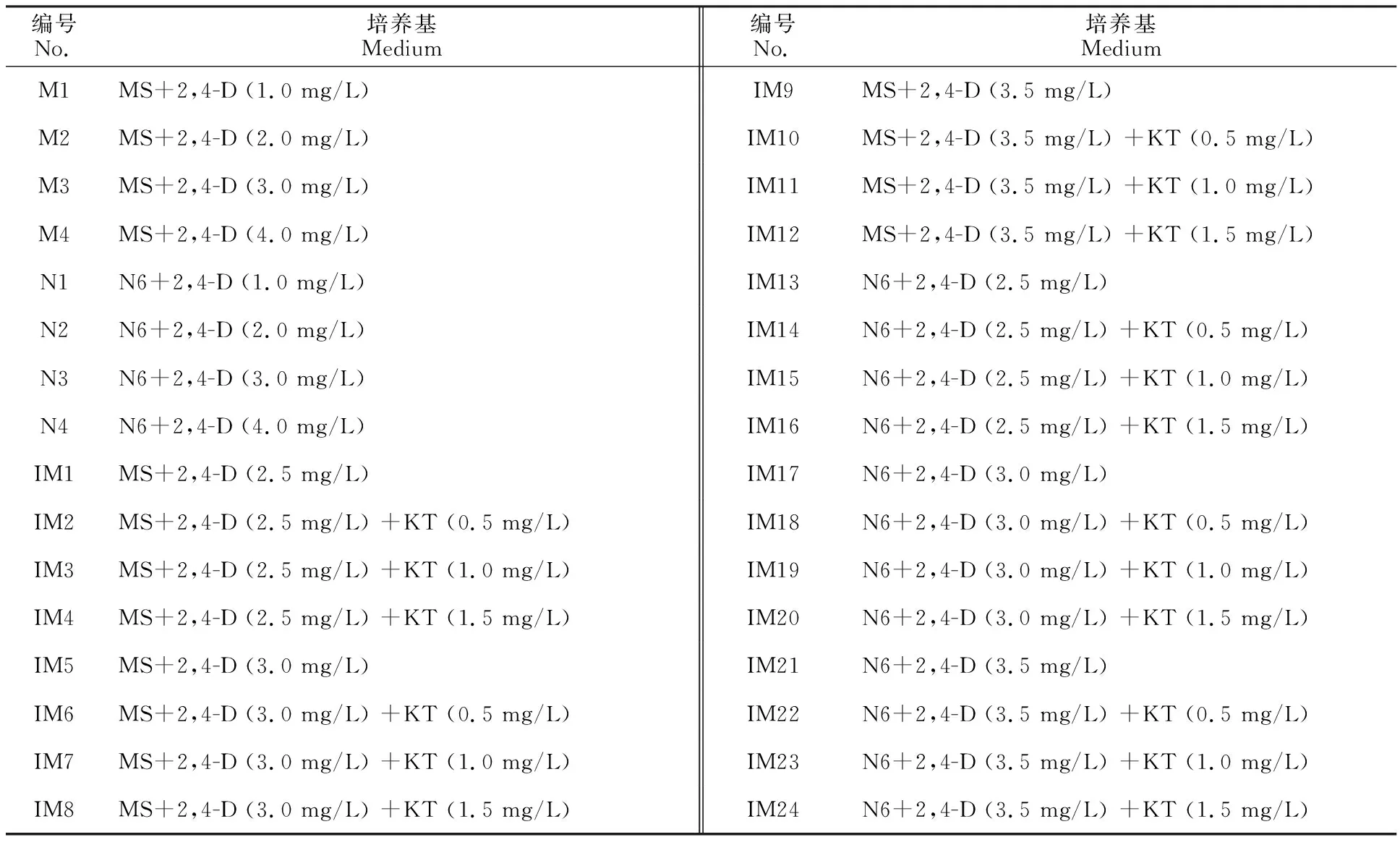
表1 诱导培养基种类Table 1 Types of induction medium
1.3.2 愈伤组织的诱导 在超净工作台中用镊子剥去穗子外壳,将里面的白色半透明幼胚接种在诱导培养基上,每个三角瓶中接种20粒幼胚。 (27±1) ℃黑暗条件下诱导培养,期间注意观察,及时清理污染样品。14 d后继代1次,21 d后统计糜子幼胚的愈伤组织诱导率。各试验处理重复3次。
1.3.3 愈伤组织的分化 将生长良好的愈伤组织转接到愈伤组织分化培养基上,每个三角瓶接种5块愈伤组织。分化培养基为MS培养基中添加1.0 mg/L 6-BA(6-苄氨基腺嘌呤,6-Benzylaminopurine)和不同质量浓度的NAA(萘乙酸,1-Naphthaleneacetic acid)(0、0.1、0.5 mg/L),在(30±1) ℃下16 h/8 h(亮/暗)散光培养。21 d后统计绿点率和出芽率(芽长1 cm视为出芽,小于1 cm视为出现绿点),每2周更换1次培养基。
1.3.4 生根培养及炼苗移栽 待到幼苗长到3 cm左右的时候,将其转接到生根培养基中进行生根培养,生根培养基为1/2MS+NAA(0.1 mg/L),(27±1) ℃黑暗培养14 d后打开三角瓶口,炼苗2~3 d后将其移入盛有基质的花盆里。
1.4 数据分析与统计
采用Microsoft Excel 2010和SPSS 16.0对数据进行处理和比较分析。
愈伤组织诱导率=(产生愈伤组织的外植体数/接种的外植体总数)×100%
绿点率=(产生绿点的愈伤组织块数/接种的愈伤组织总块数)×100%
出芽率=(产生芽的愈伤组织块数/接种的愈伤组织总块数)×100%
2 结果与分析
2.1 不同低温预处理时间对糜子幼胚愈伤组织诱导的影响
由图1可知,适当的4 ℃低温预处理有助于糜子幼胚诱导产生愈伤组织,经过3 d低温预处理,‘陕糜1号’和‘陕糜2号’幼胚愈伤组织诱导率均达到最高,分别为60.38%、56.61%。第4天,糜子幼胚愈伤组织诱导率开始下降,但与低温预处理2 d相比,其仍然有较高的愈伤组织诱导率。随着处理时间的增加,幼胚愈伤组织诱导率继续呈下降趋势。低温预处理6 d后,‘陕糜1号’幼胚愈伤组织诱导率显著低于对照;‘陕糜2号’与对照无明显差异。综上结果,低温预处理 3 d对提高糜子的幼胚愈伤组织诱导率有积极 作用。
2.2 不同质量浓度2,4-D对糜子幼胚愈伤组织诱导的影响
植物生长调节剂对植物的快速繁殖有着至关重要的作用,不仅影响植物细胞自身的全能性表达,还可以通过与内源激素的相互作用影响细胞的分裂和分化[10]。

不同字母表示不同处理间差异显著性(P<0.05),下同
添加2,4-D对‘陕糜1号’‘陕糜2号’幼胚诱导产生愈伤组织有重要意义(图2)。在MS和N6 2种基本培养基,分别单独添加不同质量浓度的2,4-D,糜子幼胚的愈伤组织诱导率显著不同。总体而言,随着2,4-D质量浓度的增加,‘陕糜1号’、‘陕糜2号’幼胚的愈伤组织诱导率均呈现出先增加后降低的趋势,而且2种糜子幼胚的愈伤组织诱导率为20.00%~65.85%。并且二者的愈伤组织诱导率,均在2,4-D 质量浓度为3 mg/L时达到最大,分别为65.85%(‘陕糜1号’)、 59.16%(‘陕糜2号’),且与其他处理存在显著 差异。
‘陕糜1号’和‘陕糜2号’均在M3培养基显示出最高的愈伤组织诱导率。同时,仅在M3培养基中,‘陕糜1号’和‘陕糜2号’的出愈率均达到50%以上,但在M2培养基中,2个糜子品种的幼胚也存在较高的愈伤组织诱导率,甚至高于N3培养基。由此可见,MS培养基比N6培养基更适合‘陕糜1号’和‘陕糜2号’进行幼胚愈伤组织诱导。因此,可以选择M3培养基做‘陕糜1号’和‘陕糜2号’幼胚的愈伤组织诱导培养基。

图2 不同2,4-D浓度下的糜子幼胚愈伤组织诱导率Fig.2 Frequency of callus induction from immature embryo of proso millet under different 2,4-D concentration
2.3 不同质量浓度2,4-D和KT对糜子幼胚愈伤组织诱导的影响
2.3.1 对‘陕糜1号’的影响 在植物再生体系建立中,将低质量浓度的KT配合较高质量浓度的2,4-D使用,是诱导愈伤组织的常见方法之一[11]。图3为‘陕糜1号’的幼胚在2,4-D与KT组合的培养基中的愈伤诱导情况。比较发现,在不添加KT的情况下,随着2,4-D质量浓度的增加,愈伤组织诱导率呈现先升高后降低的趋势,且IM5培养基中,‘陕糜1号’的幼胚愈伤组织诱导率最高,为65.85%;添加了KT后,愈伤组织的质量明显得到改善,在IM7培养基中,‘陕糜1号’的幼胚愈伤组织诱导率与其他添加了KT的愈伤组织诱导率存在显著差异。本研究还发现,IM9、IM10、 IM11、 IM12、IM21、 IM22、 IM23和IM24培养基中,幼胚的愈伤组织容易发生褐化,也有少量会出现水渍状愈伤组织,同时期其他培养基中并未出现此种情况,说明2,4-D质量浓度过高易导致‘陕糜1号’幼胚愈伤组织褐化。在IM7培养基中,得到的愈伤组织质量最佳,块大,致密,颜色淡黄或者白色。因此,2,4-D和KT的组合中,IM7培养基较适合‘陕糜1号’的幼胚愈伤组织诱导。
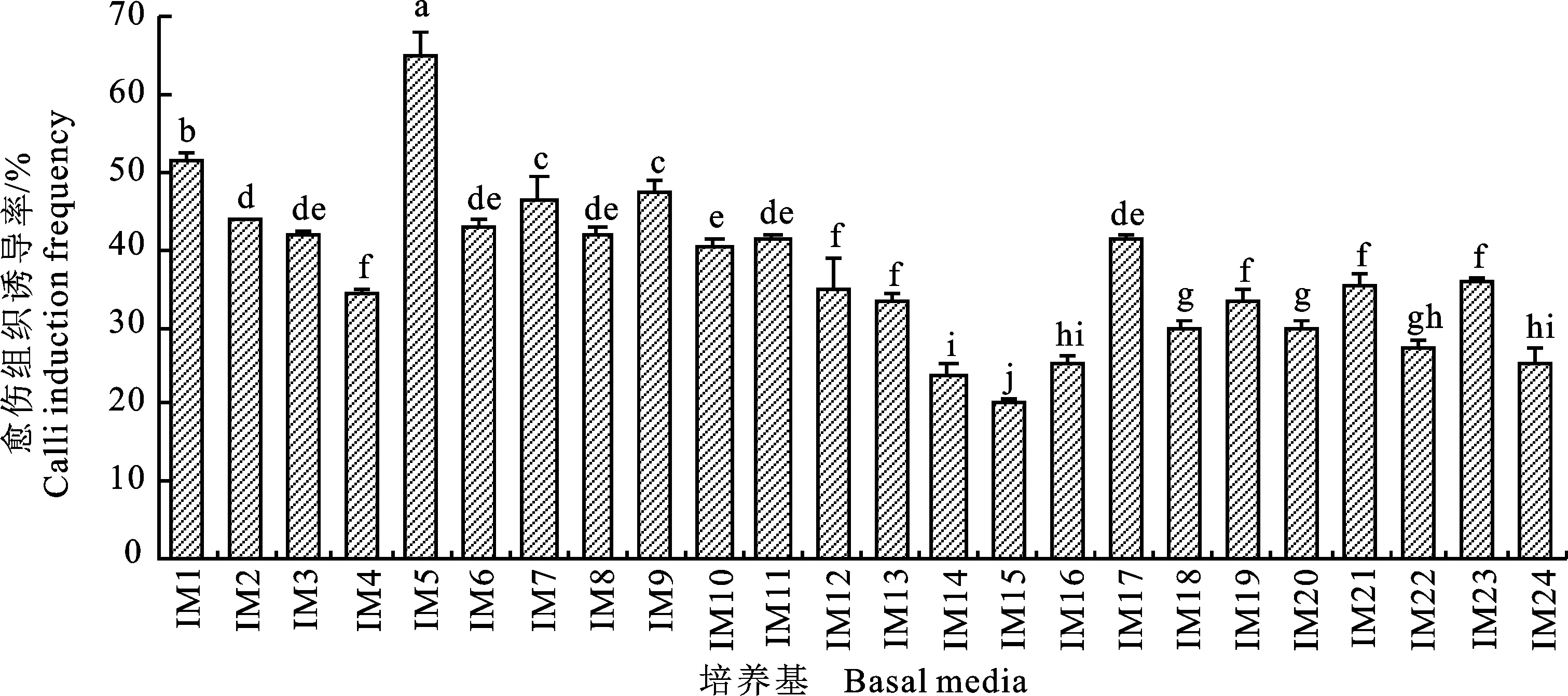
图3 不同质量浓度2,4-D和KT下的‘陕糜1号’幼胚愈伤组织诱导率Fig.3 Frequency of callus induction from immature embryo of Shaanmi No.1 under different concentrations of 2,4-D and KT
2.3.2 对‘陕糜2号’的影响 基因型对幼胚诱导愈伤组织有很大影响[12]。如图4所示,在IM13、 IM14、 IM15、 IM16、 IM17、 IM18、 IM19、 IM20、 IM21、 IM22、 IM23和IM24培养基中,‘陕糜2号’的幼胚愈伤组织诱导率在IM16、IM20、IM24 3种培养基中均达到同2,4-D质量浓度组合最高,分别为44.92%、43.59%、47.68%,且与其他组合存在显著差异,说明在N6培养基中添加KT有利于促进幼胚诱导形成愈伤组织。而在MS培养基中,‘陕糜2号’幼胚愈伤组织诱导率达到最高时(59.27%),KT的质量浓度仍为0 mg/L。同时,在IM6培养基中得到了质量较好的愈伤组织,这与‘陕糜1号’在MS培养基中的响应存在一定差异,可能是由基因型的差异影响了愈伤组织诱导效率和产生的愈伤组织类型。因此,选择IM6培养基为‘陕糜2号’的幼胚愈伤组织最佳诱导培养基,在IM16、IM20、IM24 3种培养基的基础上进一步深入研究N6培养基对‘陕糜2号’的幼胚愈伤组织诱导的 影响。
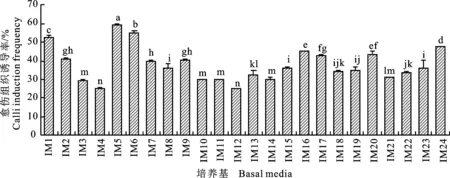
图4 不同质量浓度2,4-D和KT下的‘陕糜2号’幼胚愈伤组织诱导率Fig.4 Frequency of callus induction from immature embryo of Shaanmi No.2 under different mass concentrations of 2,4-D and KT
2.4 不同质量浓度6-BA和NAA对糜子幼胚愈伤组织分化的影响
由表2可知,在1.0 mg/L 6-BA和不同质量浓度NAA中,‘陕糜1号’和‘陕糜2号’的愈伤组织绿点率及出芽率不同。当NAA 质量浓度为0.1 mg/L时,‘陕糜1号’和‘陕糜2号’的绿点率均达到最高,分别为83.33%、88.33%,同时,其出芽率也达到最大值(36.67%、50.00%)。所以,本研究选择MS+1.0 mg/L 6-BA +0.1 mg/L NAA为适宜糜子幼胚愈伤组织分化的培养基。糜子幼胚愈伤组织诱导及植株再生过程见图5。

表2 不同质量浓度6-BA和NAA下的糜子幼胚愈伤组织绿点率及出芽率Table 2 Rate of green spot and bud induction from immature embryo calli of proso millet under different mass concentrations of 6-BA and NAA

a/A. 接种后14 d的幼胚愈伤组;b/B.继代一次的愈伤组织;c/C.转分化后14 d的幼胚愈伤组织;d/D.再生幼苗;f/F. 再生植株(a-f.‘陕糜1号’;A-F.‘陕糜2号’)
3 讨 论
3.1 不同低温预处理时间对糜子幼胚愈伤组织诱导的影响
低温预处理可以提高愈伤组织诱导率[13-14]。但是,对于低温预处理的具体影响,学者们之间的看法不尽一致。有研究表明,低温预处理可以显著提高水稻花药和成熟胚的出愈率和分化率[15-17],而冯明芳等[18]研究发现,黑龙江粳稻成熟胚愈伤组织诱导率会降低,但分化率显著提高;胡雪丹等[19]综合比较, 低温预处理2 d为葫芦花药愈伤诱导的最佳处理时间;周玉丽等[20]等的研究结果则是低温预处理1 d,可以得到较高的甜叶菊愈伤组织率。本研究结果表明,低温预处理3 d有利于糜子幼胚愈伤组织的形成。与前人研究结果不完全相同,可能是植物种类及所选外植体不同,使外植体在脱分化时对低温处理的响应不同所致。
3.2 不同质量浓度2,4-D对糜子幼胚愈伤组织诱导的影响
2,4-D作为一种常见的植物激素,对植物愈伤组织诱导有重要影响,且有学者研究表明,2,4-D是诱导形成愈伤组织的必要条件[21]。当培养基中仅含有2,4-D时,外植体更容易产生愈伤组织,且2,4-D的最佳质量浓度为2.0 mg/L[22]。王晶晶[23]研究发现,2,4-D质量浓度为1.5~2.0 mg/L时,小麦幼胚的继代培养效果最好,其中 2,4-D为2.0 mg/L时,甚至继代5次后,再生率还高达29.8%。杨玉洁等[24]在对直立冬青幼胚愈伤组织的诱导分化研究中,发现在培养基中添加0.5~2.0 mg/L 2,4-D时,对其幼胚诱导有积极作用,得到的幼胚诱导率最高。本研究结果发现,当2,4-D质量浓度为3.0 mg/L时,糜子幼胚诱导出的愈伤组织质量好且诱导率较高,这与徐凤等[25]在节节麦的幼胚再生体系建立中的结论一致。本研究也表明,2,4-D质量浓度过高或者过低,均会导致幼胚愈伤组织诱导率的下降,且当2,4-D达到较高的质量浓度时,愈伤组织容易发生褐变,这与彭琼等[26]的研究结果一致。
3.3 不同质量浓度2,4-D和KT对糜子幼胚愈伤组织诱导的影响
国内有相关研究发现[23],在小麦组织培养中,在诱导和继代培养基中添加0.5 mg/L KT和2,4-D配合使用,将显著提高小麦幼胚的愈伤组织诱导率和分化率。徐凤等[25]在节节麦的幼胚体系建立中,发现KT对节节麦幼胚愈伤组织分化有着显著影响,且以KT浓度为1.0 mg/L时最佳。Asakura等[22]对番茄外植体再生能力进行比较,结果显示,在MS培养基中添加2,4-D和KT,未成熟胚愈伤组织诱导率从42.4%到100%不等,其中,最适合番茄未成熟胚愈伤组织诱导的激素组合为2,4-D 2.0 mg/L和KT 5.0 mg/L。而别晓敏等[27]则认为适宜小麦幼胚愈伤组织诱导的的最佳激素组合为2,4-D 2.0 mg/L和ABA 0.3 mg/L。本试验也选择在2,4-D的基础上,添加一定质量浓度的KT,优化糜子幼胚愈伤组织诱导体系,研究结果证明,添加低质量浓度的KT对愈伤组织的诱导率没有显著影响,但是可以明显改善愈伤组织的质量,这与李惠[11]的研究结果相同。
此外,本研究还发现,‘陕糜2号’在N6+ 2,4-D+KT(1.5 mg/L)的组合中,即IM16、IM20、IM24培养基中均表现出了较高的愈伤组织诱导率,虽然低于仅含有2,4-D的培养基,但是,较之低质量浓度的KT组合,愈伤组织诱导率已经显著提高,因不知持续增加KT的质量浓度,出愈率变化的趋势,所以暂时认定低质量浓度的KT对糜子幼胚愈伤组织诱导影响不大,但尚不能确定高质量浓度的KT对幼胚诱导率的影响,Asakura等[22]的研究结果在一定程度上为本研究的后续工作提供了依据。
3.4 不同质量浓度6-BA和NAA对糜子幼胚愈伤组织分化的影响
MS培养中添加不同质量浓度的6-BA和NAA对植物愈伤组织分化有较大影响[28-29]。李扬等[30]认为适于野生一粒小麦的6-BA质量浓度为0.5 mg/L,且6-BA质量浓度较高会使愈伤组织的褐化率升高,分化率降低,与本研究结果不尽一致,应是由作物对激素的耐受力不同引起的。郭伶娜等[31]通过试验得到,在只添加6-BA的培养基中,高羊茅的分化成苗率为33.1%,与本研究的结果相同。同时,他们还发现当6-BA和NAA配合使用时,可以促进愈伤组织分化成苗。本研究结果也显示,在MS培养基中,当6-BA的浓度为1.0 mg/L,NAA 的质量浓度为0.1 mg/L时,糜子幼胚愈伤组织的绿点率和出芽率均为最高,体现了6-BA和NAA的组合对愈伤组织分化的积极作用,这可能是因为NAA的主要功能是诱导芽的生长和促进生根,可以有效地吸收培养基中的营养成分[32]。
4 结 论
4 ℃低温预处理3 d对糜子幼胚愈伤组织诱导最有利。在M3培养基中,‘陕糜1号’和‘陕糜2号’的幼胚愈伤组织诱导率均达到最大值;且在培养基中添加低浓度的KT可以明显改善愈伤组织质量,其中,2,4-D和KT的组合中,适宜‘陕糜1号’幼胚愈伤组织诱导是IM7培养基,适宜‘陕糜2号’幼胚愈伤组织诱导是IM6培养基,存在基因型差异;适宜糜子幼胚愈伤组织分化的培养基为MS+1.0 mg/L 6-BA +0.1 mg/L NAA。
