珊瑚礁对热液流体的地球化学记录
——来自南海西沙永兴岛珊瑚礁稀土元素的证据
2020-08-26魏浩天刘刚韩孝辉赵彦彦吴佳庆杨俊
魏浩天,刘刚,韩孝辉,赵彦彦,4,吴佳庆,杨俊
1.中国海洋大学海洋地球科学学院,青岛 266100
2.海底科学与探测技术教育部重点实验室,中国海洋大学海洋高等研究院,青岛 266100
3.海南省海洋地质资源与环境重点实验室,海南省海洋地质调查研究院,海口 570206
4.青岛海洋科学与技术国家实验室海洋矿产资源评价与探测技术功能实验室,青岛 266061
稀土元素是一组特殊的微量元素,一般以共同沉淀或吸附的方式进入水成的化学沉积物(岩),如:碳酸盐岩、条带状铁建造、硅质岩或磷酸盐岩等[1-4]。这些化学沉积物(岩)的稀土元素含量、配分模式及元素异常能够记录周围沉积水体的地球化学特征,从而能够很好地指示古海洋条件及沉积过程[1,3,5-6]。
永兴岛位于西沙群岛东部的宣德环礁中部(图1),是一座由珊瑚、贝壳沙等堆积在礁平台上形成的珊瑚岛。现代珊瑚礁是一种生物多样性很高、资源非常丰富的生态系统[7],其主要组成是珊瑚,它可以作为一个高分辨率的载体记录过去环境变化过程,从而使得珊瑚在揭示热带、亚热带海区环境变化过程及全球气候变化等方面发挥着重要的功能[8-10]。珊瑚文石骨骼保存的地球化学特征可以记录海洋环境条件[11],而其中的稀土元素组成可以反映周围海水在珊瑚生长时期的成分变化[12]。另外,Webb等[13]对更新世的石珊瑚骨骼研究发现,稀土元素配分模式等信息在成岩过程中可以较完好地保存下来。因此,稀土元素在珊瑚礁环境记录方面具有较大潜力。本研究中,我们对南海西沙宣德环礁永兴岛的钻孔岩心样品进行了详细的地球化学分析,根据其主微量元素含量,尤其是稀土元素的配分模式、异常指数等指标,来反演142~84 ka间海水中稀土元素的分布特征,并判断珊瑚礁形成时的气候条件、环境演化及流体来源。
1 材料及方法
本文的珊瑚礁样品是使用钻机于SSZK1井取得56 m的岩心柱(图2A)。由于0~18.40 m主要是由未固结的生物碎屑砂及弱固结生物碎屑灰岩组成,其来源相对不确定,所以不是我们本次关注的对象。本次研究主要关注18.40~56.00 m层位的固结灰岩,其中18.40~21.55和23.40~28.55 m主要为生物碎屑灰岩,夹杂着部分红藻和少量珊瑚骨架;21.55~23.40和29.30~30.80 m主要为珊瑚骨架;28.55~29.30和30.80~42.50 m主要为红藻黏结灰岩,其中夹杂着部分生物碎屑;42.50~46.40 m为含内碎屑泥灰岩;46.40~50.20 m主要为红藻黏结灰岩,其中夹杂着生物碎屑、含内碎屑泥灰岩及珊瑚骨架;50.20~51.90 m主要为生物碎屑灰岩,其中有少量的珊瑚骨架;51.90~53.55 m主要为含内碎屑泥灰岩,夹杂着生物碎屑;53.55~55.50 m为珊瑚骨架;55.50~56.00 m为含内碎屑泥灰岩及少量的红藻充填。而在23 m的位置发育长24 cm的珊瑚骨板(图2B),主要由珊瑚化石构成的碳酸盐岩。
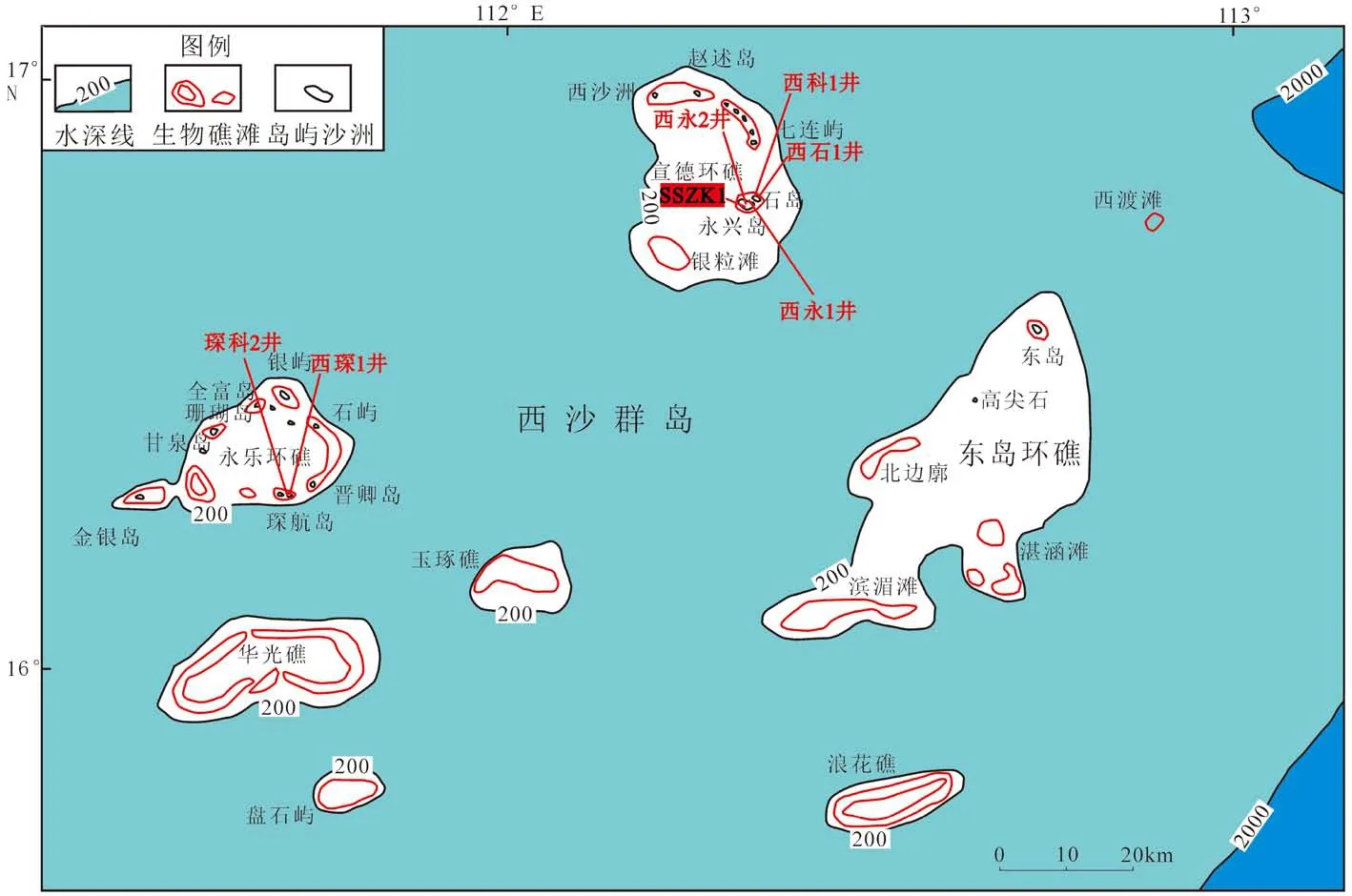
图1 珊瑚样品采集地点[14]Fig.1 Coral sample collection site[14]
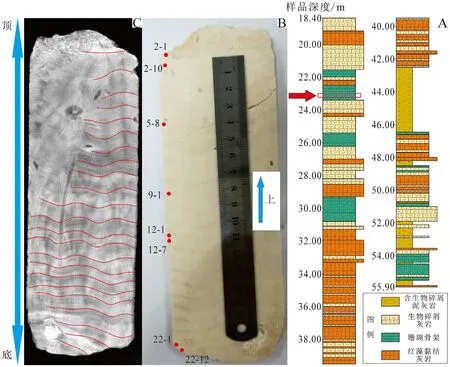
图2 地层柱状图(A),滨珊瑚骨骼化石样品(B)及其X光照片(C)Fig.2 Stratigraphic column (A),samples of Porites skeleton fossil (B) and its X-ray photos (C)
在进行地球化学测试之前,将所有样品用去离子水超声清洗干净,自然晾干。为了获取当地海水的特征,取样过程中优先选取分布连续、边界清晰的珊瑚骨骼或生物碎屑用牙钻钻取样品,并用玛瑙研钵将其无污染的研磨至200目。其中23 m处发育的滨珊瑚骨骼化石切成厚度约为7 mm的薄板,并通过X射线拍照(图2C)识别出21年的生长纹层,后用牙钻在滨珊瑚骨骼化石纹层的脊部按约0.5 mm的间隔钻取样品,并将其无污染的研磨至200目。
1.1 XRD测试方法
不同层位珊瑚礁的矿物组分采用粉晶衍射法(XRD)进行确定。样品测试在中国科学技术大学理化实验中心,使用Rigaku D/max-IIIa X射线衍射仪,Cu靶旋转靶辐射,管电压为40 kV,管电流为20 mA,步长为 0.02°(2θ),扫描范围为 3°~70°。测试过程均为计算机控制,测定时的试验条件均保持不变。
1.2 主微量元素测试方法
称取50 mg样品放入离心管中,然后加入3 mL 1 mol/L的HAC,在水浴环境下超声震荡使样品充分溶解至无气泡。待样品完全溶解后,在3 500 r/min的速度下离心15 min,并将离心管上部清液转移至溶样罐中,在电热板上蒸至湿盐状。随后,加入0.1 mL 1 N的HNO3蒸至湿盐状2次,最后加入0.3 mL 1 N的HNO3将样品溶解,并加入1 mL 100×10-9的Rh定容至10 mL待测。微量元素含量测试在南京聚谱检测科技有限公司的Agilent 7700x ICP-MS上进行。为了监控测试精度,在溶样过程中加入GSR-12和JDO-1两个标准物质及两个空白样,并间隔20个样品增加两个重复样。样品测试结果由标准物质、空白样和重复样进行监控,分析精度小于10%。
1.3 电子探针测试方法
电子探针分析在中国地质大学(武汉)地质过程与矿产资源国家重点实验室的JEOL JXA-8 100电子探针分析仪上完成。样品在上机测试之前先按照Zhang等[15]提供的办法镀碳,然后放入样品腔进行测试。工作时为了减少样品损坏及计数的波动[16],所用的加速电压为15 kV,加速电流为10 nA,束斑直径为10 μm。测试数据均进行ZAF校正处理,其中碳元素的含量是根据原子比C∶O = 1∶3进行计算并参与ZAF校正。
1.4 Th-U定年测试方法
为了获取可靠的年龄,取样时使用牙钻获取了晶形保存较好的珊瑚骨骼样品,实验过程参照廖泽波等[17]采用的方法,利用UTEVA树脂分离提纯U/Th,化学流程为:①在Teflon溶样器中添加少量Spike(≤50 mg)并在 100 ℃ 下蒸干,待溶样器冷却后加入适量样品(20~120 mg),随后向其中加入1 mL 14 N的HNO3彻底溶解样品;②加入不超过20 μL的HClO4高温消解有机质,在温度为130 ℃的电热板上加热,使之回流5 h以上,最后将样品完全蒸干;③向已经蒸干的样品中分别加入1 mL 14 N和1 mL 7 N 的HNO3溶解样品,并再次蒸干,再加入1 000 μL 7 N的HNO3溶解样品,等待过柱;④将样品溶液加入已备好的UTEVA树脂柱,分别用500 μL 7 N 的 HNO3、1 000 μL 6 N 的 HCl和 500 μL 6 N 的HCl淋洗树脂柱去除溶液中的杂质;⑤先后用500 μL 3 N的HCl洗涤树脂柱以收集Th、用1 000 μL 0.5 N HCl洗涤树脂柱以收集U;⑥加入不超过20 μL的HClO4高温消解收集Th、U溶液中的有机质,然后将溶液彻底蒸干,最后用适量14 N的HNO3溶解样品并蒸干;⑦向蒸干的Th、U收集杯中加入0.5 N HNO3+0.01 N HF混合酸各500 μL使样品完全溶解,准备上机测试。
U/Th同位素测试在南京师范大学钟乳石同位素实验室的Neptune MC-ICP-MS上完成,采用上述化学流程得到的U、Th回收率超过75%。U同位素标准样品采用HU-1作为标准,测试结果经过计算后能够获得珊瑚生长的年龄,年龄分析误差为±2σ。
2 结果
2.1 岩性特征描述
通过钻孔岩心的手标本和岩石薄片的鉴定,结合前人对碳酸盐岩微相的研究[18-19],识别出研究区的主要岩石类型为珊瑚骨架灰岩、红藻黏结灰岩、生物碎屑灰岩和含生物碎屑泥灰岩。研究区珊瑚骨架灰岩基本是由原地生长的滨珊瑚组成的骨架灰岩,通常呈灰白色,具有明显的隔板结构,其间孔隙较为发育,部分被胶结物充填(图3A)。镜下观察发现珊瑚的基本结构与形态保存完整,珊瑚骨骼含量大于90%(图3B)。部分样品存在因隔板溶蚀形成的次生孔隙,其间可见重结晶的方解石晶体,可能是由文石发生新生变形作用转化的低镁方解石;红藻黏结灰岩主要是由红藻呈白色条带以缠绕状将生物碎屑及泥晶黏结在一起,通常为灰白色(图3C)。镜下观察红藻含量为20%~30%,生物屑含量为60%~80%(图3D);生物碎屑灰岩主要由大小不一的生物碎屑颗粒组成,通常呈灰白色,不同层段的固结程度有一定差异(图3E)。镜下观察发现生物碎屑主要由珊瑚碎片、藻屑和有孔虫壳体组成,多数生物碎屑颗粒破碎,形成大小不一的不规则形状(图3F)。生物碎屑间填充有起胶结作用的泥晶方解石;含生物碎屑泥灰岩主要由生物碎屑和灰泥构成,其内少见胶结物,通常较松散,微弱固结(图3G)。镜下观察发现有较多溶蚀形成的次生孔隙,泥晶中也有少量的微小溶蚀孔发育(图3H)。
2.2 XRD
文石的(111)特征峰为 2θ=25.5°~26.5°,d=3.39~3.40Å,(212)特征峰为 2θ=45°~46.30°,d=1.974~1.977Å;方解石的(104)特征峰为 2θ=29.25°~29.80°,d=2.995~3.035Å,据此可将两者从衍射图谱中定性地识别出来(图4)。同时,采用自清洗法对样品中的文石和方解石相对含量进行计算,从国际衍射数据中心提供的PDF-4矿物数据库中查找文石和方解石的 RIR(K)值,分别为 0.55(d=1.99)和 2.65(d=3.02),结合Jade6.5软件对原始数据的分析,得到文石和方解石的相对含量(表1)。结果显示,珊瑚礁岩心柱18.40 m处的生物碎屑灰岩为文石和方解石组成的混合物,其中文石含量为76.4%,方解石含量为23.6%(图4A);22.80 m处的珊瑚骨架主要矿物为文石,含量100%(图4B);23 m处的滨珊瑚骨骼化石为文石与方解石组成的混合物,其中文石含量为76.3%,方解石含量为23.7%(图4C);27.75 m处的生物碎屑灰岩为文石和方解石组成的混合物,其中文石含量为43.6%,方解石含量为 56.4% (图4D);31.20 m 处的生物碎屑灰岩和41.80 m处的红藻黏结灰岩的主要矿物均为方解石,含量为100%(图4E、F)。从垂向分布来看,珊瑚礁岩心柱随深度变化,矿物含量也在改变。以27.75和31.20 m为分界线,27.75 m以上主要以文石矿物居多,27.75 m以下方解石矿物大量增多,31.20 m以下珊瑚礁全部为方解石矿物组成。

图3 研究区珊瑚礁宏观手标本和显微照片A.珊瑚骨架灰岩宏观照片;B.珊瑚骨架灰岩,单偏光;C.红藻粘结灰岩宏观照片;D.红藻粘结灰岩,单偏光;E.生物碎屑灰岩宏观照片;F.生物屑灰岩,单偏光;G.含生物碎屑泥灰岩宏观照片;H.泥晶生屑灰岩,单偏光。Fig.3 Macroscopic hand specimens and micrographs of coral reefs in the study area A.Macro photo of coral skeleton limestone; B.Coral skeleton limestone,single polarized light; C.Macro photo of red algae bound limestone; D.Red algae bound limestone,single polarized light; E.Macro photo of bioclastic limestone; F.Bioclastic limestone,single polarized light; G.Macro photo of bioclastic marl; H.Micritic bioclastic limestone,single polarized light.

图4 珊瑚礁样品X射线衍射图谱Ar.文石,C.方解石;A.18.40 m处生物碎屑灰岩,B.22.80 m处珊瑚骨架,C.23 m处滨珊瑚骨骼化石,D.27.75 m处生物碎屑灰岩,E.31.20 m处生物碎屑灰岩,F.41.80 m处红藻黏结灰岩。Fig.4 X-ray diffraction pattern of coral reef samples Ar.aragonite,C.calcite.A.Bioclastic limestone at 18.40 m; B.Coral skeleton at 22.80 m; C.Porites skeleton fossil at 23 m; D.Bioclastic limestone at 27.75 m;E.Bioclastic limestone at 31.20 m; F.Red algae bound limestone at 41.80 m.
2.3 珊瑚礁的年龄
珊瑚礁岩心柱11个样品的测年结果见表2。样品238U 含量为 509~3 108×10-9,232Th 含量为 158~111 312×10-12,较高的238U含量与相对较低的232Th含量提高了测年的精度,测年绝对误差为300~3 710 a(相对误差为2.6‰~11‰)。结合XRD数据及对岩心柱手标本的观察可以得出,由于成岩交代作用的破坏,岩心柱27.75 m以下深度的样品分析结果不能使用。最终得到可靠的珊瑚年龄测试结果,珊瑚礁 18.35 m处年龄为83.82±0.277 ka,至24.95 m处年龄为142.47±0.540 ka。其中23.00 m处YL-2 300为滨珊瑚骨骼化石,样品的年龄为114.35±0.30 ka,沿样品的主生长轴设置截线断面可识别出滨珊瑚骨骼化石的生长年龄约为21 a,平均生长率为1.14 cm/a。
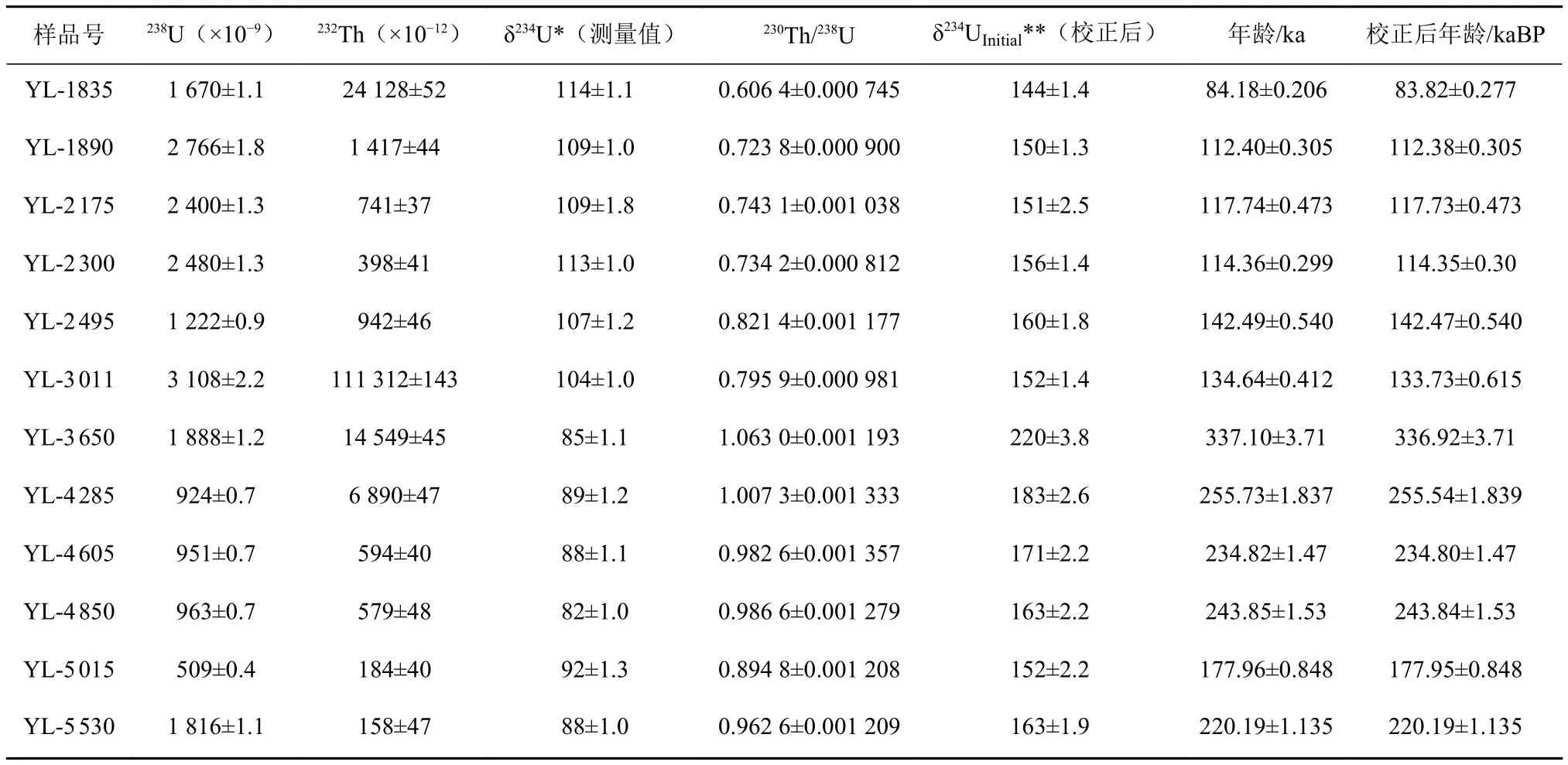
表2 岩心柱中部分珊瑚(包括滨珊瑚骨骼化石)238U-232Th测年结果Table 2 238U-232Th dating results of some corals (including Porites skeleton fossil) in core column
2.4 珊瑚礁的主量元素特征
珊瑚礁的主量元素测试结果见表3。珊瑚岩心柱样品中CaO含量为53.05%~63.04%,MgO含量为0.13%~0.82%,Na2O含量为0.16%~0.58%,Al2O3、K2O 含量均不超过0.05%,P2O5、SiO2含量均不超过0.1%;滨珊瑚骨骼化石样品中CaO含量为42.2%~52.4%,MgO含量为0.12%~0.33%,Na2O含量为0.44%~0.99%,Al2O3、K2O含量均不超过0.05%,SiO2含量均不超过0.1%。
2.5 珊瑚礁的稀土元素特征
为了更直观地展现稀土元素的含量和分馏特征,消除由于元素丰度奇偶效应所造成的随原子序数增加而出现的锯齿状变化,本文采用澳大利亚后太古宙页岩(PAAS)对样品数据进行标准化(将样品中REE的含量除以参照物质中各REE的含量)。稀土元素含量经标准化后以10为底取对数作为纵坐标、稀土元素为横坐标可得到稀土元素配分模式图(图5)。通常可以利用[Nd/Tb]PAAS和[Nd/Yb]PAAS代表LREE/MREE和LREE/HREE来指示LREE的亏损和富集程度[5,20]。对多种稀土元素的异常指数进行计算,其中La异常、Ce异常和Eu异常的计算公式分别为:
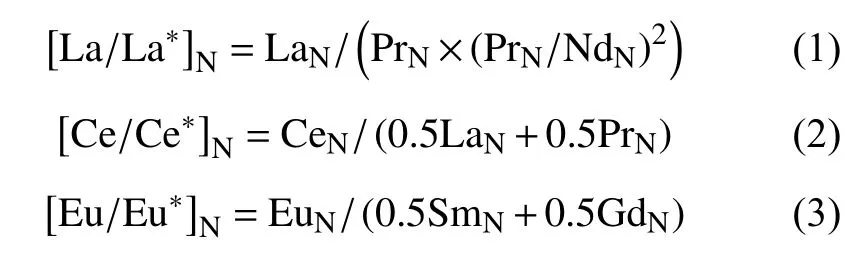
在计算这些元素异常时,首先要保证用来计算元素异常的相邻元素自身不能有任何异常。通常情况下,一般用线性平均法来计算元素的异常系数[21];但是若相邻元素呈现异常,则可用几何平均法来计算[22]。最后通过比较两个公式得出的差值来决定采用哪种方法,若差值较小(<5%),采用线性平均法;若差值较大,则采用几何平均法。根据此原则,本研究中的La异常采用了几何平均法,而Ce和Eu异常则采用了线性平均法。
结果表明,永兴岛SSZK1井珊瑚岩心柱样品的总稀土含量(ΣREE)为(0.06~2.55)×10-6(表4),其PAAS标准化后的稀土配分特征为:①LREE亏损,其中 [Nd/Tb]PAAS为 0.27~0.56,[Nd/Yb]PAAS为 0.17~0.59;②La具有正异常,[La/La*]PAAS为1.28~2.16;③Ce具有负异常,[Ce/Ce*]PAAS为0.3~0.72;④Eu的异常不明显,[Eu/Eu*]PAAS为0.98~1.35;⑤Y/Ho值变化范围比较大,为41.16~78.49(图5A)。
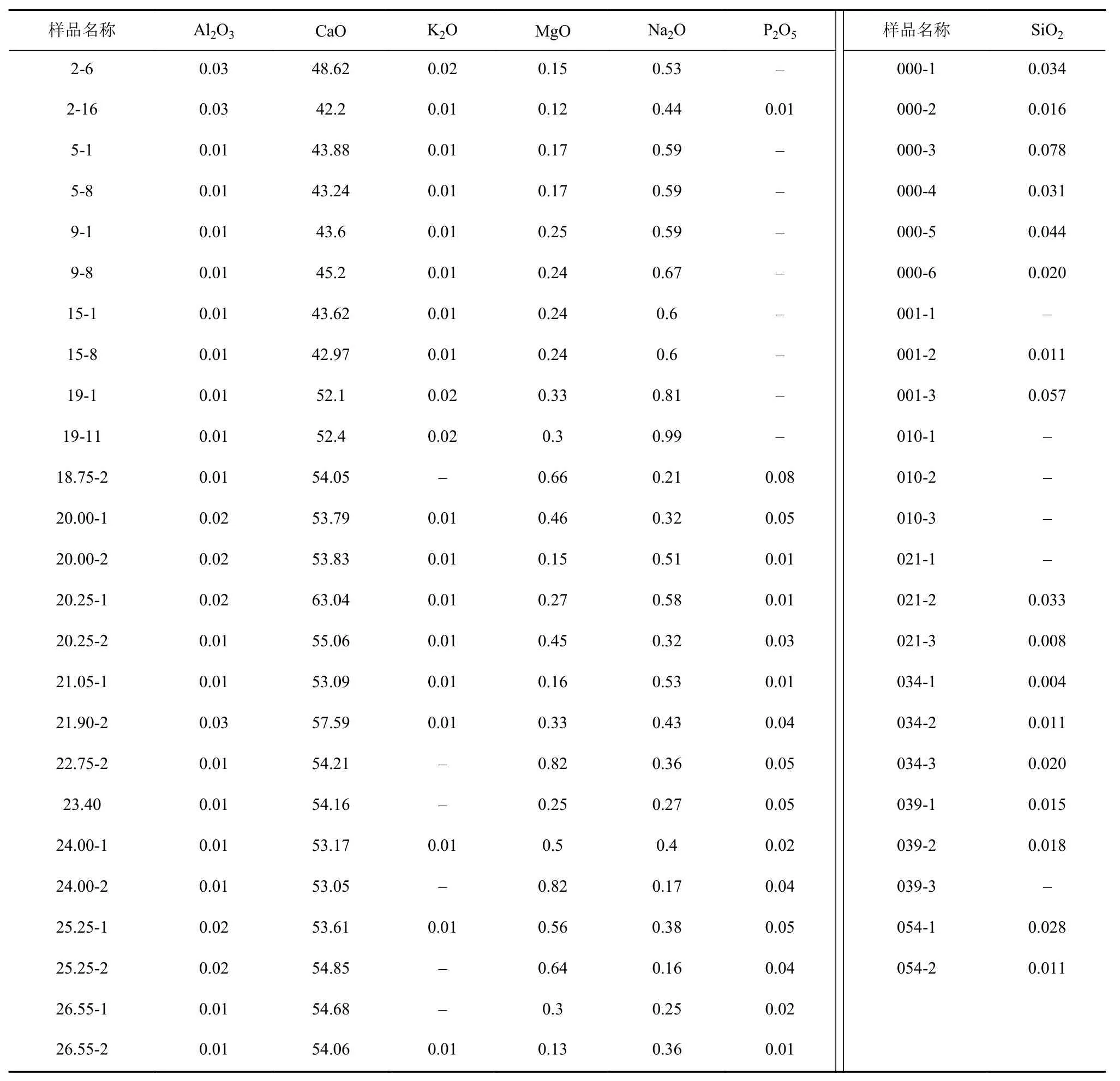
表3 主量元素测试结果(单位:%)Table 3 Major element test results(unit: %)
23 m附近滨珊瑚骨骼化石的ΣREE含量为(0.03~0.06)×10-6(表4),其稀土配分特征为:①LREE 亏损,[Nd/Tb]PAAS为 0.29~0.43,[Nd/Yb]PAAS为0.16~0.25;②La具有正异常,[La/La*]PAAS为1.16~1.69;③Ce呈 负 异常,[Ce/Ce*]PAAS为0.60~1.07;④Eu具有明显的正异常,[Eu/Eu*]PAAS为1.34~2.94;⑤Y/Ho 比值较高,为 81.11~105.65(图5B)。
3 影响稀土元素组成的因素
在碳酸盐矿物的沉积过程中,不可避免的会混入一些硅酸盐矿物[3,5,20-21,23]、Fe-Mn氧化物[24]和磷酸盐[25]等非碳酸盐组分。这些非碳酸盐组分中的稀土元素在成岩蚀变和分析测试过程中容易析出,改变碳酸盐岩的原始稀土元素含量。所以,在利用稀土元素配分模式、异常指标等讨论沉积环境和流体来源之前,要首先排除非碳酸盐组分和成岩蚀变作用对原始微量元素含量的改变程度。

图5 岩心柱样品与滨珊瑚骨骼化石样品稀土元素配分模式图A.岩心柱样品,B.滨珊瑚骨骼化石样品。Fig.5 REE distribution pattern of core column samples and Porites skeleton fossil samples A.Core column samples,B.Porites skeleton fossil samples.
3.1 非碳酸盐组分的影响
3.1.1 硅酸盐矿物
硅酸盐矿物的混入能够明显改变海相碳酸盐岩的稀土元素配分模式使得碳酸盐岩的REE+Y表现为平缓、未分异的配分模式,稀土元素的异常也会变得不明显[1,20-21,26]。由于硅酸盐矿物中富含不溶性元素Al、Th、U及稀土元素,所以可以用这些元素含量与ΣREE或元素异常之间的相关性识别碳酸盐岩的稀土元素含量是否受硅酸盐矿物的污染。如果碳酸盐岩的元素含量已受到污染,则其Al、Th、U的含量与ΣREE含量之间会呈明显的正相关关系[1,5,21,27],而LREE亏损程度(用NdN/YbN代替)则与ΣREE呈负相关关系。电子探针测试中珊瑚礁样品的SiO2含量均小于0.1%(表3),滨珊瑚骨骼化石和其他层位珊瑚礁岩心的NdN/YbN与ΣREE含量之间(图6A、B)、U含量与ΣREE含量之间都不存在任何相关性(图6C、D),这说明所有样品没有受到硅酸盐矿物的影响。尤其是Frimmel[21]的研究认为碳酸盐岩中Zr含量大于4 μg/g时,样品可能已经受硅酸盐物质的影响,但是本研究中珊瑚样品的Zr含量为 0.015~0.651 μg/g(表5),所以样品中硅酸盐含量很低,珊瑚的稀土元素组成和配分模式没有受到硅酸盐矿物的影响。
3.1.2 Fe-Mn氧化物/氢氧化物
Fe-Mn氧化物/氢氧化物在溶解过程中可能会释放出MREE到水体中,导致水体中的MREE富集,进而导致沉淀的碳酸盐岩呈现出MREE富集的稀土配分模式[28-29]。Fe-Mn氧化物/氢氧化物常富集Ni和Cu元素,因此,碳酸盐岩的稀土元素含量受Fe-Mn氧化物/氢氧化物的影响程度可以通过稀土元素含量、Y/Ho比值与Fe、Mn、Ni、Cu等元素之间的相关性进行分析。本次研究中,不论是滨珊瑚骨骼,还是其他层位的珊瑚岩心样品,其ΣREE含量和Y/Ho比值与Fe、Mn、Ni、Cu含量之间都不存在相关关系(图7),而且整个珊瑚岩心的Ce元素都具明显的负异常,这指示了整个珊瑚样品都没有受到Fe-Mn氧化物/氢氧化物的污染。
3.1.3 磷酸盐矿物
在碳酸盐岩沉淀时或早期成岩过程中,磷酸盐矿物可以取代钙质沉积物或直接沉淀在表面[30],使碳酸盐岩遭受到磷酸盐矿物的污染。碳酸盐岩是否受到磷酸盐矿物的污染可以用ΣREE和P之间的相关性进行检测[31]。若二者不具有很好的正相关性,则表明磷酸盐矿物的影响很小甚至可以忽略。本研究中,大部分滨珊瑚骨骼化石样品中的P元素含量低于检测限(表3),而其他层位珊瑚岩心柱样品中,ΣREE和P之间的相关系数R2=0.47(图8),表明该珊瑚样品中有磷元素的混入,可能是永兴岛上存在的鸟粪层带来的磷元素。
另外,碳酸盐岩中还经常富含黄铁矿、黄铜矿等硫化物,所以其稀土元素含量经常受到硫化物的影响。Bolhar等[3]发现,Y/Ho值与氧化物和硫化物富含元素(Pb、Sc)之间的关系,可识别出碳酸盐岩是否受到氧化物和硫化物等非碳酸盐矿物的影响。本研究中滨珊瑚骨骼化石和其他层位珊瑚岩心的Y/Ho值与Sc、Pb含量之间没有相关性(图9),因此,本研究中的样品没有受到氧化物和硫化物的影响。
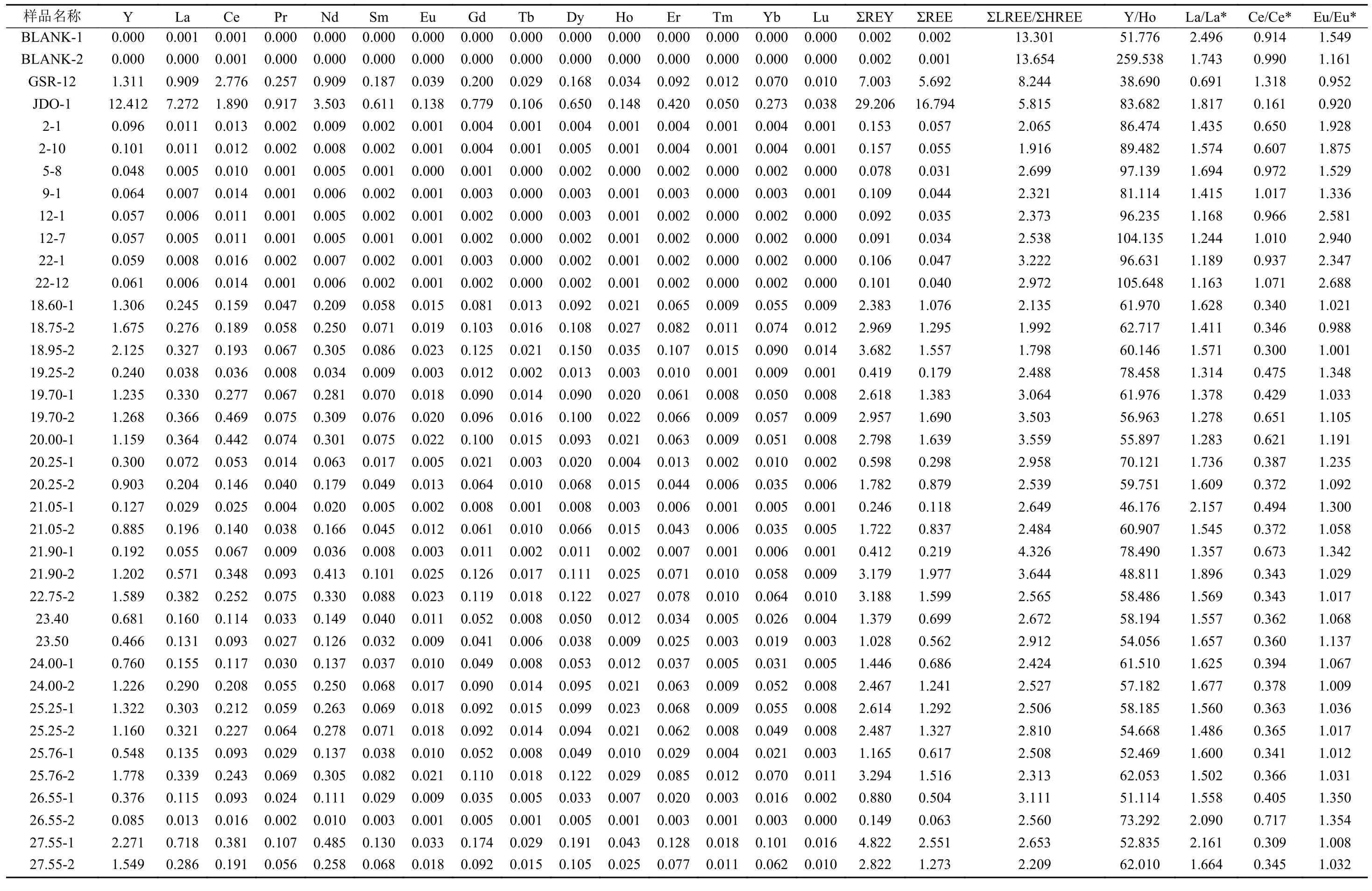
表4 稀土元素含量(×10-6)及其相关指标Table 4 Rare earth element content (×10-6)and related indicators
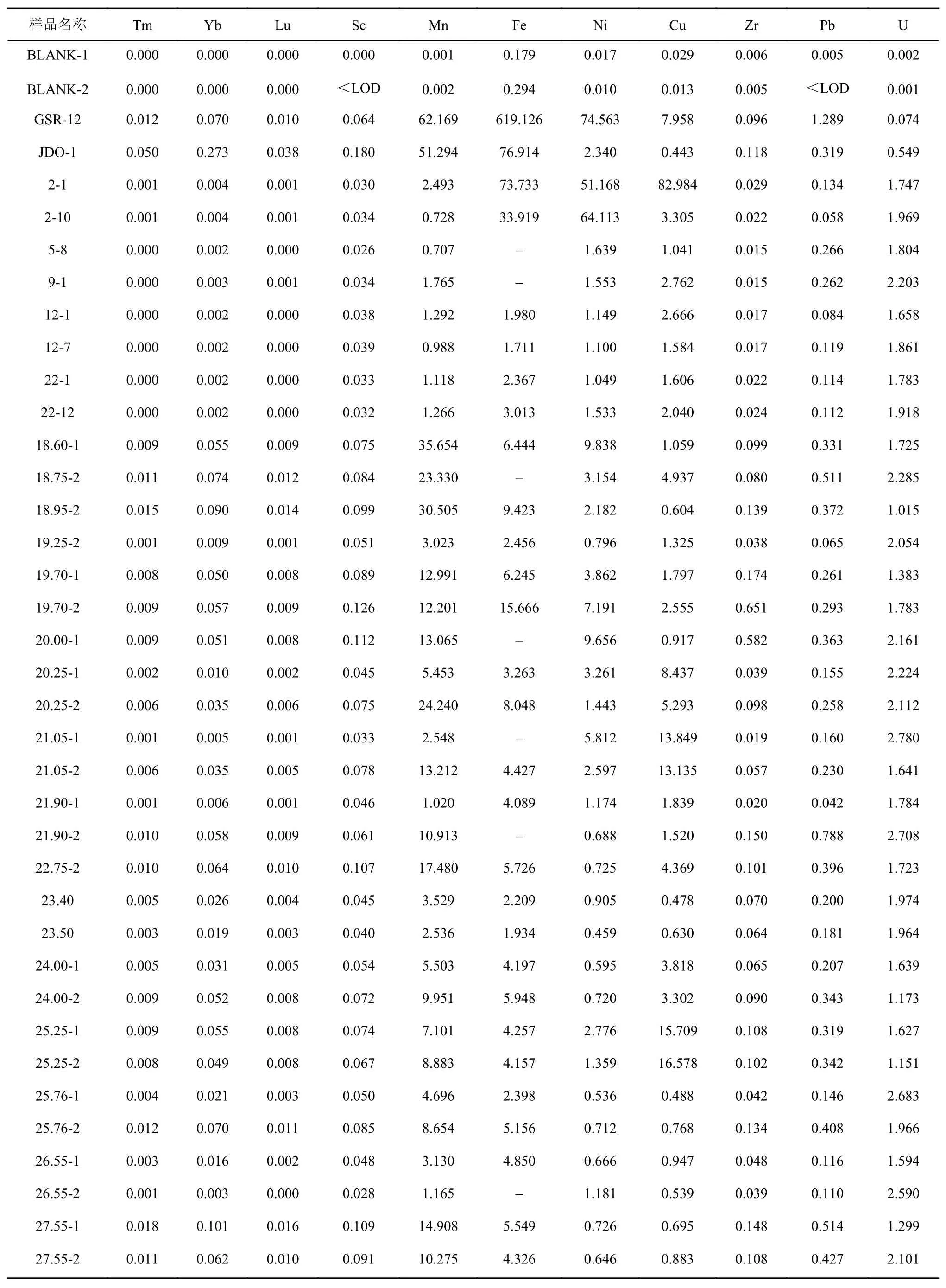
表5 微量元素含量(单位:×10−6)Table 5 Trace element content (unit: ×10-6)
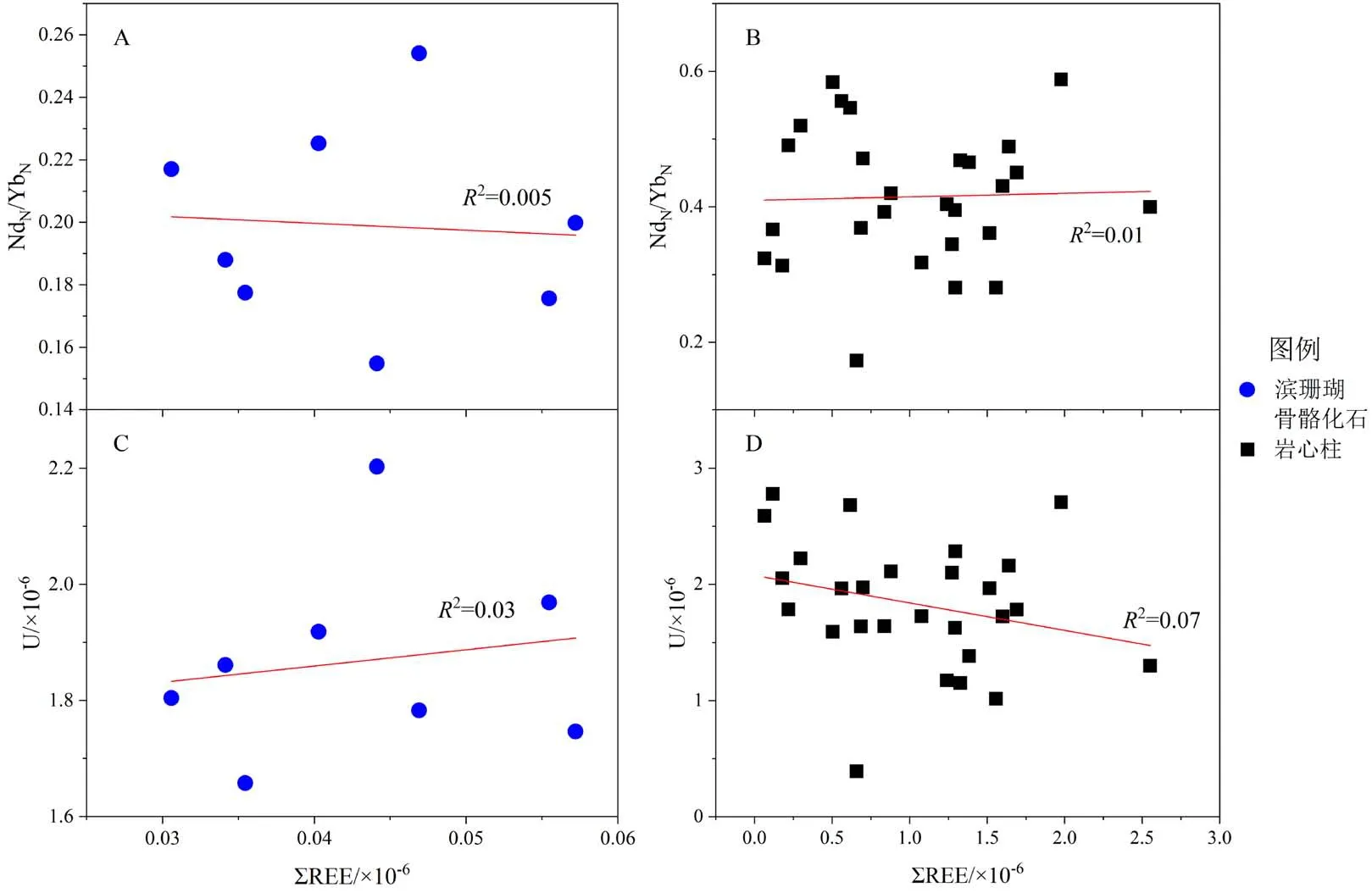
图6 滨珊瑚骨骼化石和岩心柱的NdN/YbN、U与ΣREE含量相关图Fig.6 NdN/YbN,U and ΣREE contents in Porites skeleton fossil and core columns
3.2 成岩蚀变作用的影响
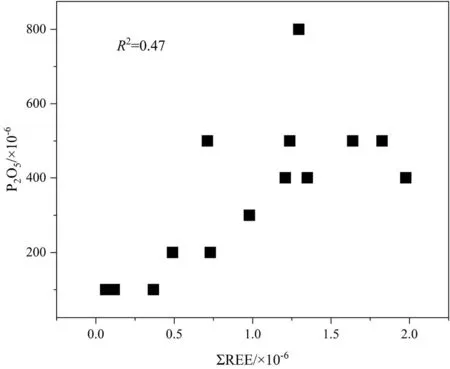
图8 岩心柱样品中ΣREE和P之间的相关图Fig.8 Correlation between ΣREE and P in core samples
海水中的微量元素一般可以通过3种途径进入珊瑚:类质同象、捕获和珊瑚组织吸收有机物质,即摄食[32]。Fallon Stewart等[8]的研究表明珊瑚的REE配分模式与海水的REE配分模式是一致的,表明珊瑚主要是以类质同象的方式吸收海水中的REE。而且许多研究也表明稀土元素是通过类质同象的方式进入碳酸盐晶体格架中[27,33],所以在成岩过程中,格架中的稀土元素比较稳定。同时稀土元素离子半径较大、低温不易溶于水,导致沉积后流体中的稀土元素含量很低(约为 10-6~10-4μg/g)[34-35]。而且成岩过程中,胶结作用会使得碳酸盐沉积物的孔隙度和渗透率降低,所以,一般认为沉积后的成岩流体对碳酸盐岩中稀土元素含量的影响很小[5,13,36],即使存在强烈成岩蚀变,碳酸盐岩的稀土元素含量也可能十分稳定[5,36-37]。
然而,碳酸盐矿物从水体中沉淀之后,会经过一系列的结构、组分和化学变化逐渐达到稳定,这个过程中稀土元素会从碳酸盐岩中吸附/解析,可能产生稀土元素的分馏[28,38]。Webb等[13]提出较为古老的石灰岩的REE地球化学指标是否能作为恢复原始海水REE的指示取决于在后来的成岩作用中原始REE配分模式的保留程度,而Nothdurft等[5]的研究也说明如果没有陆源污染、也没有高含量的与海水REE组分相异的流体侵入或成岩蚀变,多数石灰岩可以较好地保存沉淀区REE地球化学的相关信息。Banner等[37]发现,海相碳酸盐岩中发生大规模的白云岩化并没有显著改变碳酸盐岩的REE+Y模式。对原始珊瑚骨骼和新生方解石中REE+Y分布的比较表明,稀土元素在文石转变成方解石的新生变形作用下没有发生显著改变,在新生方解石中保存下来的REE+Y模式与珊瑚骨骼保存的原始稀土模式相似[13]。Shields和Stille[39]发现碳酸盐矿物在沉积之后的成岩蚀变过程中,其稀土元素的配分模式会发生改变,导致Ce/Ce*与Eu/Eu*呈现负相关性。本研究中滨珊瑚骨骼化石样品的Ce/Ce*与Eu/Eu*之间无相关关系(图10A),说明成岩蚀变作用对滨珊瑚骨骼化石样品的影响可以忽略。岩心柱样品中Ce/Ce*与Eu/Eu*的相关系数R2=0.48(图10B),说明该样品可能经过大气淡水的作用,导致部分文石转变成方解石,与之前XRD结果一样,岩心柱样品中出现了少量方解石。
4 讨论
4.1 原始地球化学记录的保存
XRD数据显示,珊瑚礁岩心柱18.40 m处文石含量为76.4%,22.80 m处文石含量为100%,23 m处文石含量为76.3%,同时在扫描电镜中观察发现,22.80、23 m处的样品珊瑚骨架保存完好,文石晶体清晰可见(图11),表明样品的原始地球化学记录保存较好。
4.2 珊瑚礁的REE特征与来源
海相碳酸盐岩的稀土元素配分模式具有以下特征:①LREE亏损,HREE 富集;②La正异常;③Gd较弱的正异常;④高的Y/Ho值;⑤氧化海水中有Ce的负异常[3,40-41]。
化学沉积岩经PAAS标准化后,其La异常能够作为可靠标志来判断沉积水体的特征[1,23,41-42]。海水以及海相碳酸盐岩具有明显的La异常,La/La∗>3[1,41,43],而淡水的 La异常较弱(L a /La∗≈ 2.62),主要与pH值有关[22]。滨珊瑚骨骼化石的La异常较弱,[La/La*]PAAS为1.16~1.69,而其他珊瑚礁样品具有明显的La正异常,[La/La*]PAAS为1.28~2.16。
在氧化水体中,可溶的Ce3+通过氧化锰或细菌的作用被氧化成不溶于水的Ce4+[44]。导致氧化水体中Ce呈现明显的负异常,沉淀的碳酸盐类也会出现明显的Ce负异常[40,44]。而在弱氧或缺氧条件下,由于富Fe-Mn氧化物/氢氧化物的颗粒会发生还原溶解[45],导致Ce4+被还原为Ce3+并释放到水体中,促使Ce在海水中富集,没有Ce的负异常,甚至呈现Ce的正异常。因此,Ce异常可以用来指示氧化还原条件[3,45-46]。滨珊瑚骨骼化石的Ce具有弱的负异常,[Ce/Ce*]PAAS为0.61~1.07,而其他珊瑚礁样品则具有明显的Ce负异常,[Ce/Ce*]PAAS为0.30~0.72,代表了周围水体呈氧化状态。
Y和Ho的电荷数与离子半径相似[42],在地质环境中的行为也一致[42]。Kawabe等[47]指出,由于Y和REE3+中存在或缺失4f电子层的热化学效应,Y在水环境中的行为可能不同于Ho,尽管两者的离子半径相似,但两者有不同的配位性质,使得它们在水溶液中的化学行为差异较大。海水中Ho的移除速率是Y的两倍[48],导致从太古宙到现代的海相碳酸盐岩都具有较高的Y/Ho值(>44)[20,36,41]。在现代海水的研究中,日本附近的北太平洋西部海域的Y/Ho比值为103.48[49],北大西洋表层海水的Y/Ho比值为83.82[50]。滨珊瑚骨骼化石的Y/Ho比值为81~106,其他层位珊瑚礁样品的Y/Ho为41~78,与海相碳酸盐岩的Y/Ho比值特征相近。
本文珊瑚礁样品具有LREE亏损、Ce负异常、La正异常和高的Y/Ho比值,符合正常海相碳酸盐岩稀土元素配分模式,代表了氧化条件下正常的海洋环境。而滨珊瑚骨骼化石具有LREE亏损、Ce负异常、La正异常、Eu正异常和高的Y/Ho比值,与岩心柱样品稀土元素配分模式相比,滨珊瑚骨骼化石样品具有明显的Eu正异常,[Eu/Eu*]PAAS为1.34~2.94(图4B)。对于海相碳酸盐岩,Eu正异常通常存在于pH=7的高温、高还原性或富含氯化物的溶液[51]。而正常的海洋环境中不存在Eu异常[52-53]。因此,滨珊瑚骨骼化石的稀土元素配分模式不符合正常海相碳酸盐岩稀土元素配分模式,不能代表正常的海洋环境。
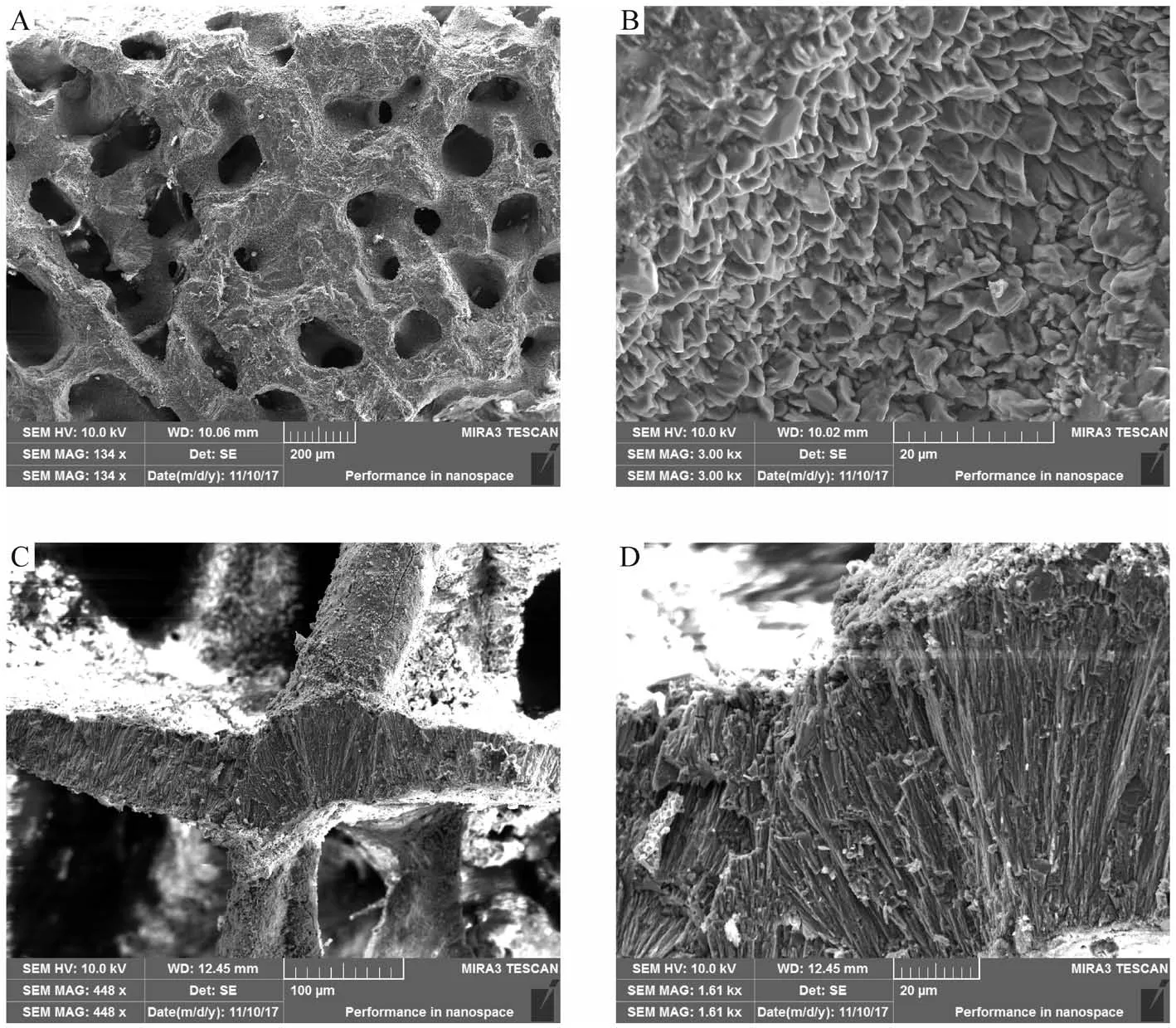
图11 滨珊瑚骨骼化石扫描电镜图片A.23 m 珊瑚骨架(134x),B.23 m 文石(500x),C.22.80 m 珊瑚骨架(989x),D.22.80 m 文石(3.00kx)。Fig.11 Scanning electron microscope picture of Porites skeleton fossil A.coral skeleton at 23 m (134x),B.aragonite at 23 m (500X),C.coral skeleton at 22.80 m (989x),D.aragonite at 22.80 m (3.00kx).
4.3 滨珊瑚骨骼样品的Eu异常特征及其指示意义
通常情况下,化学沉积岩的Eu异常是由以下情况导致:①长石风化,若碳酸盐岩中含长石,则风化过程中会释放出Eu2+[54],不过,这种可能性可通过Eu异常与[Pr/Yb]PAAS或[Pr/Tb]PAAS之间的相关性进行判断,若它们之间没有相关性,则可以排除由于长石风化导致Eu正异常的可能性[23,55]。我们的样品中,滨珊瑚骨骼化石样品的Eu异常与[Pr/Yb]PAAS相关系数为0.12(图12A),Eu异常与[Pr/Tb]PAAS相关系数为0.20(图12B),表明Eu异常与[Pr/Yb]PAAS或[Pr/Tb]PAAS之间没有任何相关性,而且由于西沙生物礁碳酸盐台地为大陆坡孤立型碳酸盐台地,中间有西沙海槽与陆架相隔,陆源碎屑物质难以到达,因此,可以排除长石风化导致的珊瑚骨骼化石的Eu正异常;②高温(>200 ℃)、还原性热液流体的参与[48,56-58]。由于热液是热的酸性流体穿过海底玄武岩形成的,所以热液流体中的Eu呈+2价态。热液流体可能以高温热液流体和低温热液流体两种不同形式存在。在这两种体系下,稀土元素配分模式也是不同的。现代海洋中的高温体系(>250 ℃)下的流体,如洋中脊或弧后扩张中心,常具有明显的 Eu/Eu*正异常[48,57,59];而低温(<200 ℃)[42,57]或距离热液区比较远的地带[60],Eu/Eu*则具有弱异常或无异常,并具有高的Sm/Yb值。Bau等[59]发现,尽管溶解的Eu由于较冷海水的传导或混合而被重新氧化,但正Eu异常仍然能保存在低温沉淀中。因此,Eu异常可以看作是高温热液的残余记忆,而只有当热液与大量的海水稀释时,Eu异常才会消失。根据稀土配分形式,滨珊瑚骨骼化石具有明显的Eu正异常,指示了热液流体的加入。根据热液流体与正常海水之间的混合模型,至少有0.1%的热液加入才能形成滨珊瑚骨骼化石的Eu/Eu*比值(图13A),同时Sm/Yb和Eu/Sm也表明至少有0.1%左右的热液加入(图13B)。
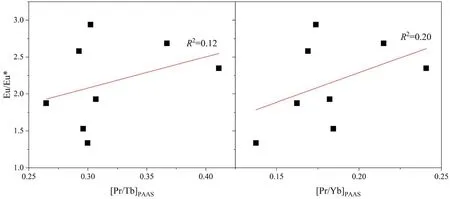
图12 滨珊瑚骨骼化石的Eu/Eu*与[Pr/Yb]PAAS及[Pr/Tb]PAAS相关图Fig.12 Correlation between Eu/Eu* and [Pr/Yb]PAAS or [Pr/Tb]PAAS of Porites skeleton fossil

图13 计算了标准化水样和PAAS端元的REY模式(注:绿色三角为岩心柱数据,红色三角形为滨珊瑚骨骼化石数据,海水端元数据引自文献[49],热液端元数据引自文献[48])Fig.13 Calculated the REY pattern of standardized water samples and PAAS end elements(Note: green triangle is core column data,red triangle is Porites skeleton fossil data,seawater end metadata is quoted from reference[49],hydrothermal end metadata is quoted from reference[48])
关于这部分热液来源,目前还不明确。南海及西沙海域附近的地震资料显示,晚中新世以来南海北部海域有强烈的火山活动[61-62],其中琼北永昌村发现晚更新世(0.11±0.03) Ma 的火山岩[63]。西沙南部及中部在第四纪也出现大量的火山活动[64],高尖石岛是西沙唯一的火山岛,在第四纪有喷发记录[65]。而石岛与永兴岛之间存在的活动断裂,可能为岩浆上涌提供了良好的通道[66]。因此,滨珊瑚骨骼化石样品出现的Eu正异常可能记录了与高尖石岛或海南岛火山喷发有关的热液活动。海底或陆地火山喷发引发的富Eu热液流体进入西沙海域周围的海水,被滨珊瑚吸收并记录下来。虽然后来热液流体减少,温度降低,但滨珊瑚骨骼中的Eu异常仍然保留了下来。
综上所述,本文样品所处的环境整体上可以很好地判断为具有氧化条件的海洋环境,而其中的滨珊瑚骨骼化石样品可能受到附近的火山喷发影响,所以出现了明显的Eu正异常,代表了一种受热液影响的氧化的海洋环境。
5 结论
本研究中的珊瑚样品大部分具有海相稀土元素配分特征:①均一的LREE亏损和HREE富集;②La正异常;③高Y/Ho比值(>44);④氧化海水中沉积的碳酸盐岩具有Ce负异常。然而滨珊瑚骨骼化石样品中除了正常海水稀土元素配分特征外,还表现为明显的Eu正异常和微弱的Ce正异常。经过对Eu和La、Ce异常的分析得出该样品处在有热液侵入的氧化环境。尽管目前还没有找到当时火山活动的相关资料,但是稀土元素配分模式表明了在珊瑚骨板生长阶段,至少有0.1%的热液流体加入珊瑚生长水体中,为珊瑚骨板的生长提供了必要的条件,在后续的研究中,将对其他地球化学指标进行测试,以佐证该结论。本文的研究利用其中的珊瑚样品提供了一个高分辨率的分析,并提出了可能具有热液的影响的猜想,为以后的研究提供了一个方向。
致谢:感谢中国科学院深海科学与工程研究所吴时国研究员和陈万利博士对样品采集的帮助。感谢中国科学技术大学夏梅博士在XRD测试上的帮助。
参考文献(References)
[1]Kamber B S,Webb G E.The geochemistry of late Archaean microbial carbonate: implications for ocean chemistry and continental erosion history [J].Geochimica et Cosmochimica Acta,2001,65(15): 2509-2525.
[2]Bolhar R,Van Kranendonk M J,Kamber B S.A trace element study of siderite-jasper banded iron formation in the 3.45 Ga Warrawoona Group,Pilbara Craton-Formation from hydrothermal fluids and shallow seawater [J].Precambrian Research,2005,137(1-2): 93-114.
[3]Bolhar R,Van Kranendonk M J.A non-marine depositional setting for the northern Fortescue Group,Pilbara Craton,inferred from trace element geochemistry of stromatolitic carbonates [J].Precambrian Research,2007,155(3-4): 229-250.
[4]Jiang S Y,Zhao H X,Chen Y Q,et al.Trace and rare earth element geochemistry of phosphate nodules from the lower Cambrian black shale sequence in the Mufu Mountain of Nanjing,Jiangsu province,China [J].Chemical Geology,2007,244(3-4): 584-604.
[5]Nothdurft L D,Webb G E,Kamber B S.Rare earth element geochemistry of Late Devonian reefal carbonates,canning basin,Western Australia: confirmation of a seawater REE proxy in ancient limestones [J].Geochimica et Cosmochimica Acta,2004,68(2): 263-283.
[6]Jiang W,Yu K F,Fan T L,et al.Coral reef carbonate record of the Pliocene-Pleistocene climate transition from an atoll in the South China Sea [J].Marine Geology,2019,411: 88-97.
[7]赵美霞,余克服,张乔民.珊瑚礁区的生物多样性及其生态功能[J].生态学报,2006,26(1):186-194.[ZHAO Meixia,YU Kefu,ZHANG Qiaomin.Review on coral reefs biodiversity and ecological function [J].Acta Ecologica Sinica,2006,26(1): 186-194.]
[8]Fallon S J,White J C,McCulloch M T.Poritescorals as recorders of mining and environmental impacts: misima Island,Papua New Guinea [J].Geochimica et Cosmochimica Acta,2002,66(1): 45-62.
[9]Webster J M,Braga J C,Humblet M,et al.Response of the Great Barrier Reef to sea-level and environmental changes over the past 30,000 years [J].Nature Geoscience,2018,11(6): 426-432.
[10]余克服.南海珊瑚礁及其对全新世环境变化的记录与响应[J].中国科学: 地球科学,2012,55(8):1217-1229.[YU Kefu.Coral reefs in the South China Sea: their response to and records on past environmental changes [J].Science China Earth Sciences,2012,55(8): 1217-1229.]
[11]Kasper-Zubillaga J J,Armstrong-Altrin J S,Rosales-Hoz L.Geochemical study of coral skeletons from the Puerto Morelos Reef,southeastern Mexico [J].Estuarine,Coastal and Shelf Science,2014,151: 78-87.
[12]Sholkovitz E,Shen G T.The incorporation of rare earth elements in modern coral [J].Geochimica et Cosmochimica Acta,1995,59(13):2749-2756.
[13]Webb G E,Nothdurft L D,Kamber B S,et al.Rare earth element geochemistry of scleractinian coral skeleton during meteoric diagenesis: a sequence through neomorphism of aragonite to calcite [J].Sedimentology,2009,56(5): 1433-1463.
[14]陈万利,吴时国,黄晓霞,等.西沙群岛晚第四纪碳酸盐岩淡水成岩作用——来自永兴岛SSZK1钻孔的地球化学响应证据[J].沉积学报, http://doi.org/10.14027/j.issn.1000-0550.2020.006.[CHEN WanLi,WU ShiGuo,HUANG XiaoXia,et al.Geochemical signatures in the Late Quaternary meteoric diagenetic carbonate succession,Xisha Islands,South China Sea [J].Acta Sedimentologica Sinica,http://doi.org/10.14027/j.issn.1000-0550.2020.006.]
[15]Zhang R X,Yang S Y.A mathematical model for determining carbon coating thickness and its application in electron probe microanalysis [J].Microscopy and Microanalysis,2016,22(6): 1374-1380.
[16]Zhang X,Yang S Y,Zhao H,et al.Effect of beam current and diameter on electron probe microanalysis of carbonate minerals [J].Journal of Earth Science,2019,30(4): 834-842.
[17]廖泽波,邵庆丰,李春华,等.MC-ICP-MS标样-样品交叉测试法测定石笋样品的230Th/U年龄[J].质谱学报,2018,39(3):295-309.[LIAO Zebo,SHAO Qingfeng,LI Chunhua,et al.Measurement of U/Th Isotopic Compositions in stalagmites for230Th/U geochronology using MC-ICP-MS by standard-sample bracketing method [J].Journal of Chinese Mass Spectrometry Society,2018,39(3): 295-309.]
[18]李晓,刘娜,吴仕玖,等.南海西沙群岛西科1井上新统-全新统碳酸盐岩微相分析[J].科技导报,2016,34(7):103-110.[LI Xiao,LIU Na,WU Shijiu,et al.Analysis of carbonate microfacies in Pliocene-Holocene,in Well XK-1,the Xisha Islang,South China Sea [J].Science & Technology Review,2016,34(7): 103-110.]
[19]解习农,谢玉洪,李绪深,等.南海西科1井碳酸盐岩生物礁储层沉积学: 层序地层与沉积演化[M].武汉: 中国地质大学出版社,2016.[XIE Xinong,XIE Yuhong,LI Xushen,et al.Sedimentology of carbonate reef reservoirs in Well Xike-1,South China Sea: Sequence Stratigraphy and Sedimentary Evolution[M].Wuhan: China University of Geosciences,2016.]
[20]Van Kranendonk M J,Webb G E,Kamber B S.Geological and trace element evidence for a marine sedimentary environment of deposition and biogenicity of 3.45 Ga stromatolitic carbonates in the PilbaraCraton,and support for a reducing Archaean ocean [J].Geobiology,2003,1(2): 91-108.
[21]Frimmel H E.Trace element distribution in Neoproterozoic carbonates as palaeoenvironmental indicator [J].Chemical Geology,2009,258(3-4): 338-353.
[22]Lawrence M G,Greig A,Collerson K D,et al.Rare earth element and yttrium variability in South East Queensland waterways [J].Aquatic Geochemistry,2006,12(1): 39-72.
[23]Zhao Y Y,Zheng Y F,Chen F K.Trace element and strontium isotope constraints on sedimentary environment of Ediacaran carbonates in southern Anhui,South China [J].Chemical Geology,2009,265(3-4):345-362.
[24]Bayon G,German C R,Burton K W,et al.Sedimentary Fe-Mn oxyhydroxides as paleoceanographic archives and the role of aeolian flux in regulating oceanic dissolved REE [J].Earth and Planetary Science Letters,2004,224(3-4): 477-492.
[25]Byrne R H,Liu X W,Schijf J.The influence of phosphate coprecipitation on rare earth distributions in natural waters [J].Geochimica et Cosmochimica Acta,1996,60(17): 3341-3346.
[26]Zhao M Y,Zheng Y F.A geochemical framework for retrieving the linked depositional and diagenetic histories of marine carbonates [J].Earth and Planetary Science Letters,2017,460: 213-221.
[27]Zhao M Y,Zheng Y F.Marine carbonate records of terrigenous input into Paleotethyan seawater: Geochemical constraints from Carboniferous limestones [J].Geochimica et Cosmochimica Acta,2014,141: 508-531.
[28]Haley B A,Klinkhammer G P,McManus J.Rare earth elements in pore waters of marine sediments [J].Geochimica et Cosmochimica Acta,2004,68(6): 1265-1279.
[29]Bayon G,Birot D,Ruffine L,et al.Evidence for intense REE scavenging at cold seeps from the Niger Delta margin [J].Earth and Planetary Science Letters,2011,312(3-4): 443-452.
[30]Kidder D L,Krishnaswamy R,Mapes R H.Elemental mobility in phosphatic shales during concretion growth and implications for provenance analysis [J].Chemical Geology,2003,198(3-4): 335-353.
[31]Kamber B S,Webb G E,Gallagher M.The rare earth element signal in Archaean microbial carbonate: information on ocean redox and biogenicity [J].Journal of the Geological Society,2014,171(6): 745-763.
[32]Barnard L A,Macintyre I G,Pierce J W.Possible environmental index in tropical reef corals [J].Nature,1974,252(5480): 219-220.
[33]Porta G D,Webb G E,McDonald I.REE patterns of microbial carbonate and cements from Sinemurian (Lower Jurassic) siliceous sponge mounds (Djebel Bou Dahar,High Atlas,Morocco) [J].Chemical Geology,2015,400: 65-86.
[34]Mc Lennan S M,Bock B,Hemming S R,et al.The roles of provenance sedimentary processes in the geochemistry of sedimentary rocks[M]//Lentz D R.Geological Association of Canada Short Course Notes.Toronto: Geological Association of Canada,2003.
[35]Sholkovitz E R,Piepgras D J,Jacobsen S B.The pore water chemistry of rare earth elements in Buzzards Bay sediments [J].Geochimica Et Cosmochimica Acta,1989,53(11): 2847-2856.
[36]Webb G E,Kamber B S.Rare earth elements in Holocene reefal microbialites: a new shallow seawater proxy [J].Geochimica Et Cosmochimica Acta,2000,64(9): 1557-1565.
[37]Banner J L,Hanson G N,Meyers W J.Rare earth element and nd isotopic variations in regionally extensive dolomites from the burlington-keokuk formation (Mississippian): implications for REE mobility during carbonate diagenesis [J].Journal of Sedimentary Research,1988,58(3): 415-432.
[38]Kim J H,Torres M E,Haley B A,et al.The effect of diagenesis and fluid migration on rare earth element distribution in pore fluids of the northern Cascadia accretionary margin [J].Chemical Geology,2012,291: 152-165.
[39]Shields G,Stille P.Diagenetic constraints on the use of cerium anomalies as palaeoseawater redox proxies: an isotopic and REE study of Cambrian phosphorites [J].Chemical Geology,2001,175(1-2):29-48.
[40]Bau M,Koschinsky A,Dulski P,et al.Comparison of the partitioning behaviours of yttrium,rare earth elements,and titanium between hydrogenetic marine ferromanganese crusts and seawater [J].Geochimica et Cosmochimica Acta,1996,60(10): 1709-1725.
[41]Shields G A,Webb G E.Has the REE composition of seawater changed over geological time? [J].Chemical Geology,2004,204(1-2): 103-107.
[42]Bau M.Controls on the fractionation of isovalent trace elements in magmatic and aqueous systems: evidence from Y/Ho,Zr/Hf,and lanthanide tetrad effect [J].Contributions to Mineralogy and Petrology,1996,123(3): 323-333.
[43]Bau M,Dulski P.Distribution of yttrium and rare-earth elements in the Penge and Kuruman iron-formations,Transvaal Supergroup,South Africa [J].Precambrian Research,1996,79(1-2): 37-55.
[44]Tanaka K,Tani Y,Takahashi Y,et al.A specific Ce oxidation process during sorption of rare earth elements on biogenic Mn oxide produced byAcremoniumsp.strain KR21-2 [J].Geochimica et Cosmochimica Acta,2010,74(19): 5463-5477.
[45]German C R,Elderfield H.Application of the Ce anomaly as a paleoredox indicator: the ground rules [J].Paleoceanography,1990,5(5): 823-833.
[46]Ling H F,Chen X,Li D,et al.Cerium anomaly variations in Ediacaran-earliest Cambrian carbonates from the Yangtze Gorges area,South China: implications for oxygenation of coeval shallow seawater [J].Precambrian Research,2013,225: 110-127.
[47]Kawabe I,Kitahara Y,Naito K.Non-chondritic yttrium/holmium ratio and lanthanide tetrad effect observed in pre-Cenozoic limestones [J].Geochemical Journal,1991,25(1): 31-44.
[48]Bau M,Dulski P.Comparing yttrium and rare earths in hydrothermal fluids from the Mid-Atlantic Ridge: implications for Y and REE behaviour during near-vent mixing and for the Y/Ho ratio of Proterozoic seawater [J].Chemical Geology,1999,155(1-2): 77-90.
[49]Alibo D S,Nozaki Y.Rare earth elements in seawater: Particle association,shale-normalization,and Ce oxidation [J].Geochimica et Cosmochimica Acta,1999,63(3-4): 363-372.
[50]Luong L D,Ryuichi S,Nguyen H,et al.Spatial variations in dissolved rare earth element concentrations in the East China Sea water column [J].Marine Chemistry,2018,205: 1-15.
[51]Michard A,Albarède F,Michard G,et al.Rare-earth elements and uranium in high-temperature solutions from East Pacific Rise hydrothermal vent field (13°N) [J].Nature,1983,303(5920): 795-797.
[52]German C R,Klinkhammer G P,Edmond J M,et al.Hydrothermal scavenging of rare-earth elements in the ocean [J].Nature,1990,345(6275): 516-518.
[53]Chen D Z,Qing H R,Yan X,et al.Hydrothermal venting and basin evolution (Devonian,South China): constraints from rare earth element geochemistry of chert [J].Sedimentary Geology,2006,183(3-4):203-216.
[54]Kamber B S,Greig A,Collerson K D.A new estimate for the composition of weathered young upper continental crust from alluvial sediments,Queensland,Australia [J].Geochimica et Cosmochimica Acta,2005,69(4): 1041-1058.
[55]Wang Q X,Lin Z J,Chen D F.Geochemical constraints on the origin of Doushantuo cap carbonates in the Yangtze Gorges area,South China [J].Sedimentary Geology,2014,304: 59-70.
[56]Michard A,Albarède F.The REE content of some hydrothermal fluids [J].Chemical Geology,1986,55(1-2): 51-60.
[57]Alexander B W,Bau M,Andersson P,et al.Continentally-derived solutes in shallow Archean seawater: rare earth element and Nd isotope evidence in iron formation from the 2.9 Ga Pongola Supergroup,South Africa [J].Geochimica et Cosmochimica Acta,2008,72(2): 378-394.
[58]Robbins L J,Lalonde S V,Planavsky N J,et al.Trace elements at the intersection of marine biological and geochemical evolution [J].Earth-Science Reviews,2016,163: 323-348.
[59]Bau M,Balan S,Schmidt K,et al.Rare earth elements in mussel shells of theMytilidaefamily as tracers for hidden and fossil hightemperature hydrothermal systems [J].Earth and Planetary Science Letters,2010,299(3-4): 310-316.
[60]Johannessen K C,Roost J V,Dahle H,et al.Environmental controls on biomineralization and Fe-mound formation in a low-temperature hydrothermal system at the Jan Mayen Vent Fields [J].Geochimica et Cosmochimica Acta,2017,202: 101-123.
[61]Ho K S,Chen J C,Juang W S.Geochronology and geochemistry of late Cenozoic basalts from the Leiqiong area,Southern China [J].Journal of Asian Earth Sciences,2000,18(3): 307-324.
[62]孙嘉诗.南海北部及广东沿海新生代火山活动[J].海洋地质与第四纪地质,1991,11(3):45-66.[SUN Jiashi.Cenozoic volcanic activity in the Northern South China Sea and Guangdong coastal area [J].Marine Geology & Quaternary Geology,1991,11(3): 45-66.]
[63]樊祺诚,孙谦,李霓,等.琼北火山活动分期与全新世岩浆演化[J].岩石学报,2004,20(3):533-544.[FAN Qicheng,SUN Qian,LI Ni,et al.Periods of volcanic activity and magma evolution of Holocene in North Hainan Island [J].Acta Petrologica Sinica,2004,20(3): 533-544.]
[64]冯英辞,詹文欢,孙杰,等.西沙海域上新世以来火山特征及其形成机制[J].热带海洋学报,2017,36(3):73-79.[FENG Yingci,ZHAN Wenhuan,SUN Jie,et al.The formation mechanism and characteristics of volcanoes in the Xisha waters since Pliocene [J].Journal of Tropical Oceanography,2017,36(3): 73-79.]
[65]邹和平.试谈南海海盆地壳属性问题—由南海海盆及其邻区玄武岩的比较研究进行讨论[J].大地构造与成矿学,1993,17(4):293-303.[ZOU Heping.On the problem about the crust’s attribution of South China Sea basin-discussion from comparative study on basalts of seamounts in South China Sea basin and the neighboring areas [J].Geotectonica et Metallogenia,1993,17(4): 293-303.]
[66]吕炳全,王国忠,全松青,等.试论西沙群岛石岛的形成[J].地质科学,1986(1):82-89.[LV Bingquan,WANG Guozhong,QUAN Songqing,et al.A preliminary study of the formation of Shidao Island,Xisha Islands [J].Chinese Journal of Geology,1986(1): 82-89.]
