银杏二萜内酯对脑缺血大鼠学习记忆能力的影响及机制研究
2020-08-26霍好利
霍好利
缺血性脑卒中是导致血管性痴呆的主要病因,而学习记忆功能障碍是其早期的主要临床表现[1,2]。银杏二萜内酯类主要来自于银杏叶,其银杏二萜内酯葡胺注射液(diterpene ginkgolides meglumine injection,DGMI)主要是由银杏内酯组成,研究发现DGMI能够抑制氧化应激和抑制体内的细胞凋亡[3-6],但其是否可以改善患者脑缺血后的学习记忆能力尚未见文献报道,本实验将复制脑缺血大鼠模型并行DGMI治疗,从而研究DGMI对患者脑缺血后的影响和作用机制。
1 材料与方法
1.1 实验动物 河北省实验动物中心购买健康清洁级的雄性SD大鼠(8周龄,体重220~260 g,动物合格证号:201809014)。大鼠饲养温度23℃~25℃,饲养环境的相对湿度为55%~60%,饲养光照的周期为12 h∶12 h,大鼠在适应性饲养1周后再进行实验,且手术前需常规24 h禁食,可以自由饮水。
1.2 药物与试剂 江苏康缘药业股份有限公司生产的DGMI(规格:25 mg∶5 ml,批号:20170416);北京博奥森生物技术有限公司生产的TUNEL试剂盒(批号:170417);上海碧云天生物技术有限公司生产的Bcl-2抗体(批号:071209)、Bax抗体(批号:180113)和ABC-DAB(批号:180107)等试剂盒;南京建成生物工程研究所生产的超氧化物歧化酶(SOD,批号:20170404)、过氧化氢酶(CAT,批号:20170513)、丙二醛(MDA,批号:20170124)等试剂盒。
1.3 实验仪器 生化分析仪(深圳迈瑞生物医疗电子股份有限公司);采用北京麦克奥迪仪器仪表有限公司生产的Image-Pro Plus 6.0图像分析系统;L-80XP型低温超速离心机(美国Beckman公司);FSH-Ⅱ型匀浆器(江苏金坛国胜实验仪器厂)。
1.4 分组、模型制备与给药 应用随机数字法将200只实验用大鼠随机分为假手术组和模型组,每组100例。按照DGMI剂量分为低(剂量1.5 mg·kg-1·d-1)、中(剂量3 mg·kg-1·d-1)、高(剂量6 mg·kg-1·d-1)剂量组,每组40只。根据王钊楠等[7]实验报道,制备慢性脑缺血大鼠模型需采用结扎双侧颈总动脉的方法,但是假手术组仅需游离颈总动脉不进行结扎。精确称取DGMI,加入适量0.9%氯化钠溶液配置浓度为0.75 mg/ml的DGMI溶液,然后加入0.9%氯化钠溶液依次配置浓度为1.5 mg/ml、3 mg/ml的DGMI溶液,各组均于术后第2天开始腹腔注射给药治疗(2 ml/kg),疗程14 d,假手术组和模型组同步腹腔注射给予等体积的0.9%氯化钠溶液(2 ml/kg)。
1.5 Morris水迷宫实验和跳台实验评价大鼠学习记忆能力
1.5.1 水迷宫实验:将Morris水迷宫装置(直径1.3 m、深度0.5 m)置于暗室,添加适量水并设置恒温25℃水温,将圆形水面按十字法划分为4个象限(Ⅰ、Ⅱ、Ⅲ、Ⅳ),于第Ⅲ象限水面下2 cm设置直径10 cm、高30 cm的安全平台,安置摄像机记录大鼠运动轨迹。①定位航行试验:正式试验前1 d,每只大鼠均适应性训练120 s;将大鼠分别在4个象限面放入水迷宫的池壁中,然后记录大鼠2 min内游泳的轨迹和逃避潜伏的时间,大鼠到达安全平台后需停留30 s,如果大鼠2 min 内未找到安全平台,就将大鼠的逃避潜伏期记为120 s,每只大鼠均连续进行5 d、取平均值。②空间探索试验:在定位航行试验结束后的第2天,将安全平台撤去,把所有大鼠放入第Ⅱ象限面,然后观察和记录90 s内大鼠出现在原来设置安全平台的次数。
1.5.2 跳台实验:每组随机抽取10只大鼠,正式试验前1 d放在平台后接通电源,适应性训练180 s;正式试验时,大鼠就直接放在接通铜栅电源的平台上,然后记录大鼠3 min内的错误次数和承受电击的总时间。
1.6 大脑海马CA1区行病理学检查 每组均随机抽取10只大鼠,在大鼠深度麻醉后进行断头取脑,并将嗅球、小脑和低位脑干去除,采用浓度为4%的多聚甲醛溶液固定3 d,进行石蜡包埋、切片和脱蜡水化等操作,再进行常规HE染色(先用乙醇梯度进行脱蜡、PBS洗涤,再用苏木素进行5 min染色,之后用浓度为0.5%的乙醇盐酸进行分色、采用尹红染色20 s等),染色后再利用倒置光学显微镜去观察实验大鼠大脑海马CA1区的神经元形态。
1.7 TUNEL染色法观察大脑海马CA1区细胞凋亡状况 取1.5制备的脑组织切片,经乙醇梯度脱蜡水化处理后,按照TUNEL试剂盒步骤进行染色(细胞核黄褐色着色为阳性着色)。凋亡指数(AI)计算:显微镜下计数细胞总数和凋亡细胞数,AI(%)=(视野中的凋亡细胞数/视野中的细胞总数)×100%,每只大鼠均取5张切片,每张切片需选取5个互不重叠视野取平均值。
1.8 IHC法检测大脑海马CA1区Bcl-2、Bax蛋白表达 取1.5制备的组织石蜡切片,经乙醇梯度脱蜡水化处理后,按照Bcl-2、Bax试剂盒操作步骤,采用ABC-DAB法进行IHC操作[依次进行3% H2O2-甲醇溶液孵育25 min、血清封闭1.5 h、一抗(1∶500)4℃过夜、二抗(1∶200)室温孵育1.5 h、DAB显色5 min等],通过倒置光学显微镜观察(黄褐色为阳性着色)。每只大鼠取5张切片,每张切片取5个互不重叠的视野,通过Image Pro plus图像分析系统测定图片灰度,进行半定量分析。
1.9 比色法测定大脑海马区的抗氧化酶的活性与MDA的含量 将每组剩余10只大鼠进行麻醉,然后断头取脑,将海马组织剥取后研磨匀浆,在3 000 r/min的低温(4℃)下进行离心,15 min后取上清液,然后按照步骤处理,再用紫外-可见分光光度计来测定抗氧化酶的活性和MDA的含量情况。
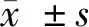
2 结果
2.1 学习记忆能力测定结果 (1)Morris水迷宫实验:与假手术组比较,模型组大鼠逃避潜伏期和逃避路程均显著增长(P<0.01);而脑缺血大鼠在DGMI中、高剂量治疗2周后能降低逃避潜伏期和缩短逃避的路程,差异有统计学意义(P<0.05或P<0.01)。模型组大鼠穿越原设安全平台位置的次数少于假手术组大鼠(P<0.01);脑缺血大鼠采用DGMI中、高剂量治疗2周后穿越原平台位置次数高于模型组大鼠(P<0.05或P<0.01)。(2)跳台实验:与假手术组比较,模型组大鼠错误次数显著增多且受电击总时间显著延长(P<0.01);而与模型组比较,脑缺血大鼠经DGMI中、高剂量治疗14 d后犯错误次数减少且受电击时间缩短(P<0.05或P<0.01)。见表1、2。
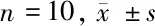
表1 5组大鼠Morris水迷宫实验结果
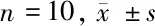
表2 5组大鼠跳台实验结果
2.2 大脑海马CA1区病理学结果 假手术组大鼠海马CA1区形态结构未见异常,而模型组大鼠海马CA1区则呈现明显的病理性改变,主要表现为神经元的层次紊乱、神经元数量减少且细胞间隙呈增大趋势,胶质细胞也有所增加,胞核固缩或是溶解,核仁消失;与模型组比较,经DGM治疗14 d能够明显改善脑缺血大鼠大脑海马CA1区组织形态和神经元结构病变,其中DGMI高剂量组上述效果最为显著。见图1。
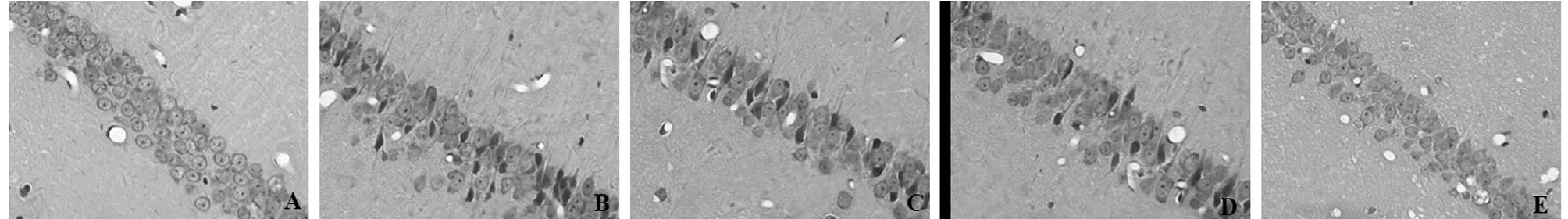
图1 5组大脑海马CA1区病理学检查结果(HE×400);A 假手术组;B 模型组;C DGMI低剂量组;D DGMI中剂量组;E DGMI剂量组
2.3 大鼠大脑海马CA1区的细胞凋亡结果观察 与假手术组比较,模型组大鼠大脑海马CA1区凋亡细胞(经TUNEL染色阳性着色:凋亡的细胞核呈黄褐色)数量明显高于假手术组;而与模型组比较,经DGM治疗14 d后脑缺血大鼠大脑海马CA1区凋亡细胞数量减少,DGMI剂量组减少效果最为显著。模型组大鼠与假手术组大鼠大脑海马CA1区细胞凋亡指数(AI)比较,呈显著升高趋势[(65.03±8.71)%vs(2.69±1.08)%,P<0.01],而与模型组比较,DGMI中、高剂量组AI显著降低[(40.92±6.75)%、(16.94±3.37)% vs(65.03±8.71)%,P<0.01]。见图2。
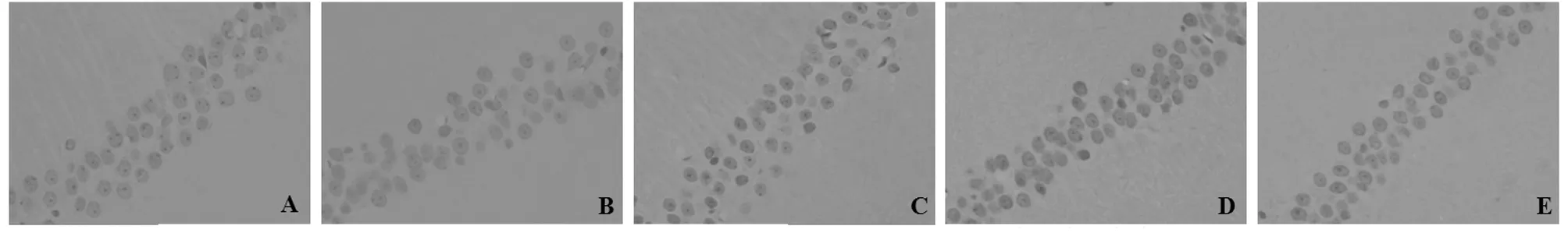
图2 5组大鼠大脑海马CA1区细胞凋亡状况(TUNEL×400);A 假手术组;B 模型组;C DGMI低剂量组;D DGMI中剂量组;E DGMI剂量组
2.4 大脑海马CA1区Bcl-2、Bax蛋白表达检测结果 细胞质通过Bcl-2蛋白和Bax蛋白进行表达;模型组大鼠与假手术组大鼠比较,大脑海马CA1区Bcl-2蛋白表达下调和灰度值降低(P<0.01),与假手术组大鼠比较Bax蛋白表达上调和灰度值升高(P<0.01),Bcl-2/Bax值显著降低(P<0.01);而与模型组比较,经DGMI中、高剂量治疗14 d后脑缺血大鼠大脑海马CA1区Bcl-2蛋白表达明显上调、Bax表达下调,灰度值差异均有统计学意义(P<0.05或P<0.01),Bcl-2/Bax值显著升高,差异有统计学意义(P<0.01)。见图3、4,表3。

图3 5组大鼠大脑海马CA1区Bcl-2蛋白表达(IHC×400);A 假手术组;B 模型组;C DGMI低剂量组;D DGMI中剂量组;E DGMI剂量组

图4 5组大鼠大脑海马CA1区Bax蛋白表达(IHC×400);A 假手术组;B 模型组;C DGMI低剂量组;D DGMI中剂量组;E DGMI剂量组
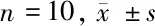
表3 5组大脑海马CA1区Bcl-2、Bax蛋白表达灰度值及Bcl-2/Bax值
2.5 5组抗氧化酶的活性和MDA含量比较 模型组大鼠大脑海马区的抗氧化酶活性比假手术组低,且MDA含量呈升高趋势(P<0.01);经DGMI中、高剂量治疗14 d的大鼠比模型组大鼠的抗氧化酶(SOD、CAT)活性高,还有助于降低MDA的含量,差异有统计学意义(P<0.05或P<0.01)。见表4。
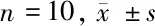
表4 5组大鼠脑组织抗氧化酶活性和MDA含量
3 讨论
血管性痴呆(VD)是缺血性脑卒中后常见的神经功能障碍并发症[8,9],其中学习记忆能力降低是其最主要的早期临床表现[1,2]。随着老龄化的加剧、脑血管疾病发病率的上升,VD患病人群也逐年增多[10]。目前,临床上主要采取抗凝溶栓、改善脑循环等治疗方案,但对于VD的防治作用并不理想,仍是临床上亟待解决的医学难题之一。Morris水迷宫实验和跳台实验是评价学习记忆能力的常用实验方法,能够较好地反映空间学习记忆的形成和维持并且能够量化[11,12],本研究发现,经DGMI治疗能够有效缩短脑缺血大鼠逃避潜伏期和跳台潜伏期、增加跳台次数,提示DGMI对脑缺血所致学习记忆功能障碍具有一定的改善作用。
空间学习记忆与大脑海马区密切相关,其中海马CA1区锥体细胞是形成记忆的重要区域[13]。海马CA1区对锥体细胞缺血缺氧非常敏感,因此脑缺血极容易导致CA1区锥体细胞损伤而导致学习记忆能力降低[14]。既往病理学研究证明,患者出现脑缺血,会引起海马区的神经功能受损,还会引起神经细胞出现继发性凋亡,如果及时挽救患者缺血的半影区神经元,就能抑制患者出现缺血性脑损伤[15]。Bcl-2、Bax蛋白在对于细胞凋亡的调控作用非常重要,二者同源但工作相反[16],Bcl-2表现出抑制细胞凋亡的生理作用,而Bax具有促凋亡的生理作用,并且Bcl-2和Bax能够形成二聚体而双双失活,因此Bcl-2/Bax值更加能够体现二者在细胞凋亡过程中所表现出的实际作用[17]。大鼠出现氧化应激损伤主要是因为大鼠体内的氧自由基出现代谢失衡导致的,而清除体内氧自由基取决于SOD和CAT等关键还原酶[18],MDA是大鼠脂质过氧化反应的终产物,所以能够间接反应大鼠的胰腺组织氧化应激损伤程度的就是胰腺组织的SOD、CAT的活性和MDA的含量[19]。结果显示,大鼠采用DGMI治疗可以显著抑制脑缺血大鼠大脑海马CA1区组织形态和细胞结构病变、抑制海马CA1区细胞凋亡,使海马CA1区的Bcl-2表达上调, Bax表达下调,有助于使Bcl-2/Bax值提高,能使大脑海马区的抗氧化酶活性得到改善,还能使MDA含量得以降低,结果提示脑缺血后采用DGMI治疗能改善其学习的记忆能力,这是因为DGMI抑制大脑海马CA1区神经元病变及该部位细胞凋亡有关。
综上所述,DGMI具有改善脑缺血所致学习记忆功能障碍,这是因为DGMI能够调控体内相关基因(Bcl-2、Bax)的表达,有助于减少氧化应激造成的损伤,与其能抑制大脑海马CA1区神经元病变及该部位细胞凋亡有关。
