β-乳球蛋白、叶酸和视黄醇三元复合物的形成机制及功能性质
2020-08-26包小妹钟俊桢周若楠刘成梅
包小妹,钟俊桢*,周若楠,周 磊,刘成梅
(南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047)
β-乳球蛋白(β-lactoglobulin,β-LG)是牛乳中主要的乳清蛋白,约占总乳清蛋白的50%[1-2],是脂质运载蛋白家族的成员之一,具有多个配体结合位点,能有效包埋、传递和保护生物活性成分使其免受氧化和降解[3]。有研究表明,β-LG可以增加儿茶素的抗氧化性,降低叶酸(folic acid,FA)的光损失[4],提高姜黄素的溶解度[5-6]等。同时,β-LG与这些小分子结合后,在改善和保护小分子功能性质的同时,β-LG自身的结构和功能性质也会发生轻微改变[7-8],Liang Li等[9]研究表明β-LG与FA的相互作用可以降低FA的光解;Abd El-Maksoud等[10]报道β-LG与咖啡酸的非共价结合,提高了β-LG的热稳定性和抗氧化性;赵焕焦等[11]提出β-LG与黑米花色苷的相互作用提高了它的抗氧化性。由此可以看出β-LG与小分子的相互作用是一个互利共赢的过程,β-LG可作为良好的生物活性载体提高保护小分子活性物质溶解度和稳定性。
目前β-LG作为绿色生物载体的研究多集中在与疏水性或两亲性小分子单配体复合物的形成和释放及多个单配体结合位点的竞争等方面[12-13]。但在利用β-LG作为载体提高生物活性成分方面仍然存在一些问题:1)对于β-LG同时与亲水性和疏水性的小分子多元复合物的形成机制不明确;2)β-LG-多配体复合物功能性质尤其是致敏性的变化尚不清晰。
基于食品体系是一个较复杂的体系,可能同时存在β-LG和不同性质的多种小分子活性物质,研究β-LG与多个不同性质的小分子多元复合物的形成机制、探究β-LG-小分子多元复合物的功能特性有助于提高β-LG作为生物载体的利用率,了解小分子与β-LG在食品中的真实状态和它们之间的相互影响。因此,本实验取对预防神经管畸形具有协同功效的亲水性FA和疏水性视黄醇(VA)与β-LG相互作用形成三元复合物,采用荧光光谱探究β-LG与不同性质的小分子多元复合物的形成机制,并对蛋白质的抗氧化性和致敏性进行表征,以期为提高β-LG作为生物载体的利用率及了解疏水性小分子和亲水性小分子与β-LG的相互作用机制提供一定的理论基础。
1 材料与方法
1.1 材料与试剂
牛乳β-LG、FA、VA 美国Sigma公司;所用水均为去离子水;其他试剂均为分析纯。
1.2 仪器与设备
F-7000荧光分光光度计 日本Hitachi公司;SynergyH1酶标仪 美国伯腾仪器有限公司;Ultra-TurraxT25高速分散机 德国IKA公司;FiveEasy Plus pH计梅特勒-托利多仪器(上海)有限公司。
1.3 方法
1.3.1 β-LG、FA和VA复合物的制备
参考Zhang Jie等[14]的方法稍加改进,通过将β-LG和FA分别溶解在pH 7.4、10 mmol/L磷酸盐缓冲液(phosphate buffered saline,PBS)中以获得2 mmol/L的储备溶液,在无水乙醇中制备终浓度为2 mmol/L的VA储备溶液。通过将蛋白质和FA或VA储备溶液添加到PBS中制备β-LG-配体混合物(β-LG的最终浓度为10 μmol/L)。以1 h为间隔顺序将配体储备溶液添加到β-LG溶液中制备含有多种配体的混合物。其中,不同名称(例如β-LG-FA或β-LG-FA-VA)表示配体添加序列。室温下,新鲜制备FA和VA溶液,样品在离心管中制备并用铝箔覆盖,一式三份进行测试。
1.3.2 内源荧光的测定
根据Liu Yan等[15]的方法,测定蛋白质样品的固有荧光光谱,测定10 μmol/L的β-LG溶液中存在不同浓度配体(1、2、5、10、15、20、50 μmol/L)时的荧光光谱。荧光光谱扫描在激发波长295 nm,波长扫描范围290~450 nm,扫描频率240 nm/min,狭缝宽度2.5 nm的条件下进行。以PBS溶液为空白对照。
1.3.3 近紫外圆二色(circular dichroism,CD)光谱分析
制备β-LG质量浓度为1 mg/mL的样品溶液,采用MOS-450光谱偏振计在室温下测量所有样品的CD[16]。路径长度为1 cm的圆柱形石英比色皿用于收集近紫外(250~300 nm)区域的数据。扫描条件:扫描速率100 nm/min,步长分辨率1 nm,带宽2.0 nm。
1.3.4 抗氧化能力的表征
1.3.4.1 1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhdrazyl,DPPH)自由基清除能力测定
结合文献[17]并稍作修改。配制0.2 mmol/L的DPPH反应液,涡旋混匀后,避光静置30 min。取1.5 mL DPPH与0.5 mL样品混匀后,避光反应30 min,于517 nm波长下测定吸光度。DPPH自由基清除率按式(1)计算:
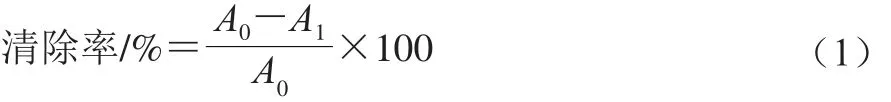
式中:A1为样品吸光度;A0为空白对照的吸光度。1.3.4.2 2,2’-联氮-双-3-乙基苯并噻唑啉-6-磺酸(2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)阳离子自由基清除能力测定
结合文献[18]并稍加修改。ABTS阳离子自由基储备液的制备:将10 mg的ABTS溶于2.6 mL的2.45 mmol/L的高硫酸钾溶液中,在避光室温条件下放置12~16 h。ABTS工作液的制备:使用前将ABTS储备液用pH 7.4的PBS稀释,使其在734 nm波长处测得的吸光度为0.700±0.020。取20 μL样品与ABTS工作液混合,室温下反应60 min,在734 nm波长下测定吸光度,PBS作为空白对照。ABTS阳离子自由基清除能力按式(2)计算:

式中:A1为样品吸光度;A0为空白对照吸光度。
1.3.4.3 铁离子还原/抗氧化能力(ferric ion reducing antioxidant power,FRAP)法
参考李明[19]方法稍作修改,将需要检测的样品与100 μL 1%的铁氰化钾混合均匀,50 ℃反应20 min,然后加入100 μL 10%三氯乙酸,充分混匀,离心,取上清液100 μL,加入100 μL蒸馏水和20 μL 0.1%的FeCl3,室温反应10 min,在700 nm波长处测吸光度。FRAP值按式(3)计算:

式中:A1为样品吸光度;A0为空白对照吸光度。
1.3.5 致敏性的变化
根据Kleber等[20]建立的间接竞争性ELISA并进行一些修改,测量样品的抗原性。使用天然β-LG溶液(2.5 μg/mL)包被9 6 孔微量滴定板,然后使用抗β-LG-IgY(稀释比1∶35 000)和纯化的山羊抗兔IgG∶HRP(稀释比1∶20 000)用于测试样品的抗原反应。通过样品致敏性的抑制率表示抗原抗体结合能力的强弱。在间接竞争ELISA实验中,致敏性的抑制率以式(4)表示:
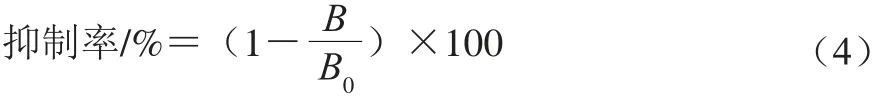
式中:B0为无竞争蛋白时的吸光度;B为各竞争蛋白(检测样品)对应的吸光度。
1.4 数据处理
采用SPSS 19对实验数据进行单因素方差分析(ANOVA),P<0.05,差异显著。所有实验均重复3 组,采用Origin 8.5软件进行绘图。
2 结果与分析
2.1 FA和VA对β-LG荧光光谱的影响
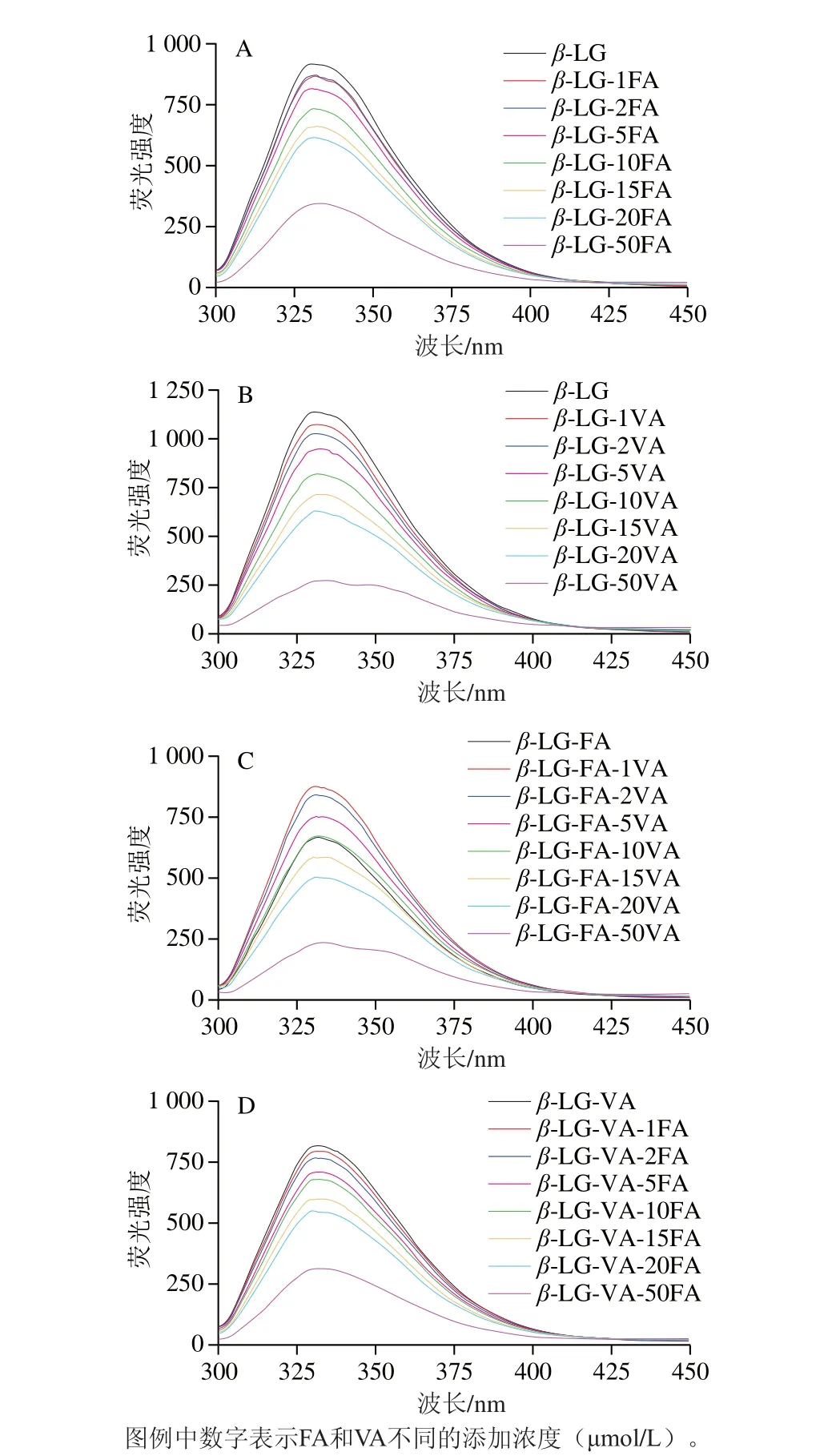
图1 不同浓度FA 和 VA 对 β-LG内源荧光强度的影响Fig. 1 Effect of different concentrations of FA and VA on intrinsic fluorescence intensity of β-LG
β-LG含有色氨酸、酪氨酸和苯丙氨酸等荧光团[21],β-LG与小分子之间的结合会改变荧光团的微环境,从而影响蛋白质的荧光强度[22],可用于表征β-LG与FA和VA之间的相互作用及检测β-LG的构象变化。由图1A、B可知,在激发波长为295 nm时,随着β-LG溶液中FA或VA浓度的逐渐增大,β-LG的内源荧光强度均逐渐减小,证明β-LG分别与FA和VA发生了相互作用,改变了β-LG的构象,使色氨酸和酪氨酸处于更加亲水的环境中,疏水性下降[23]。
进一步探究FA对β-LG-VA荧光强度的影响以及VA对β-LG-FA荧光强度的影响,由图1C、D同样可观察到随着VA和FA浓度的逐渐增加,β-LG-FA和β-LG-VA的荧光强度均逐渐降低,表明在FA存在时,VA可以与β-LG发生相互结合,进一步影响β-LG的空间构象;在VA存在时,FA同样可以与β-LG发生相互结合,并进一步影响β-LG的空间构象。这可能是因为FA和VA在β-LG上有不同的主要结合位点[24]。
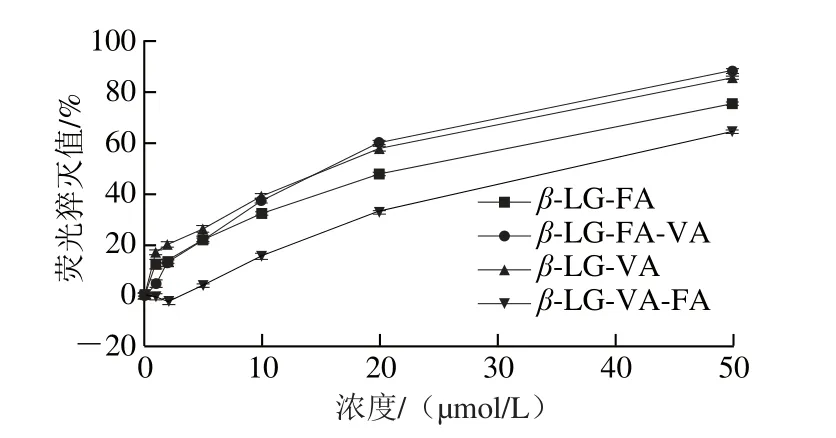
图2 不同FA和VA添加顺序对β-LG荧光强度的猝灭曲线Fig. 2 Quenching curves of fluorescence intensity of β-LG with different addition orders of FA and VA
如图2所示,VA对β-LG和β-LG-FA的荧光猝灭程度几乎相同,这表明FA的存在对VA与β-LG的相互结合几乎没影响。但在β-LG-VA中添加不同浓度的FA时,FA对β-LG-VA荧光强度的猝灭程度弱于对β-LG的猝灭,即VA能减弱FA与β-LG的相互结合,这可能是因为FA在β-LG上只有一个结合位点,而VA在β-LG具有多个结合位点[24]。
2.2 荧光猝灭机制分析
小分子对蛋白质的荧光猝灭一般可分为静态猝灭和动态猝灭[25]。静态猝灭表现为随着温度的升高,复合物的稳定性下降,猝灭速率常数降低;而动态猝灭则相反,且不影响荧光分子的结构[26]。本实验在301 K和311 K下测定了不同浓度的FA和VA对β-LG荧光强度的影响。用Stern-Volmer方程[21]计算猝灭速率常数,从而可以初步判断该反应的荧光猝灭机理:
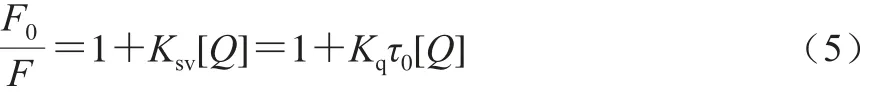
式中:F0为β-LG未加入FA和VA时的荧光强度;F为β-LG加入FA和VA的荧光强度;Kq为猝灭速率常数/(L/(mol·s));Ksv为猝灭常数/(L/mol);[Q]为FA/VA浓度/(mol/L);τ0为无配体加入时蛋白质的平均荧光寿命/s。一般认为,10-8s为生物大分子的平均荧光寿命[8]。
如表1所示,随着温度的升高,β-LG复合物的猝灭速率常数Kq升高,表明FA和VA对β-LG的荧光猝灭可能是动态猝灭。但图3表明β-LG-FA和β-LG-VA的Stern-Volmer曲线并不是线性关系,即FA和VA对β-LG的荧光猝灭并不是单纯的动态猝灭或静态猝灭,而是2 种猝灭机制共存。β-LG-FA-VA和β-LG-VA-FA的Stern-Volmer曲线与β-LG-FA和β-LG-VA的Stern-Volmer曲线具有相似的变化趋势,因此可以推测,在β-LG先与FA/VA相互作用后,再分别添加新的小分子配体VA/FA,同样可以与β-LG发生相互作用,导致蛋白质的内源荧光发生猝灭,且同时存在2 种猝灭机制。
由表1可知,在301 K下,FA和VA分别对β-LG的猝灭速率常数Kq以及VA对β-LG-FA和FA对β-LG-VA的猝灭速率常数Kq分别为3.31×1012、6.40×1012、5.51×1012、3.25×1012L/(mol·s),远大于动态淬灭速率常数(2×1010L/(mol·s)),即FA和VA对β-LG的荧光猝灭机制主要表现为静态猝灭[26],FA和VA与β-LG反应形成二元和三元复合物。
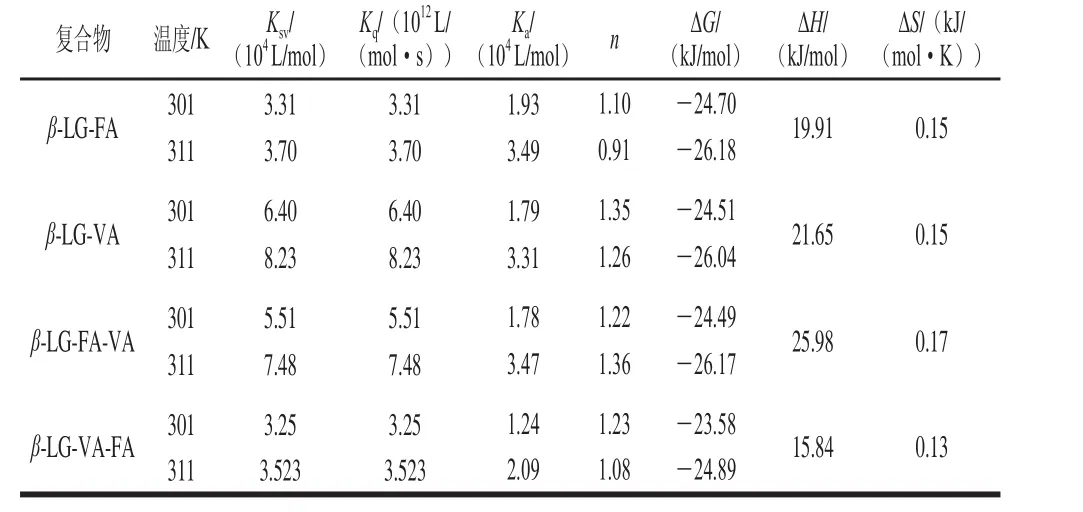
表1 FA和VA与-LG的结合参数和热力学参数Table 1 Binding parameters and thermodynamic parameters of-LG with FA and or VA


图3 β-LG与FA和VA相互作用的Stern-Volmmeerr曲线Fig. 3 Stern-Volmer curves of β-LG interaction with FA and/or VA
2.3 结合常数和结合位点数
由2.2节结果可知,FA和VA对β-LG的荧光猝灭主要是静态猝灭,所以采用Double-log方程[27]计算结合常数Ka、结合位点数n:
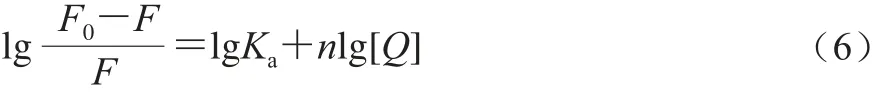
式中:Ka为FA和VA与β-LG之间的结合常数/(L/mol);n为结合位点数,结果显示在表1中。
由于Double-log曲线的R2都大于0.9,线性较好,所以FA/VA对β-LG、VA对β-LG-FA以及FA对β-LG-VA的荧光猝灭主要为静态猝灭是合理的。由表1可知,在301 K的条件下,β-LG对FA和β-LG对VA的Ka和n分别为1.93×104L/mol、1.10和1.79×104L/mol、1.35,结合常数(Ka)的数量级为104,远大于100[28],结合位点数n都在1附近,即一分子的β-L G可以与一分子不同亲疏水性的FA和VA形成较稳定的β-LG-FA和β-LG-VA二元复合物;β-LG-FA对VA以及β-LG-VA对FA的Ka和n分别为1.78×104L/mol、1.22和1.24×104L/mol、1.23,由此可知,β-LG可以与一分子的FA和VA形成较稳定的不同添加顺序的三元复合物β-LGFA-VA和β-LG-VA-FA。通过比较Ka可知,VA的存在会使FA与β-LG的结合减弱,而FA的存在不会降低VA与β-LG的结合,与2.1节不同添加顺序对β-LG荧光强度的猝灭结果一致。但由于不同的结合顺序对β-LG结构和功能的具体影响暂不清楚,因此以β-LG与FA和VA的物质的量比为1进行制样,同时制备不同添加顺序的三元复合物。
2.4 热力学参数
小分子配体与蛋白质之间的非共价相互作用力主要有氢键、范德华力、疏水作用力及静电引力[29]。可以根据热力学参数焓变值(ΔH)和熵变值(ΔS)判断蛋白质-配体之间的非共价相互作用力,这些热力学参数可以通过Van't Hoff方程[30]计算得到:
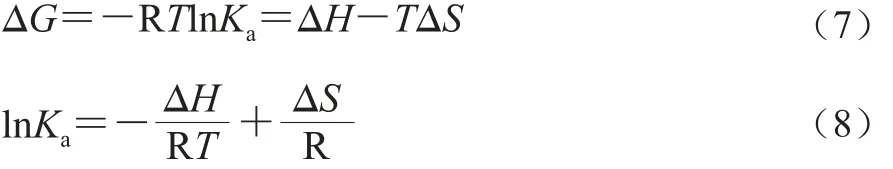
式中:R为气体常数8.314 J/(mol·K);T为实验温度/K;Ka为在相应温度下的结合常数/(L/mol)。
如表1所示,β-LG分别与FA和VA进行反应时,ΔG<0、ΔH>0且ΔS>0,表明β-LG与FA和VA主要通过疏水相互作用力自发的形成二元复合物β-LG-FA和β-LG-VA[25]。进一步探究VA与β-LG-FA和FA与β-LG-VA的相互作用,同样可得ΔG<0、ΔH>0且ΔS>0,因此β-LG与不同添加顺序的FA和VA也是主要通过疏水相互作用力自发的形成三元复合物β-LG-FA-VA和β-LG-VA-FA。这也与前人关于β-LG主要通过疏水相互作用与小分子配体形成复合物的报道相吻合[31-32]。
2.5 近紫外CD分析
使用近紫外CD进一步评估样品在溶液中的三级结构,可以反映蛋白质中酪氨酸、色氨酸、二硫键等残基的微观结构[33],如图4所示。与对照β-LG相比,β-LG-FA的摩尔椭圆率急剧上升,β-LG-VA的摩尔椭圆率急剧下降,特别是280 nm到295 nm波长之间的椭圆率,反映了色氨酸和酪氨酸的特征谱峰,表明FA和VA与β-LG的结合导致色氨酸和酪氨酸微环境发生较大的改变,三级结构变化明显,FA和VA与β-LG形成二元复合物后对β-LG原有的三级结构改变较大。而β-LG-FA-VA和β-LG-VA-FA的摩尔椭圆率与β-LG相比仅略微改变,这可能是VA进一步影响β-LG-FA的构象、FA进一步影响β-LG-VA的构象,反而使其三级结构更接近β-LG的三级结构。

图4 近紫外CCDD图Fig. 4 Near-UV CD spectra
2.6 FA和VA对β-LG抗氧化性的影响
有研究表明β-LG与小分子配体的相互作用可以改变β-LG的功能特性,降低或提高β-LG的抗氧化性[4,12-13],因此本研究采用3 种不同原理的检测方法综合评价FA和VA对β-LG抗氧化性的影响,结果如图5所示。通过DPPH法测定的结果可以看出,β-LG与二元复合物β-LG-FA和β-LG-VA的自由基清除率分别为4.00%、1.98%和3.48%,没有显著性差异。进一步比较β-LG与三元复合物β-LGFA-VA(5.35%)和β-LG-VA-FA(3.64%)的DPPH自由基清除率,也不存在显著性差异,但三元复合物β-LGFA-VA的抗氧化性显著高于二元化合物β-LG-FA;通过ABTS法测定的结果可以看出,相对于β-LG的自由基清除率(22.2 2%)而言,二元复合物β-LG-FA的自由基清除率下降为20.91%,结合近紫外CD的结果可知,这可能与β-LG-FA的构象中色氨酸和酪氨酸处于更加亲水的环境有关[16,33],β-LG-VA的自由基清除率(22.75%)没有显著变化。三元复合物β-LG-FA-VA(23.45%)和β-LG-VA-FA(23.71%)的自由基清 除率显著高于对照组和二元复合物,但β-LG-FA-VA和β-LG-VA-FA之间没有显著差异,由此可知,不同的结合顺序对复合物的抗氧化性没有显著的影响;FRAP法测定的结果表明,相对于β-LG的FRAP(5.26%),β-LG-FA和β-LG-VA的F RAP分别为7.69%和2.7%,没有发生显著的变化。同样与对照组相比,三元复合物β-LG-FA-VA(4.37%)和β-LG-VA-FA(3.56%)的FRAP没有显著性差异,不同的结合顺序对复合物的抗氧化性没有显著影响,但β-LG-FA的FRAP显著大于三元复合物。

图5 FFAA/VVAA对β-LG抗氧化能力的影响Fig. 5 Effect of complexation with FA and/or VA on the antioxidant capacity of β-LG
DPPH和ABTS法测定结果表明β-LG-FA具有较低的自由基清除能力,但FRAP的结果却表现出了较强的还原能力,可能是因为自由基清除能力的检测原理不同于FRAP的原因。FA主要结合在β-LG的α-螺旋和β-桶型结构间表面疏水带[31],改变了游离—SH所处的微环境,β-LG的FRAP主要由存在于β-LG表面的—SH贡献[34],且β-LG-FA的构象变化较大,因此表现出了较强的抗氧化性。
虽然每种检测方法所采用的原理不同,结果之间也会存在差异,但总体而言,二元复合物β-LG-FA的自由基清除能力会有所下降,β-LG-VA则不会发生显著的变化,三元复合物β-LG-FA-VA和β-LG-VA-FA的抗氧化能力并不会降低,且不同的结合顺序对复合物的抗氧化性没有显著的影响。可以推测β-LG-多配体复合物的功能性质更稳定,可以更好地应用于奶粉等功能性奶制品中。
2.7 FA和VA对β-LG致敏性的影响
当竞争抗原的抑制率越大,则说明竞争抗原与抗体的结合能力越强,样品的致敏性越强。如图6所示,β-LG与FA和VA的相互作用改变了β-LG的致敏性,与β-LG的抑制率(63.06%)相比,二元复合物β-LG-VA轻微下降为56.12%,β-LG-FA(59.91%)则没有发生显著变化。但三元复合物β-LG-VA-FA的抑制率升高为70.32%,β-LGFA-VA的抑制率下降为42.23%。β-LG的过敏性主要是由过敏表位决定,包括线性表位和构象表位。当构象发生变化时,会改变它的过敏表位,从而影响其过敏性[35]。β-LG与VA在形成二元复合物的过程中,改变了β-LG的构象,掩盖了部分构象表位,导致β-LG-VA的致敏性轻微下降[36-37]。β-LG与FA在形成二元复合物的过程中,对照近紫外CD光谱的分析可知,对β-LG的构象影响虽大,但不同于β-LG-VA的构象变化,可能对β-LG的构象表位影响较小[31],因此β-LG-FA的致敏性与β-LG的致敏性没有显著差异。当在二元复合物β-LG-FA和β-LG-VA中再添加VA/FA形成三元复合物β-LG-FA-VA和β-LG-VA-FA时,β-LG的构象进一步发生改变。β-LG-VA-FA的致敏性升高可能是因为VA先与β-LG结合[25-26]形成二元复合物时,改变了β-LG的构象,掩盖了部分构象表位,当FA再结合在β-LG表面时[31],由于结合位点的竞争,可能会重新暴露或产生新的过敏表位。然而β-LG-FA-VA的致敏性下降,可能是FA只结合在β-LG的表面,对β-LG构象的影响轻微,当VA加入在β-LG-FA中时,由于VA在β-LG上不是单一的结合位点,结合过程会使β-LG的构象表位被进一步掩盖。由此可知β-LG与小分子配体结合时,不同的结合顺序不仅会影响结合能力,也会影响蛋白质的致敏性。且多个配体的影响作用大于单一配体。
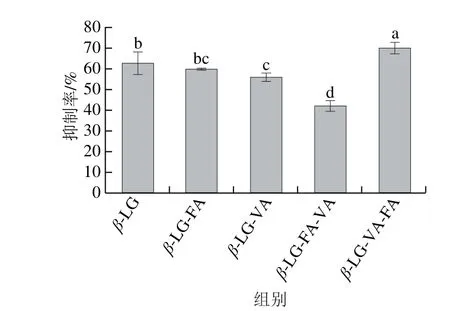
图6 FFAA/VVAA对β-LG抗原性的影响Fig. 6 Effect of complexation with FA and/or VA on the antigenicity of β-LG
3 结 论
本研究利用荧光光谱表征FA和VA与β-LG多元复合物的形成及相互作用机制,结果表明亲水性的FA和疏水性的VA对β-LG具有较强的荧光猝灭,且存在动态猝灭和静态猝灭2 种猝灭机制,通过计算猝灭速率常数(Kq)可知主要为静态猝灭,结合常数和结合位点数及热力学参数表明FA和VA可以与β-LG自发的通过疏水相互作用形成结合常数(Ka)大于104L/mol,物质的量比约为1的较稳定的二元复合物β-LG-VA和β-LG-FA以及三元复合物β-LGVA-FA和β-LG-FA-VA。通过比较FA和VA分别对β-LG-VA和β-LG-FA的荧光猝灭的程度可知,VA的存在会影响FA对β-LG的亲和性,而FA的存在不会影响VA对β-LG的亲和性。近紫外CD光谱表明,相较于β-LG,β-LG-FA和β-LG-VA的构象变化较大,而β-LG-FA-VA和β-LG-VA-FA的构象变化轻微。DPPH法和FRAP法测定的结果均表明不同结合顺序的三元复合物β-LG-FA-VA和β-LG-VA-FA的抗氧化性与β-LG的抗氧化性之间没有显著差异。但ABTS和FRAP法测定的结果表明FA单独与β-LG的相互作用会改变蛋白质的抗氧化性,而β-LG-VA与对照组间没有显著差异。ABTS法表明三元复合物β-LG-FA-VA和β-LG-VA-FA的抗氧化性显著高于对照组,不同的结合顺序对复合物的抗氧化性也没有显著影响,这与抗氧化性的测定原理不同有一定的关系。间接竞争ELISA表明β-LG-FA-VA致敏性抑制率降低为42.23%,β-LG-VA-FA的致敏性抑制率反而升高至70.32%,即不同的结合顺序会对β-LG的致敏性产生不同程度的影响。结合近紫外CD光谱分析可知,三元复合物相对于二元复合物而言,β-LG的构象会产生更复杂的多次变化,从而表现出二元复合物和β-LG所不能表现的性质。
