深度解析Vip3Aa的分子结构及作用机制(2020.8.9 Plant Biotechnology Journal)
2020-08-25
苏云金芽孢杆菌(Bt)能合成有效的杀虫蛋白,如产孢过程中分泌的Cry毒素已被广泛用于农业生產。除此之外,Bt也可分泌大量的植物性杀虫蛋白(Vip),这些蛋白被分为三个不同的家族。目前研究证实,Vip3家族成员对鳞翅目昆虫具有广谱活性,且它们针对的结合位点不同于Cry蛋白的结合位点,因此被认为是Bt杀虫毒素的优质补充。Vip3蛋白是一种非活性状态的原毒素,需要先被昆虫肠道中的蛋白酶激活才能发挥功能即触发细胞死亡。尽管Vip3家族的第一个成员早在20多年前就已被发现,且编码Vip3蛋白的基因已被引入植物中用于创制Bt作物,但人们对其在分子水平上的三维结构及作用机制仍知之甚少。
2020年8月7日,Nature Communications杂志在线发表了玛格丽塔·萨拉斯生物学研究中心的题为“Molecular architecture and activation of the insecticidal protein Vip3Aa from Bacillus thuringiensis”的研究论文,成功解析了Vip3Aa在分子水平上的三维结构及其作用机制。
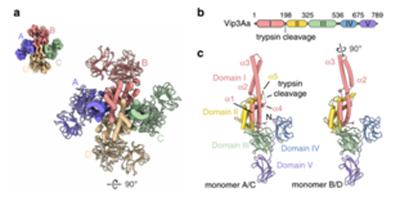
在这项研究中,作者首先揭示了Vip3Aa原蛋白的分子结构,Vip3原蛋白自发组装成高度稳定的、金字塔形结构的四聚体,其中包含三个假定的聚糖结合位点,其N-末端区域形成核心和顶点,而C-末端区域由三个球状结构域组成且暴露在溶剂中。
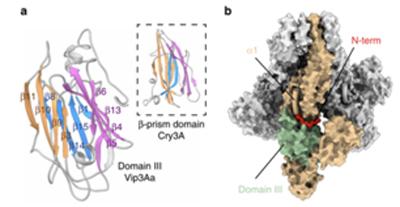
进一步研究发现,Vip3Aa由五个不同的结构域组成。结构域I从N端延伸到初级蛋白酶裂解位点,其中包含着四个长的、高度弯曲的α-螺旋(α1–α4);结构域II(残基200–325)在裂解位点之后立即开始,该位点位于连接螺旋α4和α5的完全暴露的环中;结构域III(残基328-532)与Cry内毒素非常相似,包含三个反平行的β-片形成的β-棱镜折叠,可与该蛋白的最N端片段(残基14-23)相互作用并与四聚体的核心结合;最后的两个结构域具有相似的CBM(碳水化合物结合模块)折叠,它们对壳聚糖和几丁质有强烈的偏好性。
与此同时,作者比较两种不同的非活性Vip3变体即Vip3A和Vip3B的分子结构,分析表明这两种蛋白质具有相似的四聚体结构。更精确地说,结构域I、II和III展现出显著的结构相似性。
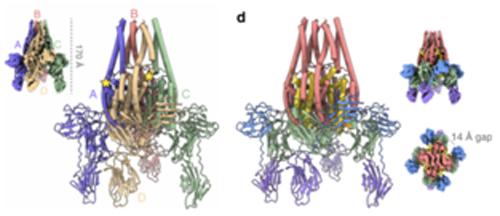
作者对原毒素和经蛋白酶处理后毒素的三维结构进行了详细对比后发现,蛋白酶的激活会引发原毒素产生剧烈的分子重组,主要体现在结构域I上产生巨大的构象变化,进而导致了N端四螺旋螺旋线圈的形成和Vip3Aa蛋白的活化。究其触发构象改变的根本原因,是随着蛋白酶环的断裂,结构域I中的两个相邻螺旋体(α4和α5)重新配置。α5的N-末端区域向邻近单体移动,破坏了螺旋体α3和α1和α2之间的环之间的疏水相互作用网络,反过来,α4的C端部分逆着α3移动施加压力以进一步促进构象变化。值得注意的是,尽管α4的N端部分在蛋白质活化过程中旋转,但其C端部分仍然牢固地附着在结构域II上,结构域II在蛋白质构象变化期间充当锚定点并提供稳定的框架。
针对vip3Aa激活过程中观察到的结构转变,作者提出一个弹簧加载机制对其进行解释。首先,vip3Aa被分泌并自发组装成四聚体原蛋白,经昆虫摄入后会被其中肠激酶消化处理并出现巨大的构象变化,即vip3Aa蛋白金字塔型四聚体的顶端被重塑成一个延伸的四螺旋卷曲螺旋线圈针头,其长度足以到达并渗透脂质双层,在与昆虫膜上受体结合后通过在昆虫细胞膜中形成孔隙触发了细胞死亡。
综上所述,这项研究揭示了Vip3的分子结构及其激活机制,结构信息和结构域边界的精确定义有助于生成具有修饰靶特异性的嵌合体,为指导开发更高效、更稳定的杀虫蛋白奠定了坚实的基础。
