一种基于RPA的番茄褪绿病毒检测方法
2020-08-25宋建薛俊孙海波王姝金凤媚
宋建 薛俊 孙海波 王姝 金凤媚
摘要 番茄褪绿病毒 Tomato chlorosis virus (ToCV)引起番茄褪綠病毒病,给番茄生产造成严重危害。开发快速准确的检测方法对该病害的防控具有重要意义。利用番茄褪绿病毒外壳蛋白(CP)基因序列,设计特异性引物,建立了ToCV的重组酶聚合酶等温扩增(recombinase polymerase amplification, RPA)检测方法,同时分析了该方法的灵敏度和特异性。结果表明,建立的ToCV-RPA方法在38℃恒温下40 min可从ToCV阳性的番茄样品中扩增出246 bp的特异性条带。扩增时间短,对设备要求低,且与番茄其他病毒无交叉反应,特异性好,灵敏度可达到PCR方法的10倍,适用于ToCV的快速检测。
关键词 番茄; 番茄褪绿病毒; 重组酶聚合酶等温扩增
中图分类号: S 436.421.1
文献标识码: A
DOI: 10.16688/j.zwbh.2019168
Detection of Tomato chlorotic virus based on RPA
SONG Jian, XUE Jun, SUN Haibo, WANG Shu, JIN Fengmei*
(Tianjin Agricultural Biotechnology Research Center, Tianjin 300192, China)
Abstract
Tomato chlorosis virus (ToCV) is the pathogen of tomato chlorosis virus disease, which causes serious damage to tomato production. It is important to develop rapid and accurate detection methods for the prevention and control of tomato chlorosis virus disease. Based on the CP gene sequence of ToCV, the specific primers were designed for the detection of virus via recombinase polymerase amplification (RPA). The specificity and sensitivity of the method were evaluated. The result showed that 246 bp specific band from ToCV-positive tomato samples could be amplified by the established ToCV-RPA method. The reaction condition was 38℃ for 40 min. The method has advantages of short operation time, low equipment requirement, and good specificity and there was no cross-reaction with other tomato viruses. The sensitivity was 10 times higher than that of the PCR method. It was suitable for rapid detection of ToCV.
Key words
tomato; Tomato chlorosis virus; recombinase polymerase amplification (RPA)
番茄褪绿病毒Tomato chlorosis virus (ToCV)是一种由烟粉虱传播的病毒,由其引起的番茄褪绿病毒病在我国迅速蔓延,且逐年加重。番茄褪绿病毒属于长线形病毒科Closteroviridae毛线病毒属Crinivirus[1]。ToCV可以侵染茄科、菊科、藜科、苋科、番杏科、夹竹桃科及白花丹科等科的多种植物[2],其中以茄科寄主最多,如: 番茄[3]、甜椒[4]、马铃薯[5]等。被病毒侵染后植株下部叶片叶脉间慢慢褪绿或黄化,然后逐渐蔓延至上部叶片,叶脉逐渐变成深绿色,染病叶片增厚变脆,植株长势也变弱,病症与生理性缺素症或营养元素缺乏相似[6]。目前,番茄褪绿病毒病已经成为我国番茄生产中一种毁灭性的病害,严重威胁着我国番茄产业的健康发展。
目前,检测番茄褪绿病毒主要采用RT-PCR技术[7],而血清学检测方法应用得较少[8]。分子生物学检测主要是通过病毒的核酸来检测病毒,它比血清学方法灵敏度高,能检测到更低数量级的病毒,特异性强、操作简便、可用于大量样品检测。PCR技术目前已经成为一种广泛采用的病毒检测方法,但该技术对仪器的依赖度高,完成扩增过程需要精密的温度循环仪器,加之成本高、耗时长,使其应用大多限制于条件完善的实验室内,难以广泛应用于现场检测。
近年来,等温核酸扩增技术的出现解决了PCR技术的局限性,该技术降低了对仪器的要求,缩短了反应时间,因而日益受到关注。重组酶聚合酶扩增技术(RPA)是一种等温核酸扩增技术,可在常温下进行反应,具有反应快、灵敏度高、特异性强、操作简便等优点。目前RPA技术在医学病原物的快速诊断中得到了一些应用[9-10],农业领域中主要用于转基因作物的检测[11-12],用于植物病毒检测的报道较少。番茄褪绿病毒病是近年来番茄上最严重的病害之一,准确、快速地检测其病原对于病害防治至关重要。本研究建立了基于RPA检测番茄褪绿病毒的方法,以期为基层单位提供一种简便适用的快速检测方法。
1 材料与方法
1.1 材料
感染番茄褪綠病毒Tomato chlorosis virus (ToCV)、番茄黄化曲叶病毒Tomato yellow leaf curl virus (TYLCV)、番茄花叶病毒Tomato mosaic virus (ToMV)、黄瓜花叶病毒Cucumber mosaic virus (CMV)、烟草花叶病毒Tobacco mosaic virus (TMV)的番茄叶片采自天津市西青区第六埠温室,阴性对照为脱毒番茄苗,样品经PCR检测和序列测定确认后-80℃冻干保存。
1.2 方法
1.2.1 总RNA 提取及cDNA 的合成
采用植物总RNA提取试剂盒(TaKaRa)提取番茄叶片的总RNA。用反转录试剂盒(PrimeScript RT-PCR Kit,TaKaRa)将提取的总RNA反转录合成cDNA,于-20℃保存备用。
1.2.2 引物设计
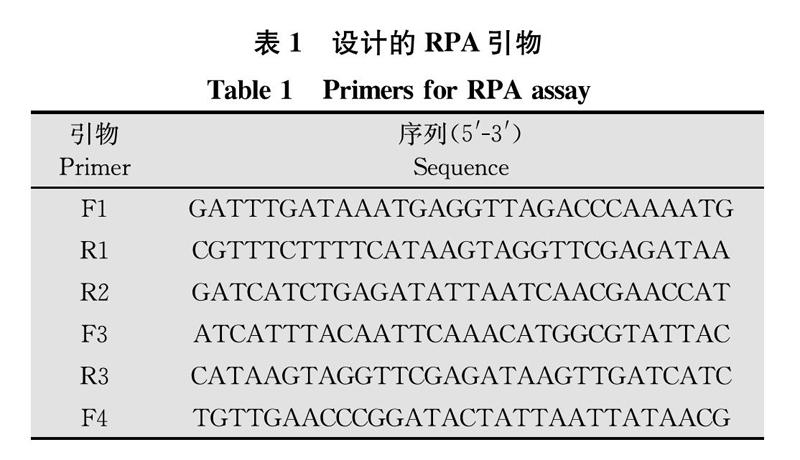
根据已发表的ToCV外壳蛋白(CP)基因的保守序列设计番茄褪绿病毒的RPA检测引物(表1)。
1.2.3 RPA 反应
以1.2.1合成的cDNA为模板,利用设计的RPA引物进行扩增,以脱毒番茄苗叶片cDNA为阴性对照。RPA扩增体系(50 μL): 向0.2 mL TwistAmp反应管(TwistAmp Basic kits,Twist)中加入Rehydration Buffer 29.5 μL,正、反向引物(终浓度为0.4 μmol/L)各2.5 μL,模板cDNA 3 μL,去离子水10 μL,最后再加入280 mmol/L醋酸镁溶液2.5 μL。将RPA扩增体系混合充分后置于38℃的金属浴上反应40 min。反应结束后,利用纯化试剂盒(DNA Fragment Purification Kit, TaKaRa)对扩增产物进行回收纯化。
1.2.4 常规PCR
PCR反应体系(25 μL):cDNA 2.5 μL,10×PCR buffer(含Mg2+)2.5 μL、去离子水14 μL、10 μmol/L上、下游引物各2.5 μL、10 mmol/L dNTPs 0.5 μL、5 U/μL Taq DNA聚合酶0.5 μL。反应程序:94℃预变性5 min;94℃变性30 s,60℃复性30 s,72℃延伸30 s,35个循环;72℃延伸10 min,反应结束后于4℃保存。
1.2.5 电泳
取RPA或PCR反应产物5 μL于1.2%琼脂糖凝胶电泳20 min,然后通过凝胶成像系统观察电泳结果。
2 结果与分析
2.1 引物的筛选
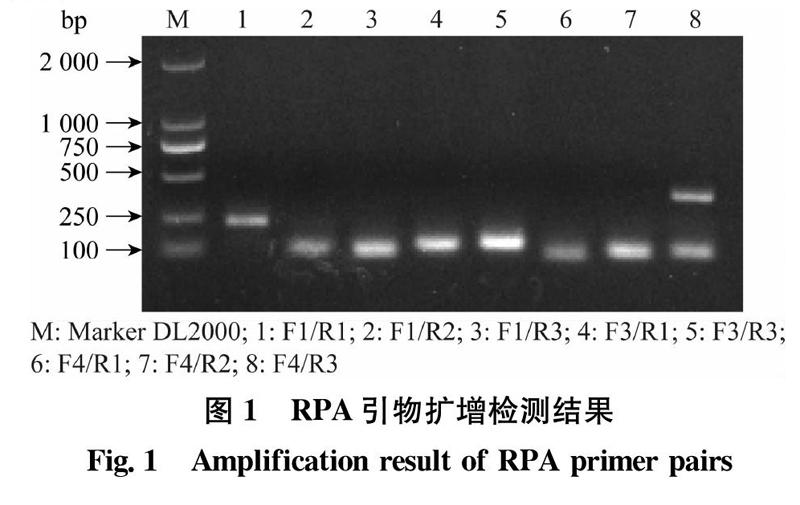
分别利用引物对F1/R1、F1/R2、F1/R3、F3/R1、F3/R3、F4/R1、F4/R2、F4/R3进行扩增,产物片段的大小分别为246、115、125、130、150、92、112、440 bp。从图1中可以看出各对引物都扩增出目标片段,但F1/R2、F1/R3、F4/R1、F4/R2 4对引物的扩增产物不够清晰,F4/R3除了扩增出目的条带,还有非特异性条带产生,而F3/R1、F3/R3在后续试验中重复性不够好,因此最终选定引物组合F1/R1作为检测引物。
2.2 RPA检测方法的灵敏度
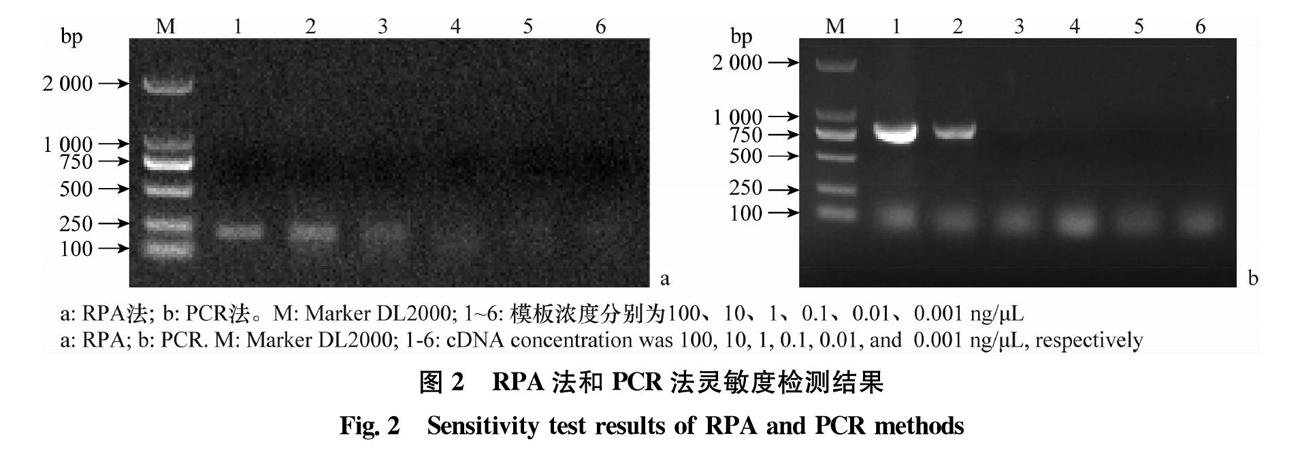
将带毒植株的cDNA进行10倍梯度稀释,浓度分别为100、10、1、0.1、0.01、0.001 ng/μL,按照1.2.3所示的反应体系进行RPA灵敏度试验,同时参考已经报道的ToCV检测引物CP-F/CP-R[13](扩增产物长度为840 bp)进行PCR灵敏度试验,比较两种方法的检测灵敏度。结果表明,RPA法的检测灵敏度为1 ng/μL(图2a),PCR法的检测灵敏度为10 ng/μL(图2b),RPA法的灵敏度要优于PCR法。
2.3 RPA检测方法的特异性
按照1.2.3的RPA反应体系,检测番茄褪绿病毒、番茄黄化曲叶病毒、番茄花叶病毒、黄瓜花叶病毒、烟草花叶病毒共5种病毒的cDNA,同时以脱毒番茄苗的cDNA为阴性对照,评价所建立的RPA检测方法的特异性。从图3中可以看出只有感染番茄褪绿病毒的番茄叶片对应的RPA反应扩增出了目的条带,感染其他种对照病毒的番茄叶片均未扩增出条带,由此证明本试验的RPA引物特异性高,可有效检测番茄褪绿病毒。
3 讨论
本研究建立了一种番茄褪绿病毒的RPA检测方法,可以在38℃等温条件并且在40 min内完成目标cDNA的快速扩增,可特异性检测番茄褪绿病毒,其他4种植物病毒的检测结果均为阴性,RPA法检测番茄褪绿病毒的灵敏度优于常规PCR法,缩短了反应时间,也不需要昂贵的仪器,可在简易实验室和田间完成快速检测,为番茄褪绿病毒病的诊断和预警提供了一种高效简便的技术方法,在植物病毒快速检测方面具有一定的实践意义。
RPA对引物有严格要求,用于扩增反应的引物一般由30~35个核苷酸组成,这种较长的引物与模板序列互补性好,使扩增获得的产物特异性更高。RPA引物的设计没有特殊的方法,只能通过筛选较好的引物进行下一步试验。此外RPA对仪器设备的要求较低,不需要PCR仪,反应可以通过水浴锅或小型金属浴完成,如果配合琼脂糖凝胶电泳或小型便携式设备,短时间内即可获得检测结果,适合基层单位的快速检测,具有广泛的应用前景。
参考文献
[1] KING A M, ADAMS M J, CARSTENS E B. Virus taxonomy: ninth report of the international committee on taxonomy of viruses [M]. Amsterdam: Elsevier Academic Press, 2011.
[2] WINTERMANTEL W M, WISLER G C. Vector specificity, host range, and genetic diversity of Tomato chlorosis virus [J]. Plant Disease, 2006, 90(6): 814-819.
[3] 赵黎明, 李刚, 刘永杰, 等. 侵染番茄的番茄褪绿病毒山东泰安分离物的分子鉴定和序列分析[J]. 植物保护, 2014, 40(5): 34-39.
[4] 赵汝娜, 王蓉, 师迎春, 等. 侵染甜椒的番茄褪绿病毒的分子鉴定[J]. 植物保护, 2014, 40(1): 128-130.
[5] FREITAS D, NARDIN I, SHIMOYAMA N, et al. First report of Tomato chlorosis virus in potato in Brazil [J]. Plant Disease, 2012, 96(4): 593-594.
[6] 周涛, 杨普云, 赵汝娜, 等. 警惕番茄褪绿病毒在我国的传播和危害[J]. 植物保护, 2014, 40(5): 196 -199.
[7] 李洁, 李慧, 丁天波, 等. 胶东半岛地区番茄褪绿病毒的快速检测与鉴定[J]. 山东农业科学, 2015, 47(2): 86-89.
[8] JACQUEMOND M, VERDINER E, DALMON A, et al. Serological and molecular detection of Tomato chlorosis virus and Tomato infectious chlorosis virus in tomato [J]. Plant Pathology, 2009, 58(2): 210-220.
[9] 吴耀东, 徐民俊, 郑文斌, 等.重组酶聚合酶扩增技术及其在动物病原快速检测中的应用[J]. 中国兽医学报, 2016, 36(10): 1797-1802.
[10]樊曉旭, 赵永刚, 李林, 等.重组酶聚合酶扩增技术在疾病快速检测中的研究进展[J]. 中国动物检疫, 2016, 33(8): 72-77.
[11]邓婷婷, 黄文胜, 程奇, 等.重组酶聚合酶扩增技术检测转基因水稻中的Cry1Ab/c 基因[J]. 中国食品学报, 2015, 15(3): 187-193.
[12]刘静, 武国干, 吴潇, 等.重组酶聚合酶扩增技术快速检测转基因玉米Bt11[J]. 上海农业学报, 2018, 34(1): 20-24.
[13]HIROTA T, NATSUAKI T, MURAI T, et al. Yellowing disease of tomato caused by Tomato chlorosis virus newly recognized in Japan [J]. Journal of General Plant Pathology, 2010, 76(2): 168-171.
(责任编辑:杨明丽)
