中华稻蝗Knickkopf(Knk)基因分子特性和生物学功能
2020-08-25于荣荣张育平马恩波张建珍
于荣荣 张育平 马恩波 张建珍


摘要 基于中华稻蝗转录组数据库,采用生物信息学方法搜索获得1条OcKnk基因全长cDNA序列,采用qRT-PCR检测其组织部位表达特性和其在表皮发育过程中表达情况,明确其分子特性,采用RNAi技术结合表型观察,研究其对中华稻蝗蜕皮和生长发育的影响,以明确其生物学功能。组织部位表达结果显示其在中华稻蝗体壁、前肠和脂肪体表达最高,发育表达结果显示其在表皮不同发育日龄均有表达,且在蜕皮前期和后期表达显著高于其他日龄。生物学功能研究表明,注射dsRNA后,多数虫体难以成功蜕去旧表皮,导致死亡,少部分可蜕至下一龄期,但活动力较低,行动缓慢,最终死亡。研究结果表明OcKnk参与昆虫生长发育和蜕皮过程,可作为重要靶标基因,为下一步害虫防治提供理论基础。
关键词 中华稻蝗; Knickkopf; 分子特性; 生物学功能
中图分类号: S 433.2
文献标识码: A
DOI: 10.16688/j.zwbh.2019648
Molecular characteristics and biological function of Knickkopf (Knk) gene in Oxya chinensis
YU Rongrong1, ZHANG Yuping1, MA Enbo2, ZHANG Jianzhen2*
(1. Taiyuan Normal University, Jinzhong 030619, China; 2. Shanxi University, Taiyuan 030006, China)
Abstract
The full-length cDNA of OcKnk gene was obtained based on the transcriptome database of Oxya chinensis. To determine the molecular characteristics of OcKnk, the expressions of OcKnk in different tissues and during different developmental stage (day) of cuticle were detected by qRT-PCR. The biological functions of OcKnk affecting molting and development were investigated by RNAi technology combined with phenotype observation. Tissue expression results indicated that there was a highest expression in the integument, foregut and fat body; developmental expression pattern showed that it was expressed in the cuticle during different developmental days of age, with a significantly higher expression during proecdysis and post-ecdysis. The biological function assay showed that most locusts was unable to escape from the old cuticle successfully, finally leading to death and failing to reach the next instar. During the process, they moved slowly with low activity and eventually went to death. The results indicated that OcKnk may be involved in insect growth and molting, which can be used as an important target gene and provide a theoretical basis for further pest control.
Key words
Oxya chinensis; Knickkopf; molecular characteristics; biological function
中華稻蝗Oxya chinensis隶属于直翅目Orthoptera斑腿蝗科Catantopidae稻蝗属Oxya,广泛分布于我国水稻种植区,是稻田土蝗的优势种[1-3],喜食水稻幼嫩组织,造成叶片缺刻受损、白穗和稻粒缺失,严重影响农作物产量[4-5]。目前化学药剂仍是防治稻蝗的主要手段[6-7],长期施用化学药剂,使稻蝗产生一定程度的抗药性[8-9]。昆虫生长发育伴随周期性旧表皮脱落和新表皮形成,几丁质是昆虫表皮的重要组成成分[10-11],几丁质片层结构以恒定角度螺旋排列形成致密而富有弹性的表皮结构[12-15]。几丁质排列过程中,Knickkopf(Knk)发挥着关键作用[16]。因此,通过RNA干扰(RNAi)技术筛选获得几丁质排列关键靶基因将为中华稻蝗防治提供重要理论基础。
目前对于Knk功能的研究主要集中于黑腹果蝇Drosophila melanogaster和赤拟谷盗Tribolium castaneum中,果蝇DmKnk对于胚胎气管直径的维持、长度的保持和结构的完整性发挥重要作用,此外,DmKnk通过对表皮几丁质进行组装,进而影响胚胎形态[16]。通过点突变结合遗传学试验筛选,发现DmKnk的DOMON功能域4个关键氨基酸对于几丁质组装具有作用[17]。同时,DmKnk对于成虫翅形状和翅表面结构的维持具有重要作用[18]。赤拟谷盗中,TcKnk对胚后发育时期虫体生长发育起着关键作用,当TcKnk表达量下降后,不同发育阶段(幼虫-蛹和蛹-成虫)虫体均出现难以蜕去旧表皮,蜕皮致死的表型,进一步通过透射电镜观察,发现注射dsTcKnk后,鞘翅表皮致密排列的几丁质片层结构消失,同时气管形态结构发生改变[19]。此外,TcKnk对胚胎发育起着关键作用,将dsTcKnk注射进入雌虫体内,发现其所产卵的孵化率显著降低,几丁质含量下降,同时浆膜表皮几丁质片层结构消失,部分已孵化幼虫在蜕至下一龄期前死亡[20-21]。此外,TcKnk负责保护幼虫新合成的表皮,防止其被几丁质酶降解[22]。已在意大利蜜蜂Apis mellifera中鉴定出AmKnk,但对其功能未做进一步阐述[23]。
1.7.2 dsRNA沉默效率检测
收集18头5龄2 d若虫,平均分为2组,采用微量注射器分别将3 μL dsGFP和dsOcKnk注射进入不同组若虫体腔内,待24 h后,收集虫体,冻存于-80℃冰箱,进一步提取总RNA并将其反转录为第一链cDNA,采用qRT-PCR检测OcKnk在对照组和处理组中的表达情况,采用SigmaPlot 12.0绘制柱形图,使用t测验分析OcKnk在对照组和处理组中表达差异。
1.7.3 飞蝗表型观察
选取40头5龄2 d若虫,平均分为2组,分别将6 μg dsGFP和dsOcKnk注射进入5龄2 d若虫中,置于人工气候培养箱中,对其生长发育进行连续观察和记录,直至蜕皮至下一龄期。
2 结果
2.1 OcKnk全长cDNA鉴定
基于中华稻蝗转录组数据库,搜索获得1条OcKnk序列(图1),其全长cDNA核苷酸长度为2 265 bp,由5′-UTR区、开放阅读框和3′-UTR区组成。其中5′-UTR和3′-UTR分别为172 bp和41 bp,开放阅读框为2 052 bp,编码684个氨基酸,分子量为77 kD,等电点为5.8。功能域预测结果显示其包含信号肽(1-24 aa)、两个串联的DM13功能域(37-136 aa和152-252 aa)、1个多巴胺类似功能域(DOMON)(282-414 aa)和C端的GPI锚定位点(655-683 aa)。
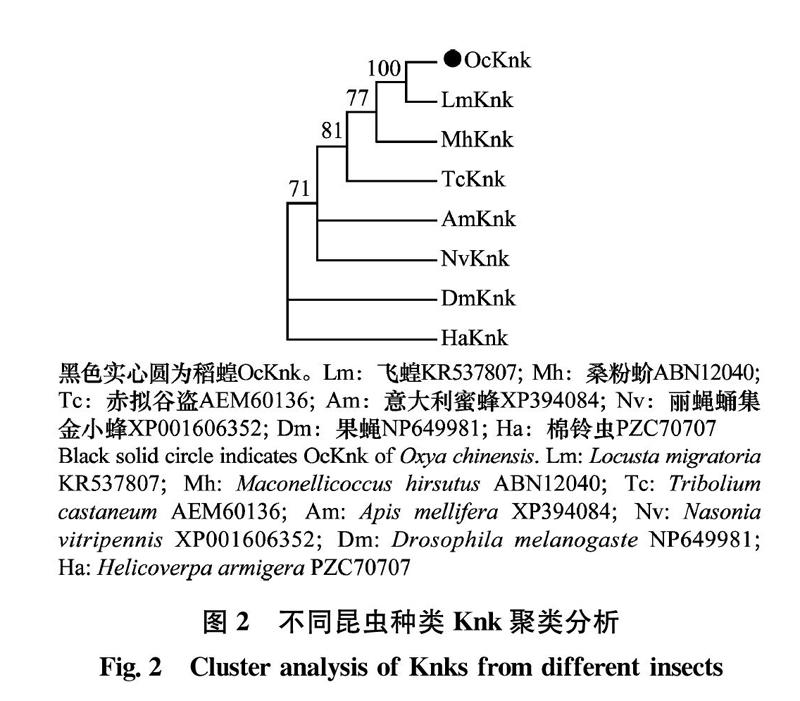
不同昆虫Knk氨基酸序列系统进化分析结果显示(图2),不同昆虫Knk聚为一支,说明不同昆虫Knk序列具有较高同源性,故将其命名为OcKnk。
2.2 OcKnk表达特性
采用qRT-PCR检测OcKnk组织部位和表皮不同天数表达特性(图3),OcKnk在不同组织部位表达结果表明(图3a):OcKnk在体壁和前腸中表达最高,暗示其在表皮中发挥重要作用,将5龄不同日龄若虫体壁解剖下来,进一步检测其在不同日龄体壁表达(图3b),结果表明其在5龄不同日龄均有表达,且其在5龄若虫蜕皮前、后期表达量显著提高,暗示其参与昆虫蜕皮过程。
2.3 OcKnk生物学功能
将合成的dsGFP和dsOcKnk分别注射进入稻蝗体内,24 h后检测其在对照组和处理组的表达情况(图4a),结果显示注射dsOcKnk后,与对照相比,OcKnk表达量显著降低,dsOcKnk沉默效率为98.5%。
表型观察结果显示(图4b),注射dsOcKnk后,85%虫体在蜕皮时脊线开裂,难以蜕去旧表皮,最终导致死亡,5%虫体可蜕去旧表皮,但虫体崩裂,组织暴露,最终死亡,10%虫体蜕至成虫,但活动力不强,行动缓慢,蜕皮后48 h内死亡。表明OcKnk在中华稻蝗蜕皮过程中发挥关键作用。
3 讨论
昆虫表皮是防止体内水分蒸发和隔绝病原体侵害的重要结构,对昆虫的生长发育具有重要意义[24-25]。昆虫表皮坚硬而富有弹性[26],由几丁质和蛋白质交联组装而成。其形成过程为几丁质纤维丝通过氢键聚合为几丁质微纤维,几丁质微纤维进一步与蛋白交联形成水平的几丁质片层结构,多个几丁质片层结构以中心垂直轴为中心,以恒定的角度螺旋排列组装形成致密的表皮结构[12-15]。Knk为参与几丁质组装的关键蛋白[16]。目前已在多个昆虫中鉴定出Knk蛋白[22-23, 25, 27]。赤拟谷盗中鉴定出3个Knk蛋白,分别被命名为TcKnk、TcKnk2和TcKnk3,且不同蛋白的功能域具有多样性,TcKnk含有信号肽,2个串联的DM13功能域,多巴胺单加氧酶N端结构域和C端的GPI-锚定位点。而TcKnk2不含信号肽和GPI-锚定位点,含有跨膜区。TcKnk3包含多个剪切子,不同剪切子因C端是否含有GPI-锚定位点而导致其功能域存在差异[19]。文献报道DM13功能域参与氧化还原反应中电子转移,DOMON是结合几丁质的重要区域,是几丁质排列关键功能域[28-29]。本文采用生物信息学方法,将搜索获得的1条OcKnk全长cDNA序列翻译成相应的氨基酸,并对其功能域进行分析,结果表明其含有信号肽,2个串联的DM13功能域,多巴胺单加氧酶N端结构域(DOMON)和C端的GPI-锚定位点。故推测其可能为OcKnk基因。进一步将其与其他昆虫同源Knk序列比对并构建系统进化树,结果表明,其与其他昆虫Knk以较高的置信度聚为一支,故将其命名为OcKnk。登录号为MN603495。
昆虫Knk在组织部位和发育阶段的表达具有多样性,果蝇中,DmKnk特异性表达于13期胚胎气管和15期胚胎咽、后肠和表皮中[16],DmKnk在幼虫、蛹和成虫期均有表达,且其在蛹化前后特定时间内表达量显著高于卵期和幼虫期[18]。赤拟谷盗中,TcKnk特异性表达于幼虫表皮和后肠以及卵期浆膜中,且其在整个胚后发育阶段(幼虫、蛹和成虫期)均有表达[19]。本文中OcKnk表达于体壁、前肠和脂肪体中,同其他昆虫一样,体壁和前肠均来源于外胚层,均含有几丁质[12],表明Knk在富含几丁质的组织中发挥作用,而其在脂肪体中表达量较高,可能由于脂肪体和气管密布于昆虫表皮上,解剖时由于部分气管的粘连,导致OcKnk在脂肪体中表达量较高。此外,目前研究多集中于不同发育阶段Knk表达,而对其在特定组织部位同一发育龄期动态变化情况研究较少,本文通过对不同组织部位检测发现其在体壁中表达量较高;为了研究其对蜕皮的影响,将不同日龄的5龄若虫体壁解剖下来,探究Knk的动态表达情况,结果表明OcKnk在不同日龄的5龄若虫中均有表达,且其在蜕皮前后表达量较高,暗示其参与昆虫蜕皮过程。
目前对于Knk功能研究多集中于全变态昆虫中。果蝇中的DmKnk在多个组织部位中发挥功能。DmKnk参与胚胎气管直径的调节和形态结构的维持。DmKnk突变体中,气管横截面由圆形变得不规则,气管长度过度延伸,缠绕在一起,导致形态结构发生变化。同时突变体胚胎膨大,且头部表皮结构畸形并呈现黑色[16]。DmKnk参与翅形成和形态结构的维持。采用RNAi沉默DmKnk表达后,蛹羽化为成虫时,出现翅折叠不能伸展,翅卡在蛹中,出现断翅或残翅,甚至虫体死亡等多种表型[18]。赤拟谷盗注射dsRNA后,不同发育阶段(幼虫-蛹-成虫)均出现蜕皮困难,虫体死亡的表型[22]。RNAi是功能基因检测常用方法[30],本文将OcKnk特异性dsRNA注射进入虫体中对中华稻蝗功能基因进行研究,为了确保试验可行性,首先对dsOcKnk沉默效率进行检测,结果表明沉默效率高达98.5%,为进一步表型观察顺利进行提供保障。表型观察结果显示dsOcKnk可使中华稻蝗出现蜕皮致死的表型。同时翅出现一定程度残缺,而该表型与果蝇翅残缺表型相一致[18]。说明OcKnk对于翅形态结构维持具有一定作用。但其是否影响几丁质排列,仍需进一步研究。本试验结果明确了OcKnk参与中华稻蝗生长发育和蜕皮的生物学功能,筛选获得的OcKnk将为中华稻蝗防治提供重要理论基础。
参考文献
[1] 杨国国. 基于机器视觉的中华稻蝗早期蝗蝻的识别和检测研究[D]. 杭州: 浙江大学, 2017.
[2] 朱恩林, 李玉川. 北方农区土蝗化学防治技术[J].中国植保导刊, 1993(2): 13-14.
[3] 冯祥和, 张爱萍. 中华稻蝗的危害与防治[J]. 农业科技通讯, 1989(12): 26.
[4] 李书琴, 赵书文, 王晋瑜.中华稻蝗的发生與防治[J]. 植物医生, 2013, 26(5): 4-5.
[5] 李艳君.中华稻蝗在辽宁中部地区的发生及防治[J].垦殖与稻作, 2003(4): 29-30.
[6] 史树森.大豆害虫综合防控理论与技术[M].长春:吉林出版社, 2013: 199-204.
[7] 孙富余, 于凤泉. 辽宁省水稻主要虫害发生与防治对策[J]. 新农业, 2017(8): 39-40.
[8] YANG Meiling, ZHANG Jianzhen, ZHU Kunyan, et al. Increased activity and reduced sensitivity of acetylcholinesterase associated with malathion resistance in a field population of the oriental migratory locust, Locusta migratoria manilensis (Meyen) [J]. Pesticide Biochemistry and Physiology, 2008, 91(1): 32-38.
[9] 萧玉涛, 吴超, 吴孔明. 中国农业害虫防治科技70年的成就与展望[J]. 应用昆虫学报, 2019, 56(6): 1115-1124.
[10]唐斌, 张露, 熊旭萍, 等. 海藻糖代谢及其调控昆虫几丁质合成研究进展[J]. 中国农业科学, 2018, 51(4): 697-707.
[11]MINKE R, BLACKWELL J. The structure of alpha-chitin [J]. Journal of Molecular Biology, 1978, 120(2): 167-181.
[12]CHAPMAN R F. The insects structure and function [M]. Cambridge: Cambridge University Press, 2013: 475.
[13]NEVILLE A C. Biology of the arthropod cuticle [M]. Springer Berlin Heidelberg, 1974.
[14]BOULIGAND Y. On a twisted fibrillar arrangement common to several biologic structures [J]. Comptes Rendus Des Séances De LacadémieDes Sciences Série D Sciences Naturelles, 1965, 261(22): 4864-4867.
[15]刘晓健, 刘卫敏, 赵小明, 等. 昆虫表皮发育研究进展及展望[J]. 应用昆虫学报, 2019, 56(4): 625-638.
[16]MOUSSIAN B, TANG E, TONNING A, et al. Drosophila Knickkopf and retroactive are needed for epithelial tube growth and cuticle differentiation through their specific requirement for chitin filament organization [J]. Development, 2006, 133(1): 163-171.
[17]SHAIK K S, WANG Yiwen, ARAVIND L. et al. The Knickkopf domon domain is essential for cuticle differentiation in Drosophila melanogaster [J]. Archives of Insect Biochemistry and Physiology, 2014, 86(2): 100-106.
[18]LI Kaixia, ZHANG Xubo, ZUO Ying. et al. Timed Knickkopf function is essential for wing cuticle formation in Drosophila melanogaster [J]. Insect Biochemistry and Molecular Biology, 2017, 89: 1-10.
[19]CHAUDHARI S S, MOUSSIAN B, SPECHT C A, et al. Functional specialization among members of Knickkopf family of proteins in insect cuticle organization [J/OL]. PLoS Genetics, 2014, 10(8): e1004537. DOI: 10.1371/journal.pgen.1004537.
[20]JACOBS C G C, BRAAK N, LAMERS G E M. et al. Elucidation of the serosal cuticle machinery in the beetle Tribolium by RNA sequencing and functional analysis of Knickkopf1, Retroactive and Laccase2 [J]. Insect Biochemistry and Molecular Biology, 2015, 60:7-12.
[21]CHAUDHARI S S, NOH M Y, MOUSSIAN B, et al. Knickkopf and retroactive proteins are required for formation of laminar serosal procuticle during embryonic development of Tribolium castaneum [J]. Insect Biochemistry and Molecular Biology, 2015, 60: 1-6.
[22]CHAUDHARI S S, ARAKANE Y, SPECHT C A. Knickkopf protein protects and organizes chitin in the newly synthesized insect exoskeleton [J]. Proceedings of the National Academy of Sciences, 2011, 108(41): 17028-17033.
[23]WANG Yiwen, ODEMER R, ROSENKRANZ P. et al. Putative orthologues of genetically identified Drosophila melanogaster chitin producing and organising genes in Apis mellifera [J]. Apidologie, 2014, 45(6): 733-747.
[24]DELON I, PAYRE F. Evolution of larval morphology in flies: get in shape with shavenbaby [J]. Trends in Genetics, 2004, 20(7): 305-313.
[25]MOUSSIAN B, SCHWARZ H, BARTOSZEWSKI S, et al. Involvement of chitin in exoskeleton morphogenesis in Drosophila melanogaster[J]. Journal of Morphology, 2005, 264(1): 117-130.
[26]MOUSSIAN B. Recent advances in understanding mechanisms of insect cuticle differentiation [J]. Insect Biochemistry and Molecular Biology, 2010, 40(5): 363-375.
[27]JURGENS G.WIESCHAUS E, NUSSLEIN-VOLHARD C, et al. Mutations affecting the pattern of the larval cuticle in Drosophila melanogaster [J]. Rouxs Archives of Developmental Biology, 1984, 193(5): 283-295.
[28]ARAVIND L. DOMON: an ancient extracellular domain in dopamine beta-monooxygenase and other proteins [J].Trends in Biochemical Sciences, 2001, 26(9): 524-526.
[29]IYER L M, ANANTHARAMAN V, ARAVIND L. The DOMON domains are involved in heme and sugar recognition [J]. Bioinformatics, 2007, 23(20): 2660-2664.
[30]張涛, 郅军锐, 叶茂. RNAi在昆虫基因功能研究中的应用进展[J]. 山地农业生物学报, 2018, 37(6): 63-69.
(责任编辑:田 喆)
