雄性布氏田鼠光周期不应现象初探
2020-08-25田林李昊璁李江鹏王大伟李宁宋英刘晓辉
田林 李昊璁 李江鹏 王大伟 李宁 宋英 刘晓辉
摘要 日照时长是调控季节性繁殖动物性腺功能的重要因子。长期处于繁殖抑制光周期相位中的动物,往往出现性腺功能恢复的现象,被称为“光周期不应性”。布氏田鼠是严格的季节性繁殖鼠类,但是其光周期不应现象是否存在仍不明确。本研究对比了室内秋季出生的雄鼠在长光照(16 h)、短光照(8 h)和自然光照条件下的体重、睾丸、储精囊的重量,及粪便睾酮含量变化。结果表明,与长光照组相比,自然光照组和短光照组雄鼠性腺重量和睾酮含量在6周龄时被显著抑制,而在6~24周龄增长迅速,至24周龄(春分左右)达到长光照组水平。这些结果说明,短光照可以显著抑制雄性布氏田鼠性腺发育,但布氏田鼠存在光周期不应机制,在春季繁殖期到来前恢复性腺活性。
关键词 布氏田鼠; 光周期; 光周期不应性; 性腺发育
中图分类号:
S 443.3
文献标识码: A
DOI: 10.16688/j.zwbh.2019279
A preliminary study on the photorefractoriness in male Brandts voles Lasiopodomys brandtii
TIAN Lin1, LI Haocong2, LI Jiangpeng2, WANG Dawei1*, LI Ning1, SONG Ying1, LIU Xiaohui1*
(1. Institute of Plant Protection, Chinese Academy of Agricultural Sciences, Beijing 100193, China;
2. Beijing No.5 High School, Beijing 100007, China)
Abstract
Photorefractoriness is characterized as the state of gonadal development that is insensitive to inhibitory photoperiods and triggers gonadal recrudescence in mammals. To study the photorefractoriness in Brandts voles (Lasiopodomys brandtii), we analyzed the variations in the body weight, gonadal weight and testosterone level in feces along with the postnatal development of new-born males under long-day light (LD, 16 h light), short-day light (SD, 8 h light) and natural photoperiod conditions from autumn to the following spring. Our results showed that the gonadal development of SD males was inhibited at the 6th postnatal week compared with that of LD males. The gonadal developmental rate of SD males was the highest during 6-24 postnatal weeks compared with the two other groups. SD males displayed a similar status as males under LD and natural photoperiod conditions around the vernal equinox (24 weeks). These results indicate the existence of photorefractoriness in Brandts voles, which is an important mechanism for regulating individual reproductive states before the onset of LD condition in early spring.
Key words
Brandts voles; photoperiodism; photorefractoriness; gonadal development
光周期现象(photoperiodism)是指日照时长调节有机体产生季节性变化的现象,从单细胞蓝藻到哺乳动物中的所有门类均有发生[1]。例如,植物开花、鸟类换羽与迁徙、动物的季节性繁殖等许多生理和行为现象都随着日照时长而发生着变化。动物的季节性繁殖是一种典型的光周期现象,主要表现为其繁殖过程被限制在每年特定时期出现[2-3]。对许多生活在高纬度地区的鼠类而言,春夏季(长光照,白昼>12 h)往往处于繁殖期,而秋冬季(短光照,白昼<12 h)则繁殖活性受到抑制[3-4]。而且,室内光照控制试验也证明,日照时长的长短可以调节季节性繁殖鼠类的繁殖活性。例如,短光照条件可抑制叙利亚仓鼠Mesocricetus auratus和黑线毛足鼠Phodopus sungorus的性腺功能,导致性腺萎缩,精子发育停止,甚至完全不育,而长光照则可使性腺恢复[2, 5-6]。因此,光周期是调节动物季节性繁殖最重要的环境因子之一[1-3,5-6]。
但是,动物对光周期的反应并不是一成不变的,在一些季节性繁殖的动物中还存在着光周期不应现象(photorefractoriness)。这是指动物长期处于繁殖抑制的光周期相位中时,其性腺活性从抑制状态重新恢复的现象[7-10]。在自然状态下,经历過秋冬季非繁殖期的性腺萎缩后,北方鼠类在冬末春初开始繁殖,这意味着其性腺恢复是在短光照相位中完成的[7-8];室内光照控制试验也表明,连续10周短光照处理后,雄性仓鼠睾丸从抑制状态开始恢复,至28周时完全恢复正常功能[11]。光周期不应性的生态意义在于,鼠类在春季来临之前可以提前恢复繁殖功能,为即将到来的繁殖期提前准备[12-13]。
布氏田鼠Lasiopodomys brandtii是一种严格季节性繁殖的鼠类,其繁殖期一般在早春(2月-3月)至秋季(8月-9月)[14]。前期研究表明,野生布氏田鼠的性腺重量具有显著的季节差异,夏季为秋季的20倍以上[15],性腺重量与粪便睾酮的高峰出现在全年日照时长最长的6月份[16]。室内试验表明,长光照下幼鼠性腺发育迅速,而短光照则起到显著抑制作用[17]。这说明,布氏田鼠性腺发育对光周期长短非常敏感,但是对于其光周期不应现象目前尚无研究报道。因此,本研究以长期驯化的、仍保持季节性繁殖特征的布氏田鼠室内种群为研究对象,以秋季自然光照下出生的雄鼠为对照,比较长光照(16 h白昼)和短光照(8 h白昼)两种处理条件对雄鼠性腺发育的影响,并探讨长期处于短光照处理中的雄鼠是否存在光周期不应现象。
1 材料与方法
1.1 试验动物
试验用鼠来自中国农业科学院植物保护研究所室内长期饲养种群。建群亲本于2007年捕自内蒙古锡林郭勒盟东乌珠穆沁旗(115°58′E,45°33′N),在室内繁殖已超过10代。自然光照下饲养,以锯末做垫料,温度为(20±3)℃,相对湿度(50±20)%。所用饲料为成兔配合饲料(北京市房山希望饲料有限责任公司),食物和饮水保持充足供应。
1.2 光周期处理与试验流程
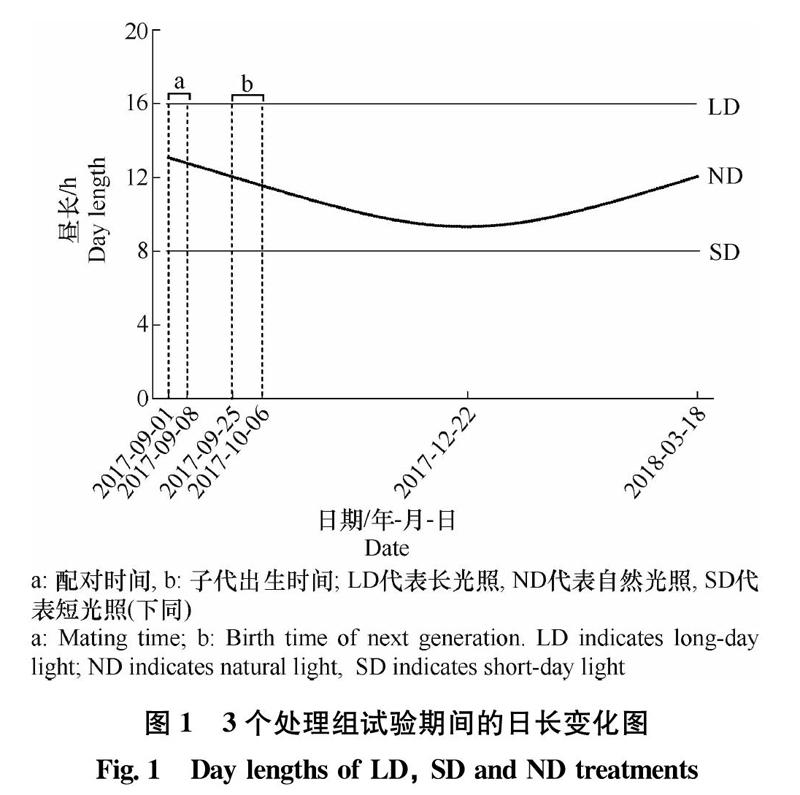
试验时期为2017年9月1日至2018年3月18日。2017年9月1日开始配对,1周后分别移入3个光周期中进行处理。光周期设置为:
1)长光照组(long-day light,LD),每天16 h光照,起始于上午4:00;
2)短光照组(short-day light,SD),每天8 h光照,光照起始时间上午8:00;
3)自然光照组(natural day light,ND),为北京地区自然光周期,日照时长为正余弦函数波动;试验开始和结束均为12 h左右,最低点为9 h 20 min(冬至)(图1)。
每组供试雄鼠来源于至少5对不同亲本。在6周龄(初冬,11月6日-17日)、12周龄(冬至附近,12月18日-29日)、24周龄(春分附近,3月12日-23日)解剖,记录体重、睾丸和储精囊重量。同时,每窝选取1只雄鼠用于进行睾酮长期监测,剪毛标记后在6、12、14、16、18、22、24周龄收集粪便,于-20℃保存至激素提取。发育增长率计算公式如下:
增长率=(监测值-起始值)/起始值×100%。
1.3 激素提取及测定
粪便激素提取参照Wang等的方法[18]。首先,将粪便样本在-40℃下真空冻干处理24 h以去除水分,每个样本称取100 mg±5 mg,放入5 mL收集管中,加入直径4 mm钢珠和1 mL蒸馏水,用组织破碎仪进行破碎(20 Hz,2 min)。然后,加入乙酸乙酯2 mL,经漩涡振荡10 s、超声波处理3 min、摇床振荡30 min(4℃,200 r/min),取出放入冰箱4℃静置30 min后,用漩涡振荡仪混匀后高速离心3 min(10 000 r/min)。最后,吸取1 mL上清液,过夜风干后置于-80℃保存至检测。检测前,向离心管中加入1 mL PBS溶液复溶,使用碘[125I]睾酮放射免疫分析药盒(北京北方生物技术研究所)测定睾酮,符合批内变异<10%,批间变異<15%。
睾酮含量=(睾酮浓度×1 mL)/粪便重量。
1.4 统计方法
使用SPSS 19.0软件进行统计分析。生理指标(体重、睾丸和储精囊)重量采用最小显著性差异法(least significant difference,LSD)进行多重比较,两点间差异性分析采用独立样本t检验。睾酮组间比较采用Kruskal-Wallis检验数据,两点间差异性分析采用非参数检验Mann-Whitney检验。显著性水平设为P<0.05,极显著水平设为P<0.01。
2 结果
2.1 长短光照对雄性布氏田鼠体重和性腺发育的影响
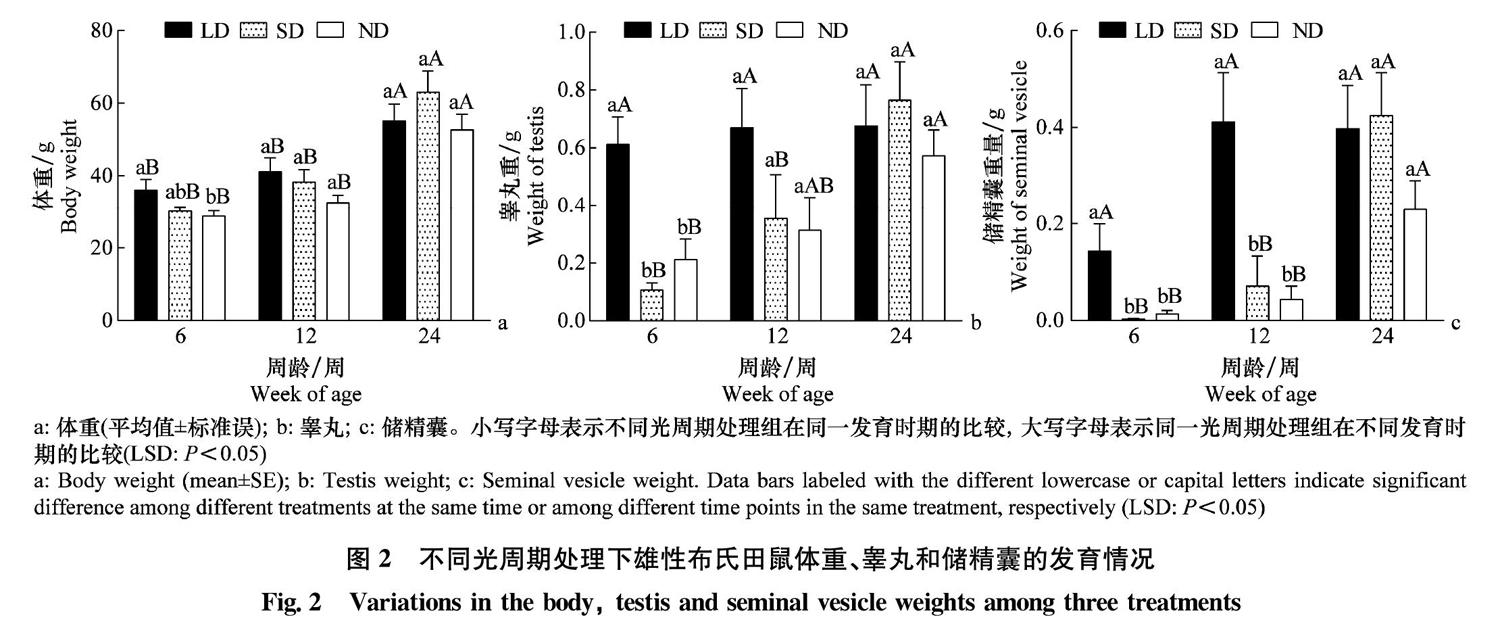
3组雄鼠体重发育(图2a)呈现出相似的变化趋势,在6~24周内均呈现显著增加(One-way ANOVA,LD:df=2,F=6.060,P=0.011;SD:df=2,F=11.120,P=0.001;ND:df=2,F=18.829,P<0.001)。组内发育分析表明,3组雄鼠在24周龄时体重均显著高于6周龄和12周龄(LSD,P<0.05),这说明体重的增加主要发生在12~24周龄。3个光照处理组间分析表明,仅在6周龄时ND组显著低于LD组(P=0.013),LD组和SD组间、ND组与SD组间并无显著差异,这说明长短光照并不是影响雄鼠体重发育的关键因子。
睾丸发育(图2b)在3组间表现出很大差异。在6~24周内,LD组雄鼠睾丸重量无显著变化(df=2,F=0.060,P=0.942),而SD组和ND组雄鼠则出现显著增加(SD:df=2,F=6.462,P=0.008;ND:df=2,F=4.488,P=0.023)。组内发育分析表明,LD组雄鼠睾丸重量在6周龄达到稳定水平;SD组雄鼠睾丸重量在12周龄和24周龄之间差异显著(P=0.047),而ND组雄鼠睾丸重量在6周龄和24周龄之间差异显著(P=0.009);这说明SD处理雄鼠的睾丸生长在12周龄之前缓慢,快速增长主要集中在12~24周龄内,而ND组则呈现出较为平缓的增长趋势。组间比较表明,LD组在6周龄睾丸即达到稳定水平,且在3组中处于最高水平;SD组和ND组在6周龄时显著低于长光照组,而12周龄和24周龄3组雄鼠间差异不显著。这些结果说明,长光照下雄鼠睾丸在6周龄进入发育稳定期,而短光照处理对雄鼠睾丸发育的抑制作用主要在6周龄之前,6~12周龄抑制作用减弱,而12~24周龄抑制作用不显著。
储精囊发育(图2c)与睾丸重量类似,在3组间表现出很大差异。在6~24周内,LD组雄鼠储精囊重量无显著变化(df=2,F=2.455,P=0.118),而SD组和ND组雄鼠则出现显著增加(SD: df=2,F=8.382,P=0.003;ND: df=2,F=7.241,P=0.004)。组间发育比较表明,LD组雄鼠储精囊重量虽未表现出显著差异,但是6周龄时平均重量仅为12和24周龄的一半;SD组和ND组储精囊重量趋势一致,在6周龄和12周龄间均无显著差异,而24周龄则出现显著升高(P<0.05)。组间处理比较表明,LD组雄鼠储精囊重量在6周龄和12周龄显著高于SD组和ND组,在24周龄差异不显著,SD组和LD组始终无显著差异。这些结果说明,储精囊发育要慢于睾丸,长光照雄鼠储精囊发育在12周龄前完成,而短光照处理对雄鼠储精囊发育的抑制作用可达12周龄,在12~24周龄之间失效。
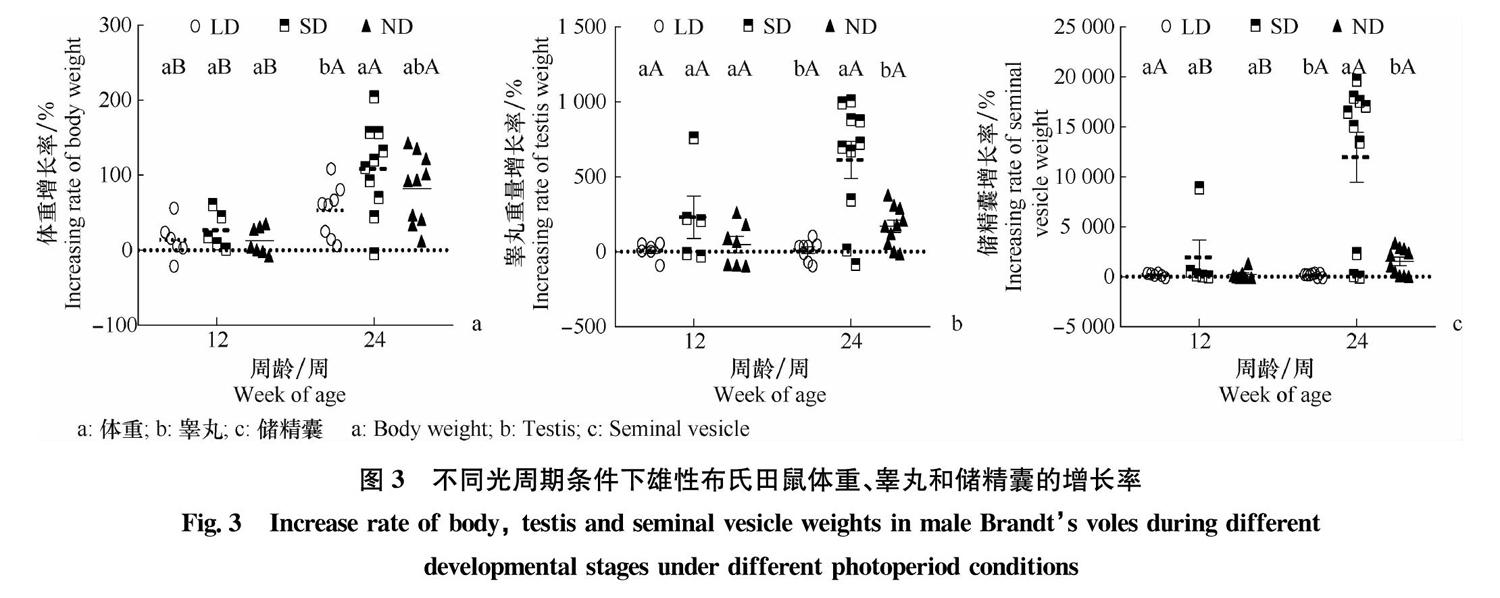
发育增速以各自光周期条件下6周龄为初始值进行分析(图3)。结果表明,在6~12周龄内,3组雄鼠在体重、睾丸和储精囊的发育增速无显著差异(One-way ANOVA,体重:df=2,F=0.621,P=0.551;睾丸:df=2,F=2.060,P=0.162;储精囊:df=2,F=1.317,P=0.297)。在12~24周龄内,在体重上,SD组最高,LD组最低,SD组增速显著高于LD组(t test:df=16,t=2.284,P=0.036);在睾丸和储精囊上,SD组增速显著高于ND组(睾丸:df=11.018,t=3.376,P=0.006;储精囊:df=9.507,t=4.117,P=0.002)和LD组(睾丸:df=9.619,t=4.773,P=0.001;储精囊:df=9.011,t=4.717,P=0.001),LD组和ND组无显著差异。
2.2 长短光照对雄性布氏田鼠粪便睾酮水平的影响
3组光周期处理雄鼠粪便睾酮变化趋势与睾丸和储精囊结果相似(图4)。在6~24周龄内,LD组雄鼠睾酮保持较高水平,且无显著波动(Kruskal-Wallis:χ2=7.247,df=6,P=0.299);而SD组和ND组雄鼠睾酮含量均出现显著增加(SD,χ2=20.312,df=6,P=0.002;ND,χ2=16.014,df=6,P=0.014);但是ND组雄鼠呈现出缓慢增加的趋势,而SD组雄鼠在6周龄后却呈现出了快速升高,并持续保持较高水平的趋势。组间分析表明,在6周龄时,LD组雄鼠睾酮水平显著高于SD组(Mann-Whitney:U=10.000,Z=-2.003,P=0.045)和ND组(Mann-Whitney:U=11.000,Z=-2.061,P=0.039);而12~16周龄内,SD组雄鼠睾酮水平显著升高,与LD组水平相当,显著高于ND组(12周龄:U=7.000,Z=-2.932,P=0.003;16周龄:U=13.000,Z=-2.614,P=0.009);在18~24周龄,3组雄鼠睾酮水平无显著差异。
以6周龄为初始值的粪便睾酮水平增速结果表明,在6~24周龄内,LD和SD组雄鼠睾酮增长率无显著变化(Kruskal-Wallis:LD,χ2=5.657,df=5,P=0.341;SD,χ2=6.042,df=5,P=0.302);ND组雄鼠睾酮增长率出现显著变化(χ2=11.654,df=5,P=0.040)。组间分析表明,在6~12周龄内,SD组雄鼠睾酮增速显著高于LD组(Mann-Whitney:U=2.000,Z=-2.635,P=0.008)和ND組(Mann-Whitney:U=10.000,Z=-2.666,P=0.008);在12~24周内,SD组睾酮增速均高于LD组和ND组,在14~16周内SD组睾酮增速显著高于LD和ND组(Mann-Whitney:U=6.000,Z=-2.475,P=0.013)和ND组(Mann-Whitney:U=14.000,Z=-2.531,P=0.011),在16~18周内SD组睾酮增速显著高于LD组(Mann-Whitney:U=5.000,Z=-2.593,P=0.010)(图4b)。
以上结果表明,与LD组相比,SD组与ND组睾酮水平在0~6周龄处于受抑制状态,LD组从6周龄睾酮水平进入稳定期。6~12周龄期间,与ND组相比,SD组睾酮水平迅速提高,指示在这一时期SD组具有更高的繁殖活跃状态。
3 结论与讨论
本研究通过对布氏田鼠雄鼠性腺重量和粪便睾酮水平的监测,对比分析了长光照、短光照和秋季自然光照对雄鼠出生后性腺发育模式的影响。结果表明,与长光照相比,短光照和秋季自然光照在6周龄前对雄鼠性腺起到明显抑制作用;6周龄后,两短光照组的抑制作用逐渐消失,而恒定短光照组呈现出更强的加速发育现象;至春季24周龄时,3种光照条件下雄鼠性腺均可达到性成熟状态,由这些结果可以得出两点结论:(1)光周期可以调控布氏田鼠出生后的性腺发育模式,呈现出长光照刺激、短光照抑制的特点;(2)长期(10周以上)的短光照处理不能持续抑制雄鼠的性腺活性,而呈现出对短光照不响应的特性。
光周期是季节性繁殖动物感知季节变化最重要的环境信号。许多研究表明,调整光周期长短可以调控许多小型鼠类的繁殖状态,使之呈现出“夏季”繁殖活跃或“冬季”繁殖抑制的现象[3,12]。仓鼠类是研究光周期反应很好的模式动物:叙利亚仓鼠和西伯利亚仓鼠均呈现出长光照保持性腺活跃,而短光照抑制性腺功能的现象[2]。刘伟等对比长光照(14 h白昼)和短光照(10 h白昼)条件下出生的布氏田鼠发现,在60日龄时,长光照雄鼠的睾丸、附睾及储精囊指数均显著高于短光照雄鼠[19]。这一点在本研究同样被证实:在出生后至12周龄(84日龄),短光照处理显著抑制了雄鼠的睾丸和储精囊发育,说明光周期在布氏田鼠出生后的性腺发育调控中具有重要作用,而且进一步说明了光周期对布氏田鼠性腺发育的影响效果可以持续更长(12周龄)。本研究所用的长短光周期比刘伟等采用的更长或更短,这可能是导致本研究中光周期效果更强的因素之一。
本研究的另一個结果是布氏田鼠中存在短光照不应现象。其表现为在12周至24周的短光照处理期间内,雄鼠性腺发育不再受短光照抑制,至24周已恢复到与长光照相似水平。仓鼠类的光周期反应和短光照不应性主要在成年个体中表现。例如,雄性叙利亚仓鼠在短光照的0~10周内性腺萎缩,但在28周恢复至与长光照(16 h白昼)下相似水平[14];雄性西伯利亚仓鼠则在短光照中16周后性腺开始恢复,至24周恢复至长光照水平[20]。我们之前在布氏田鼠成年鼠中未发现明显的对长短光周期的响应(实验室观察,未发表数据),但是新生鼠却对长短光照反应明显,短光照处理可以显著抑制其性腺发育至12周龄[17]。本研究则进一步发现了新生鼠性腺重量在12周龄后对短光照出现不应性反应,而睾酮水平则表明在6周龄~12周龄不应性已经出现在激素水平。短光照不应性在固定短光照和自然渐变短光照中均可出现,固定短光照的睾酮水平要高于渐变短光照组,这可能是由于其早期抑制作用更强,而不应性表现更强所致[21]。短光照不应性的生态意义可能是为了保证季节性繁殖的动物在春季来临前提前调整好自身的生理状态,为繁殖做准备。在自然种群中,鼠类的繁殖行为和生理启动的早晚受到诸多环境的影响,性腺功能恢复不仅与光周期相关,还与参与繁殖鼠的年龄结构、贮草种类(营养状况),甚至小地形微环境(雪被厚度、坡向等)有关[14,22-23]。
最新研究表明,鼠类光周期不应性的神经内分泌机制可能是垂体和下丘脑对长期短光照的响应模式改变导致,光响应基因发生了显著改变。对于光周期信号响应,垂体中的促甲状腺激素(TSH,thyroid stimulating hormone)和下丘脑第三脑室室管膜细胞中的2型和3型脱碘酶(DIO2和DIO3)非常敏感,被认为是解析和传递季节信号的关键物质[2]。TSH和DIO2对性腺功能的活化和维持起促进作用,而DIO3则可能起到负向调节作用。Milesi等报道,在短光照不应性出现期间,雄性西伯利亚仓鼠的下丘脑中Dio3基因表达量的持续下降,下丘脑Dio2基因和垂体TSHβ(TSH的β亚基)基因的表达量持续上升[20]。我们对布氏田鼠野外种群的研究也表明,下丘脑Dio2和Dio3基因与光周期的自然变化和雄鼠的睾丸大小表现出显著的相关性,可能在其性腺的季节性变化中起到关键作用[16]。因此,垂体和下丘脑中的关键基因可能在布氏田鼠的光周期不应现象中起到关键性的调控作用。下一步应对光周期不应期间布氏田鼠的下丘脑基因进行检测,以明确其神经内分泌调控的分子机制。
参考文献
[1] NELSON R J, DENLINGER D L, SOMERS D E. Photoperiodism: The Biological Calendar [M]. New York:Oxford University Press, 2010: 1-365.
[2] IKEGAMI K, YOSHIMURA T. Circadian clocks and the measurement of daylength in seasonal reproduction [J]. Molecular and Cellular Endocrinology, 2012,349(1): 76-81.
[3] IKEGAMI K, YOSHIMURA T. Seasonal time measurement during reproduction [J]. The Journal of Reproduction and Development, 2013,59(4): 327-333.
[4] 张知彬,王祖望. 农业重要害鼠的生态学及控制对策[M]. 北京:海洋出版社, 1998:211-244.
[5] ELLIOTT J A. Circadian rhythms and photoperiodic time measurement in mammals [J]. Federation Proceedings, 1976,35(12): 2339-2346.
[6] GOLDMAN B D. Mammalian photoperiodic system: formal properties and neuroendocrine mechanisms of photoperiodic time measurement [J]. Journal of Biological Rhythms, 2001,16(4): 283-301.
[7] REITER R J. Evidence for refractoriness of the pituitary-gonadal axis to the pineal gland in golden hamsters and its possible implications in annual reproductive rhythms [J]. The Anatomical Record, 1972,173(3): 365-371.
[8] REITER R J. Pineal control of a seasonal reproductive rhythm in male golden hamsters exposed to natural daylight and temperature [J]. Endocrinology, 1973,92(2): 423-430.
[9] BRINKLOW B R, LOUDON A S. Evidence for a circannual rhythm of reproduction and prolactin secretion in a seasonally breeding macropodid marsupial, the Bennetts wallaby (Macropus rufogriseus rufogriseus) [J]. Journal of Reproduction & Fertility, 1993,98(2): 625-630.
