具有片层或原纤状结构的壳聚糖膜制备及性能比较
2020-08-25陈玄墨宁晚娥彭泽冶黄继伟林海涛
陈玄墨,宁晚娥,彭泽冶,黄继伟,林海涛
1.广西科技大学生物与化学工程学院(柳州 545006);2.广西糖资源绿色加工重点实验室(柳州 545006);3.广西高校糖资源加工重点实验室(柳州 545006)
壳聚糖是自然界三大生物质资源之一,其不仅具有来源广、安全、无毒、可生物降解等优点,还具有优良的生物相容性和抗菌性能,被广泛应用于食品、药品、生物医学工程、环境保护、精细化工等领域[1-8]。壳聚糖膜是壳聚糖基材料的最基本形式,大量研究聚焦于获得具有不同性能或功能的壳聚糖膜材料[9-11]。壳聚糖膜的性能或功能与其微细结构紧密相关,特别是壳聚糖膜微纳级层次结构,对壳聚糖膜的力学性能存在显著影响,直接关乎其在实际应用领域中的使用[12-15],对开发具有不同功能的壳聚糖膜,亦有深远意义。
壳聚糖膜制备的首要步骤是壳聚糖的溶解,而壳聚糖溶解的关键是溶剂。作为一种碱性多糖的壳聚糖难溶于水而易溶于稀酸,其中,乙酸是最常用的壳聚糖溶剂,其具有溶解壳聚糖速度快,分子降解小,溶液黏度适中等优点[16-18]。甲酸也是一种常用的壳聚糖溶剂,已有研究表明:相对于乙酸,在同一温度下,采用相同质量分数的甲酸可使等量的壳聚糖完全溶解[19-22]。同时,甲酸对大部分高聚物的溶解能力均优于乙酸,使得采用甲酸溶解壳聚糖获得的溶液更易于与其他高聚物进行混溶[23],这对甲酸作为溶剂溶解壳聚糖的应用极为有利。虽然乙酸与甲酸作为溶剂对溶解壳聚糖的研究较多,但就2种溶剂溶解壳聚糖所制膜的结构与性能研究却较少,特别是对两者成膜的微细结构及其与性能之间关系的研究鲜有报道。
试验分别采用甲酸与乙酸为溶剂,制备出具有片层状或原纤状结构的壳聚糖膜,进而对比分析了2种膜的力学性能、结构特征(XRD和FTIR)和热性能(TG、DTG和DSC)等的差异。试验结果不仅为制备具有不同层级结构的壳聚糖膜提供思路,更为以层级结构调控壳聚糖膜的性能提供参考。
1 材料与方法
1.1 材料与试剂
壳聚糖(脱乙酰度80%~95%,国药集团化学试剂有限公司);乙酸(质量分数99.5%,广东光华科技股份有限公司);氢氧化钠、甲酸(质量分数98%,西陇化工股份有限公司);试剂均为分析纯。
1.2 设备与仪器
DF-101S集热式恒温加热磁力搅拌器(巩义市予华仪器有限责任公司);DDS-307A电导率仪(上海仪电科学仪器股份有限公司);数显外径千分尺(桂林广陆数字测控有限公司);AX124ZH/E型电子天平(奥豪斯仪器有限公司);E43.104型电子万能试验机(美特斯工业系统有限公司);S-4800型冷场发射扫描电子显微镜(日本日立公司);X’Pert-Pro型全自动X射线衍射仪(荷兰PANalytical公司);Nico LET 5700型红外光谱仪(美国热电Nicolet公司);Q2000差示扫描量热仪、Discovery TGA 55热重分析仪(美国TA仪器公司)。
1.3 方法
1.3.1 壳聚糖的溶解
分别配置不同质量分数甲酸和乙酸溶液,称取一定量壳聚糖倒入指定质量分数的甲酸或乙酸溶液中,将所得混合溶液置于集热式恒温磁力搅拌器,在一定温度下匀速搅拌,使壳聚糖溶解。
1) 溶解时间的测定。分别取所配置的质量分数1%~5%甲酸和乙酸溶液20 mL置于烧杯中,分别称取壳聚糖0.3 g倒入其中(壳聚糖质量分数1.5%),设置集热式恒温磁力搅拌器的温度30 ℃,以200 r/min进行匀速搅拌,记录壳聚糖从开始加入酸溶液至完全无法观测到壳聚糖聚集块或颗粒为止所经历的时间,以此作为壳聚糖溶解时间。
2) 电导率的测定。分别取所配置的质量分数1%~5%甲酸和乙酸溶液20 mL置于烧杯中,分别称取壳聚糖0.1g倒入其中(壳聚糖质量分数0.5%),设置集热式恒温磁力搅拌器的温度30 ℃,以200 r/min匀速搅拌,采用DDS-307A电导率仪以设定的时间间隔逐次测定溶液的电导率值,其中,时间间隔设置为:第1 h内每间隔5 min测定1次,第2 h每隔10 min测定1次,第3 h每个30 min测定1次,之后每间隔1 h测定1次。
1.3.2 壳聚糖膜的制备
壳聚糖膜的制备过程主要分3个步骤,分别是壳聚糖溶解、铺膜和膜的后处理。
1) 壳聚糖膜的溶解与铺膜。分别取所配置的质量分数1%~5%甲酸和乙酸溶液20 mL置于烧杯中,分别称取壳聚糖0.6 g倒入,设置集热式恒温磁力搅拌器的温度30 ℃,以200 r/min匀速搅拌,待壳聚糖完全溶解后,将溶解好的壳聚糖溶液静置脱泡30 min,采用流延法将溶解液倒入塑料皿中,在室温条件下自然挥发干燥24 h后成膜。
2) 壳聚糖膜的后处理。将干燥的壳聚糖膜浸泡于0.5%氢氧化钠溶液2 h以中和膜中残余的酸。用去离子水对膜进行反复冲洗,将膜浸泡于1 000 mL去离子水中24 h以去除多余的氢氧化钠残留物,将膜在室温下干燥,备用。
1.3.3 壳聚糖膜的力学性能测定
分别将所制备的壳聚糖膜切成10 mm×30 mm条状。采用数显千分尺在每条上取5个点测其厚度,求其平均值作为该条膜试样的厚度。拉伸测试采用微机控制电子万能试验机进行,每一试验条件测试20次,测定条件为:拉伸速率10 mm/min,间距10 mm,测定环境温度25±1 ℃,相对湿度65%±5%。
1.3.4 壳聚糖膜的结构及热性能测试
分别选取3%甲酸和乙酸溶解壳聚糖制模各1份,用于SEM观察,选取1%和3%的甲酸和乙酸溶解壳聚糖制模各1份,将其剪碎至粉末状,用于XRD、FTIR、TG和DSC测试。
1) SEM观察:将壳聚糖膜用导电胶黏贴于样品台上,经喷金处理后,室温下采用S-4800型冷场发射扫描电子显微镜进行形态观察。
2) XRD测试:将所得壳聚糖膜粉末,采用X’Pert-Pro型X射线衍射仪进行测试,其中,X射线光源为CuKα射线,电压40 kV,电流25 mA,扫描速度10°/min,扫描范围0°~50°。
3) FTIR测试:将所得壳聚糖膜粉末采用KBr压片法在Nicolet 5700型傅里叶红外光谱仪进行测试,扫描范围500~4 000 cm-1,分辨率4 cm-1,扫描次数64次。
4) TG测试:采用Discovery TGA 55热重分析仪对所得壳聚糖粉末进行热失重分析,其中,温度范围0~750 ℃,升温速率10°/min,测试环境为氮气气氛,氮气流量20 mL/min。
5) DSC测试:采用Q2000差示扫描量热仪对所得壳聚糖粉末进行测试,其中,温度范围0~750 ℃,升温速率10 ℃/min,测试环境为氮气气氛,氮气流量20 mL/min。
2 结果与分析
2.1 壳聚糖溶解时间
分别以不同质量分数甲酸和乙酸为溶剂,在相同温度和搅拌速度条件下,溶解相同质量的壳聚糖所需时间的测定结果,见图1所示。
由图1可知,在溶解条件相同、溶解壳聚糖的量相同的情况下,甲酸溶解壳聚糖所需时间随其质量分数的增加而逐渐减小,乙酸则呈现出先减小后增加的趋势。分析认为,壳聚糖大分子间存在较强的氢键作用,易于形成规整的结晶结构,是一种具有较高结晶度的聚合物[24],而壳聚糖的溶解实质就是破坏掉其分子间的氢键和晶格结构[25]。因此,在酸溶液中,当氢离子(H+)活度达到一定程度,可使壳聚糖分子上的氨基(—NH2)质子化成铵根离子(—NH3+),进而使壳聚糖分子间的氢键断裂和晶格结构破坏,导致了壳聚糖的溶解[32]。在此过程中,酸溶液对壳聚糖溶解存在2种相关的作用机制,首先,酸根离子(HCOO-和CH3COO-)和壳聚糖分子上的—NH2之间存在一定吸引力,以盐键形式存在,当酸根离子体积大时,对糖苷键有位阻作用,使得溶解能力下降。其次,受酸电离出H+的影响,H+浓度越高,形成的机会越多,分子间的静电相互作用越强,分子间氢键越易于断裂,越有利于溶解。就本研究而言,甲酸作为最简单的有机酸,对可以电离H+的束缚力比较小,拥有更大的电离度,当溶液中甲酸的质量分数增加时,能释放更多的H+,提高H+活度从而加快壳聚糖的溶解[26]。在乙酸为溶剂时,低质量分数下的溶解情况与甲酸的溶解机理一致,升高到一定质量分数后,由于此时CH3COO-离子的浓度明显大于壳聚糖电离出来的—NH3+离子,使得正负离子之间的距离变小,导致离子之间吸引力增加,引起离子迁移速率降低,使得此时壳聚糖的溶解反而趋于困难[27]。
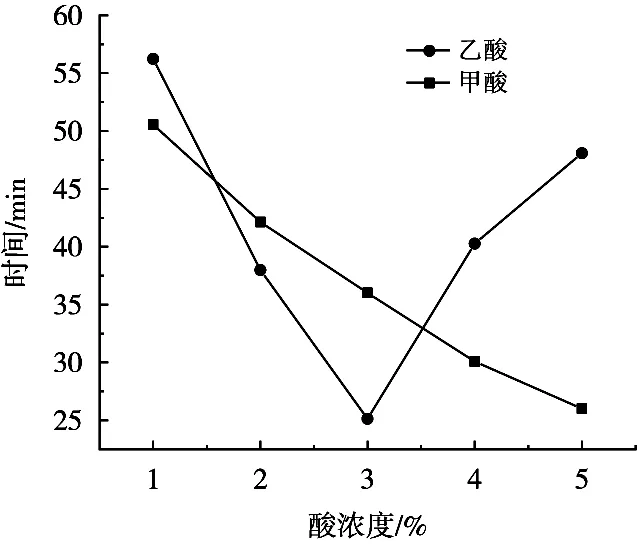
图1 不同质量分数甲酸或乙酸对壳聚糖溶解时间的影响
2.2 壳聚糖溶解中电导率的变化
以一定时间间隔,分别测定不同质量分数的甲酸或乙酸溶解相同质量壳聚糖的过程中电导率的变化,结果见图2所示。
从电导率值可以看出,甲酸溶解壳聚糖时溶液的电导率显著大于乙酸。从溶解过程中电导率的变化趋势可以看出,两种酸在溶解的开始阶段,电导率均有下降的趋势,且甲酸的下降幅度高于乙酸。另外,相对于甲酸,乙酸电导率在下降一段时间后,又呈现出上升趋势,且乙酸质量分数越低,这种上升趋势越明显。溶液的电导率趋于稳定。分析认为,甲酸的电离度较乙酸大,甲酸溶液中大量存在的H+与壳聚糖分子链上的—NH2反应生成为—NH3+,使得在较短时间内溶液中的游离H+急剧减少,验证甲酸溶液中H+浓度的提升加快壳聚糖溶解,待壳聚糖完全溶解后溶液中H+浓度趋于稳定,电导率不再出现明显变化。另一方面,就乙酸的溶解而言,乙酸溶液的电导率存在3个阶段的变化。在第1阶段,电导率曲线下降,但这种下降行为并不完全意味着壳聚糖的溶解,还存在一定的吸附或自聚集过程[26]。在第2阶段,随着壳聚糖溶解,溶液中—NH3+数目逐渐增多,溶液的电导率也随之增大[27],此时电导率的上升代表着壳聚糖溶解速度加快,壳聚糖分子逐渐舒展,分子迁移速度加快,使得溶液中的离子浓度增大。在第3阶段,随着壳聚糖的完全溶解,溶液中的各种离子处于相对稳定的状态,从而使曲线趋于平稳[19]。
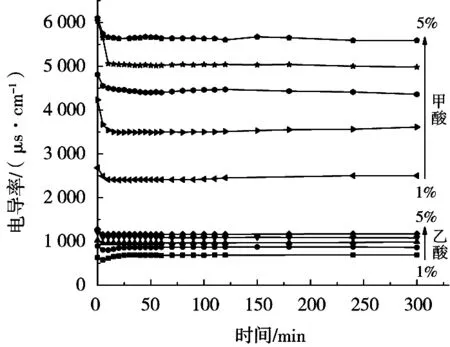
图2 不同质量分数甲酸和乙酸溶解壳聚糖时电导率的变化曲线
2.3 壳聚糖膜的形态特征
图3 所示为3%甲酸和乙酸为溶剂溶解等量壳聚糖制模表面的SEM图。结果表明,乙酸溶解壳聚糖制模的形态有类片层的结构,而甲酸溶解壳聚糖制模存在明显的原纤化结构,分析认为壳聚糖可甲酸中可自组装成原纤的结构。与此同时,发现甲酸溶解壳聚糖制模中存在一些空洞,这些空洞表现为原纤间隙。

图3 质量分数3%甲酸或乙酸溶解壳聚糖制膜的SEM
2.4 壳聚糖膜的力学性能
以不同质量分数甲酸和乙酸为溶剂溶解等量壳聚糖制模,对所制膜进行拉伸测试,图4所示为典型的拉伸测试应力-应变曲线,表1所示为2种酸溶解膜的强度及伸长率的统计分析结果。
由图4和表1可知,酸质量分数较低(1%和2%)时,甲酸溶解壳聚糖所制的膜的强度、断裂伸长率和杨氏模量均低于乙酸,随着酸质量分数的增加(3%,4%和5%),甲酸溶解壳聚糖制模的断裂强度逐渐增加,断裂伸长率和杨氏模量逐渐下降,而乙酸溶解壳聚糖制模的断裂强度却逐渐下降,断裂伸长率和杨氏模量逐渐增加。另外,在酸质量分数为3%,4%和5%时,甲酸溶解壳聚糖制模的断裂强度优于乙酸,断裂伸长率和杨氏模量劣于乙酸。综合评判可知,甲酸溶解壳聚糖膜的更硬更脆,而乙酸溶解的壳聚糖膜更有韧性,特别是随着酸质量分数的增加,这种差异约明显。

图4 不同质量分数的甲酸或乙酸溶解壳聚糖制膜的应力-应变曲线
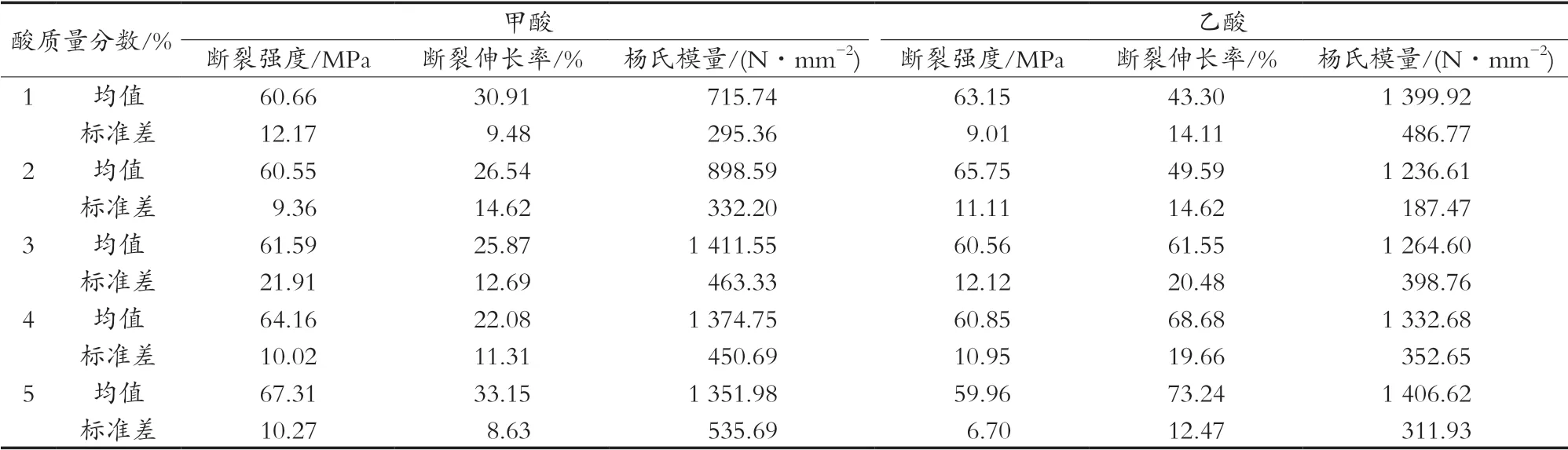
表1 不同质量分数的甲酸或乙酸溶解壳聚糖制膜的力学性能数据统计
2.5 XRD与FTIR分析
分别对采用1%和3%质量分数的甲酸与乙酸溶解壳聚糖所制膜进行粉末X射线衍射测试和红外光谱测试,其结果分别见图5和图6所示。
由图5可知,甲酸与乙酸溶解壳聚糖所制膜在10.5°和20.0°附近均存在较强衍射峰。其中,10.5°附近的衍射峰归属于FormⅠ晶形,20.0°附近的衍射峰归属于FormⅡ晶形,说明两者具有类似的半结晶结构[28-29]。然而,甲酸溶解壳聚糖所制膜在15°附近存在一个较强的衍射峰,而乙酸溶解壳聚糖制模却没有,一般认为,15°附近的衍射峰为无水结晶峰,对应于壳聚糖的无定形结构(也翻译成非晶态结构)[30-31]。结合力学测试的结果可知,甲酸溶解壳聚糖所制膜具有更高的强度,但延伸性却较乙酸溶解壳聚糖膜差,这或许是由于甲酸具有一定的诱导结晶作用,使甲酸溶解壳聚糖所制膜具有更高的结晶度所致。
由图6所示可知,分别采用1%和3%质量分数的甲酸与乙酸溶解壳聚糖所制膜的FTIR谱图并无显著差异。其中,893 cm-1为壳聚糖的六元环的伸缩振动吸收峰,1 025 cm-1为C—O伸缩振动(一级醇羟基),1 062 cm-1为C—O的伸缩振动(二级醇羟基),1 149 cm-1为C—O—C的不对称变形振动,1 258 cm-1为O—H属于C3上的二级羟基和C6上的一级羟基的C—O伸缩振动,1 317 cm-1为C—N伸缩振动和N—H弯曲振动(酰胺Ⅱ谱带),1 377 cm-1附近为CH2弯曲振动,1 420 cm-1为CH3弯曲振动,1 587 cm-1处的吸收峰为C=O伸缩振动(酰胺Ⅰ谱带),1 652 cm-1处的吸收峰为N—H弯曲振动(包括酰胺Ⅱ谱带δ(C—N)+δ(N—H)),2 867 cm-1和2 922 cm-1附近为甲基和次甲基的C—H伸缩振动[33],3 361 cm-1附近为N—H的伸缩振动,3 452 cm-1附近为O—H的伸缩振动[34]。乙酸溶解壳聚糖所制膜在3 452 cm-1处存在的弱峰比甲酸在此处明显。通常,3 452 cm-1附近被认为是羟基的伸缩振动,是分子间羟基间的氢键形成所致。这或许可作为解释乙酸溶解壳聚糖所制膜具有更好延伸性的原因之一。

图5 甲酸与乙酸溶解壳聚糖所制膜的FTIR谱图
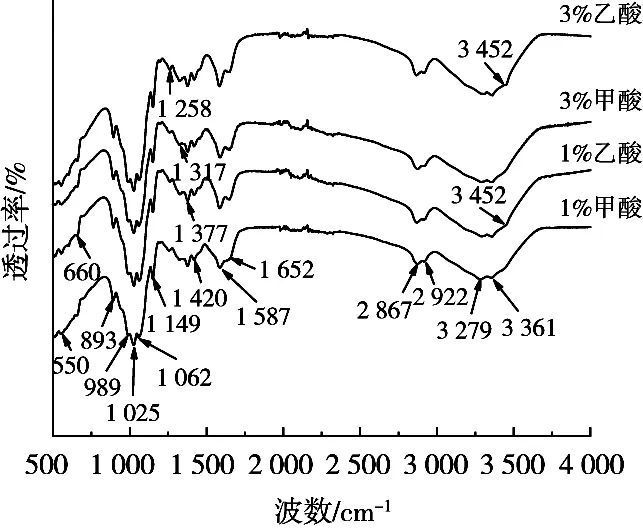
图6 甲酸与乙酸溶解壳聚糖所制膜的FTIR谱图
2.6 热分析
分别对采用质量分数1%和3%的甲酸与乙酸溶解壳聚糖所制膜进行TGA/DTG测试和DSC测试,其结果分别见图7和图8所示。

图7 甲酸与乙酸溶解壳聚糖所制膜的TGA/DTG图
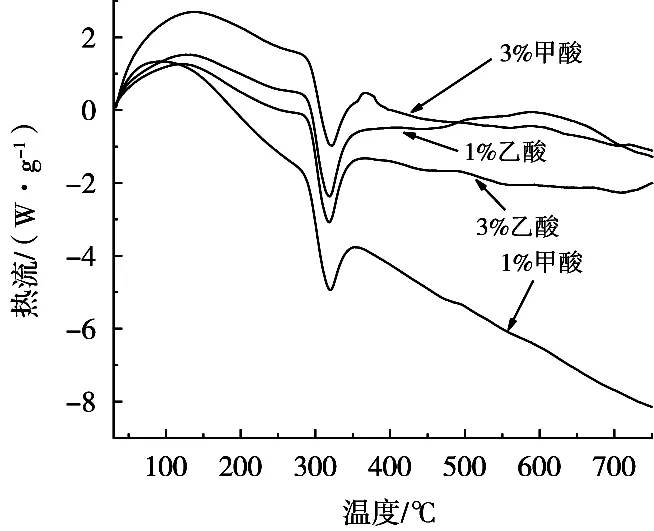
图8 甲酸与乙酸溶解壳聚糖所制膜的DSC谱图
图7 (A)为壳聚糖膜的热失重曲线(TGA)。随着温度升高,壳聚糖膜质量逐渐损失,呈现出明显的3阶段变化趋势:第1阶段位于30~260 ℃,其归属于壳聚糖膜中水分的散失,质量损失10%~15%;第2阶段位于260~360 ℃,其表现为急剧的质量损失,对应于壳聚糖的热分解,至该阶段结束壳聚糖膜剩余约50%左右;第3阶段位于360~750 ℃,该阶段的质量损失明显放缓,说明壳聚糖热分解逐渐结束,最终壳聚糖剩余约37%左右。图7(B)是壳聚糖膜的DTG曲线,是壳聚糖膜TGA曲线对温度求一阶导数所得的曲线,由图可知,壳聚糖膜存在2个主要的失重过程,第1阶段出现在125 ℃左右,与水的蒸发有关;第2阶段出现在312 ℃附近(起始温度262 ℃,结束温度361℃),对应的是壳聚糖的分解[35]。不同的酸及其不同酸质量分数下溶解的壳聚糖溶液具有近乎相同的失重变化。甲酸溶解壳聚糖膜的热分解残余多于乙酸溶解壳聚糖膜,这可能与甲酸具有较高的结晶度有关。
由图8可知,所有壳聚糖膜在100 ℃左右出现一个吸热峰,这归因于壳聚糖膜中水分的损失;在320 ℃左右出现一个放热峰,这归因于壳聚糖膜的分解。甲酸质量分数由1%提升至3%时,壳聚糖膜的DSC曲线最大值由85 ℃变为135 ℃,表明甲酸与壳聚糖反应使得壳聚糖膜拥有更加紧密的结构,导致水分蒸发温度提升,需要更多能量释放水分[26]。乙酸溶解的壳聚糖膜的吸热峰均出现在125 ℃,说明乙酸质量分数对壳聚糖膜结构并没有显著影响。
3 结论
分别以甲酸与乙酸为溶剂溶解壳聚糖制备,获得2种具有不同微纳层级结构的壳聚糖模型,进而就2种壳聚糖膜的力学性能、结构特征和热学性质等进行对比分析。
1) 从溶解及溶液性质上看,甲酸与乙酸溶解壳聚糖的速度和性质显著不同。甲酸溶解壳聚糖随着其酸质量分数增加而加快,乙酸则呈现出先加快后减慢趋势,酸质量分数大于3%时,甲酸溶解壳聚糖的速度明显大于乙酸。甲酸溶解壳聚糖溶液的电导率明显大于乙酸。
2) 甲酸溶解壳聚糖所制膜具有明显的原纤化结构,而乙酸溶解壳聚糖所制膜具有片层状结构特征。对比原纤化的甲酸溶解壳聚糖膜与片层状的乙酸溶解壳聚糖膜可知,乙酸溶解壳聚糖所制膜具有更好的力学性能,特别是断裂伸长率和模量较高,但相对于甲酸溶解壳聚糖所制膜,其断裂强度却较低。
3) XRD和FTIR测试分析结果反映出甲酸溶解壳聚糖膜具有更高的结晶度,而热分析(TG/DTG和DSC)结果表明两者的热学性质差异不大,但在相同温度范围内,甲酸溶解壳聚糖所制膜的热分解残余更多。
