水体碱度组成测定及其应用的教学探讨
2020-08-24张泽志
张泽志, 王 瑾, 高 霞
(河南财政金融学院 环境经济学院,河南 郑州 450046)
0 引言
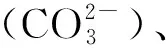
碱度是判断水质和废水处理控制的重要指标[3-4],亦常用于评价水体的缓冲能力及金属在其中的溶解性和毒性等。碱度的测定多以酸碱滴定法[5-6],即以水中所含能与强酸定量作用的物质总量测定,有连续滴定和分别滴定两类方式。教材[6]中分别滴定方式中因采用两种混合指示剂分别确定终点,且用符号pH8.3和pH4.8表示碱度组成,结论较为抽象且给出较为突兀,教材和其他资料对此鲜有解释,在教学中发现学生对此理解困难,甚至产生厌学情绪。因此,基于多年教学实践的积累,笔者采用图示和推理相结合的方法将抽象的结论演变通俗易懂结论,调动了学生的学习积极性,取得较好的教学效果。
1 实验用品及组成测定
1.1 实验用品
含碱水样、盐酸标准溶液(0.050 00 mol/L)、百里酚蓝-甲酚红混合指示剂、溴甲酚绿-甲基红混合指示剂、锥形瓶、酸式滴定管等。
1.2 组成测定
取两份同体积含碱水样,第一份加入百里酚蓝-甲酚红混合指示剂(简写为百-甲指示剂),用盐酸标准溶液滴定至指示剂由紫色变为黄色,终点的pH=8.3,消耗标准盐酸溶液体积记为VpH8.3;第二份加入溴甲酚绿-甲基红混合指示剂(简写为溴-甲指示剂),用盐酸标准溶液滴定至指示剂由绿色变为浅灰绿色,终点的pH=4.8,消耗标准溶液体积记为VpH4.8,由表1数据可判断水中碱度组成和表示[6]。
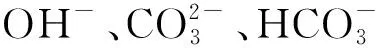
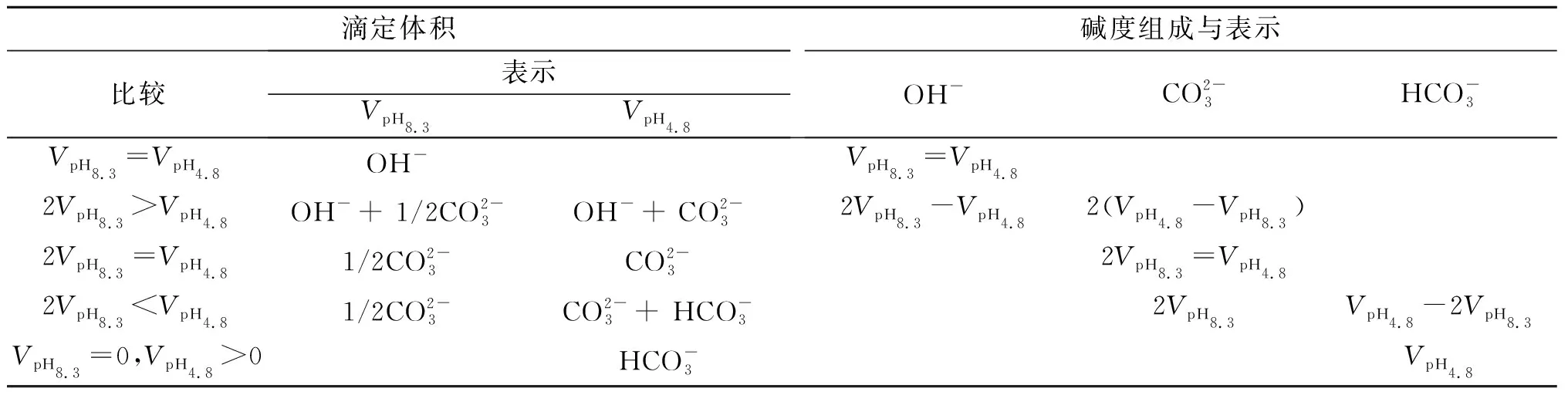
表1 水中碱度组成和浓度
2 教学探讨
2.1 碱度组成测定的推导
为方便学生理解,笔者将实验过程采用框图形式表述,如图1所示。

图1 水中碱度的分别滴定过程Fig.1 Titration of alkalinity using different indicators in water
以下按表1所述分5种情况讨论。

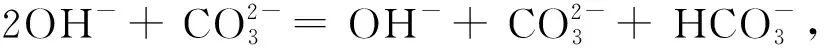

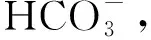
将2×①-②得,OH-=2VpH8.3-VpH4.8,即水体中的OH-消耗盐酸标准液的体积为V=2VpH8.3-VpH4.8。
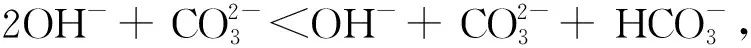
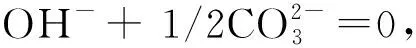
图1和以上讨论清晰明了地解释了表1中各项的来由,使学生听得懂、理得清、记得住、用得好,激发了同学们的积极性,避免了死记硬背。
2.2 碱度组成测定的应用
理解了表中内容,在做题时就能得心应手。
例1取水样100 mL,用0.050 00 mol/L的HCl溶液滴定至pH为8.3,混合指示剂由紫红色变为黄色用去2.00 mL;另取同样水样用前述HCl溶液滴定至pH为4.8,混合指示剂由绿色变为浅紫色用去3.00 mL,求该水样的碱度组成(以CaO计)。(重庆大学考研习题)
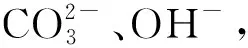
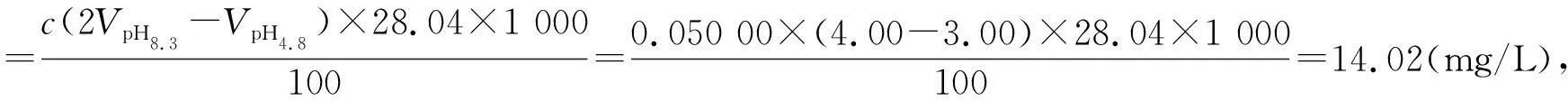
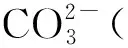
3 结论
采用图示和推导的教学方法,对水体碱度组成测定及应用进行了探讨,将抽象的结论通过代数关系演变成通俗易懂的推理结果,过程清楚易懂,结论一目了然。通过示例让同学们真正理解如何进行水体碱度组成判断和相关计算,激发了学生的学习积极性,取得很好的教学效果,同时亦克服了同学们原有的对从事水质分析工作的畏惧心理。
