柳杉优良无性系组培快繁体系研究
2020-08-24张俊红许雯婷楼雄珍童再康
王 晨,张俊红,张 苗,许雯婷,楼雄珍,童再康
(浙江农林大学 省部共建亚热带森林培育国家重点实验室,浙江 杭州 311300)
柳杉Cryptomeria fortunei为杉科Taxodiaceae柳杉属Cryptomeria常绿高大乔木,是中国特有的用材与绿化树种。天然种群集中分布于东南部的武夷山和天目山山脉,长江以南省区多有栽培[1]。柳杉生长快,生长期持久,树干通直,材质优良,可广泛应用于建筑、桥梁、家具等,且树姿雄伟,树形优美,是优良的园林绿化树种。同时,柳杉叶片对空气颗粒物有着较强吸附能力,是重要环保树种[2]。目前柳杉研究主要集中在育苗[3−6]、良种选育[7]、病虫害[8−9]与生理生态[10−11]等方面。此外,学者进行了简单重复序列(simple sequence repeat,SSR)分子标记引物筛选[12]与材性相关基因的筛选[13]等分子生物学方面的初步探索。此前柳杉种苗繁育仍采用播种[3−4]、扦插[5]与嫁接[6]等常规扩繁方法,但即便是良种选育,也存在优良材料繁殖系数低、繁育周期长等问题,有性繁育子代分离难以保持优良性状。植物组织培养是目前植物快速繁殖的重要手段,具有繁殖系数高、生产速度快、受外界环境影响小、可实现工厂化育苗、全年生产等优点,在良种繁育上已具有诸多成功案例[14]。如张翠萍等[15]以柳杉种胚为实验材料,通过柳杉试管苗繁殖技术研究,建立了种子试管苗组培快繁体系;但该体系仅能应用于分离世代的种子材料,受种胚采集时间和环境限制,繁殖效率偏低。祝晨辰等[16]以柳杉优良无性系的茎段为外植体,建立了柳杉优良无性系繁育技术体系,但不定芽增殖效率较低(1.23~5.00)。为提高柳杉的不定芽增殖效率,本研究以柳杉优良无性系的茎段为外植体,以高效分段培养的方式进行组织快繁,以期建立高效无性繁殖技术体系,为柳杉良种生产性规模化快繁提供参考。
1 材料与方法
1.1 材料
以浙江省文成县石垟林场20年生柳杉无性系测定林中3个植株健壮、性状优良的无性系作为外植体,取当年生幼嫩枝条,用洗涤剂浸泡30 min后轻刷枝条表面,并将其剪成独立的带顶芽茎段,流水冲洗2 h。无菌条件下用质量浓度75.0%的乙醇浸泡20 s,再用质量浓度0.1%的升汞消毒8 min,无菌蒸馏水冲洗4~5次,每次1~2 min。
1.2 培养基及培养条件
1.2.1 不定芽的诱导与增殖 为探索基本培养基、水解酪蛋白(CH)对不定芽诱导与增殖的影响,采用MS、DCR和WPM等3个基本培养基 , 分别 添加 蔗 糖 30 g·L−1, 琼 脂粉 7 g·L−1,pH值调至 5.8;设置 6-苄氨基腺嘌呤 (6-BA,0.10、0.50 和 1.00 mg·L−1)、吲哚丁酸 (IBA,0、0.10 和 0.30 mg·L−1)、水解酪蛋白 (CH,0、0.50和1.00 g·L−1)各3个水平,使用L9(34)正交实验(表1)。每瓶接种2~3个茎段,每个处理10瓶,重复3次,40 d后统计数据,计算不定芽诱导率与增殖系数。
1.2.2 不定芽的伸长 前期实验发现,组织培养过程中<1 cm的不定芽操作效率偏低,微扦插生根效果不佳。本实验将芽长≥1 cm的不定芽定义为有效芽。为解决上一步实验中不定芽萌发多但有效芽少的问题,调整培养基植物生长调节剂质量浓度,设计 B1(WPM+1.00 mg·L−16-BA+0.10 mg·L−1IBA)、B2(WPM+0.20 mg·L−16-BA+0.02 mg·L−1IBA)和 B3(不添加植物生长调节剂的WPM培养基)等3个培养基组合,每瓶接种3~5个茎段,每个处理10瓶,重复3次。40 d后观察芽伸长情况,统计数据。
1.2.3 生根培养 剪取不定芽长≥1 cm的有效芽进行生根培养。在DCR和WPM培养基中添加0.10 mg·L−1IBA和不同质量浓度(0、0.01、0.10 mg·L−1)萘乙酸(NAA),每瓶接种3个有效芽,每个处理10瓶,重复3次。30 d后观察并统计数据。
1.2.4 炼苗移栽 生根培养约40 d后,将株高≥5 cm且根系发达的柳杉无菌苗移至V(泥炭)∶V(蛭石)=1∶1的混合基质常规管理。30 d后调查移栽存活率。
1.3 培养条件
以上培养条件均为光照时间16 h·d−1,光强2 000 lx,培养温度(23±2) ℃。
1.4 数据处理与统计分析
根据实验获得数据,分别计算以下指标。
芽诱导率=出芽外植体数/总接外植体数×100%。芽增殖系数=诱导出的不定芽总数/外植体总数。有效枝条增长率=诱导出的有效枝条总数/原有效枝条总数×100%。不定根的诱导率=生根的枝条数/接种枝条总数×100%。平均不定根数=生根的总数/诱导出不定根的枝条数。平均根长=不定根的总长度/诱导出不定根的枝条数。移栽存活率=移栽存活的苗数/移栽的总苗数×100%。繁殖潜能(株·株−1·a−1)=繁殖系数3.75×生根率×移栽存活率。
采用SPSS 17.0和Excel先对百分率数据进行反正弦转换,再进行方差分析和LSD多重比较。
2 结果与分析
2.1 不同培养基对柳杉芽诱导与增殖的影响
由表1知:各无性系在所有培养基中均能形成不定芽,但不同处理间芽的诱导率与增殖系数存在差异。综合来看,A8处理优于其他组合,不定芽诱导率和增殖系数达到最高,分别为100%和9.13。外植体在培养基中7 d左右开始萌动,针叶基部的芽点膨大,随后逐渐伸长,萌发出芽(图1A)。从芽的生长状况来看,A8芽萌发较多,叶色翠绿,生长健壮(图1B);A1芽萌发少,叶色较黄,芽苗瘦弱,生长状况较差(图1C)。
根据正交实验结果进行极差分析,结果见表2。从诱导率来看,6-BA对柳杉茎段不定芽诱导率的影响占主导地位,极差(R)达40.63,其次是IBA(15.07)和基本培养基(12.82),最后是CH(5.91)。其中最佳水平6-BA为1.00 mg·L−1,IBA 为 0.10 mg·L−1,CH 为 0.50 g·L−1,最佳基本培养基为DCR。因此,柳杉芽诱导与增殖的最佳基本培养方案为WPM+1.00 mg·L−16-BA+0.10 mg·L−1IBA。
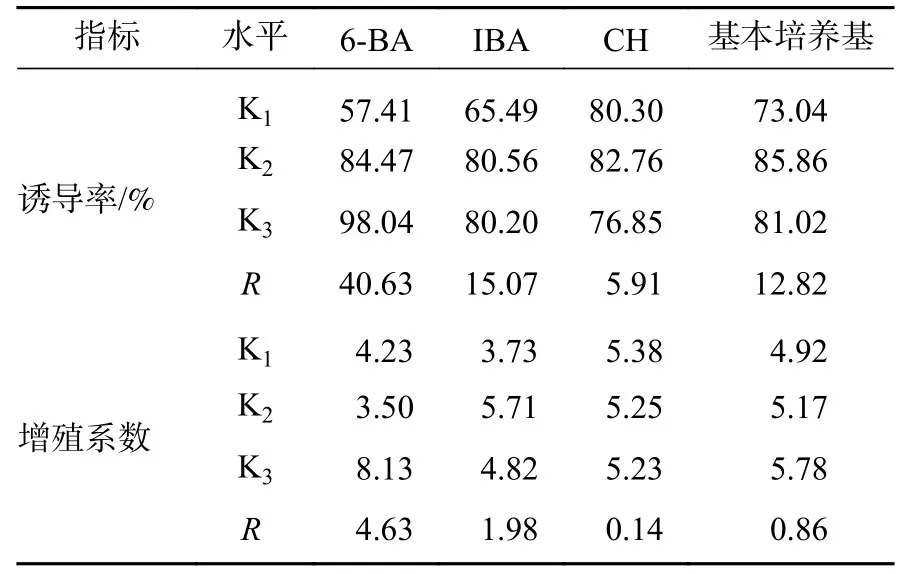
表2 不定芽诱导与增殖实验结果极差分析Table 2 Range analysis on the induction and proliferation of adventitious buds
方差分析发现(表3):6-BA对柳杉茎段不定芽的诱导率及增殖系数均有极显著影响(P<0.01),基本培养基与IBA质量浓度对柳杉茎段不定芽的增殖系数有显著影响(P<0.05)。
2.2 不同质量浓度植物生长调节剂对柳杉不定芽伸长的影响
在继代培养过程中,将幼芽接入最佳诱导增殖培养基后,各无性系不定芽增殖系数显著提升。培养40 d后,接入不定芽伸长培养基。结果表明(表4):相较于添加高质量浓度植物生长调节剂的培养基,低质量浓度或不添加植物生长调节剂的培养基对柳杉不定芽的伸长有显著促进作用。其中B3处理下柳杉芽伸长效果最好,有效枝条多,长势良好,有效枝条增长率达到456.87%;B1处理下柳杉芽基本没有伸长,短芽多,植株发黄,甚至死亡。由图1D(培养1 d)、图1E(培养7 d)、图1F(培养40 d)可知:B3处理下柳杉芽伸长良好。
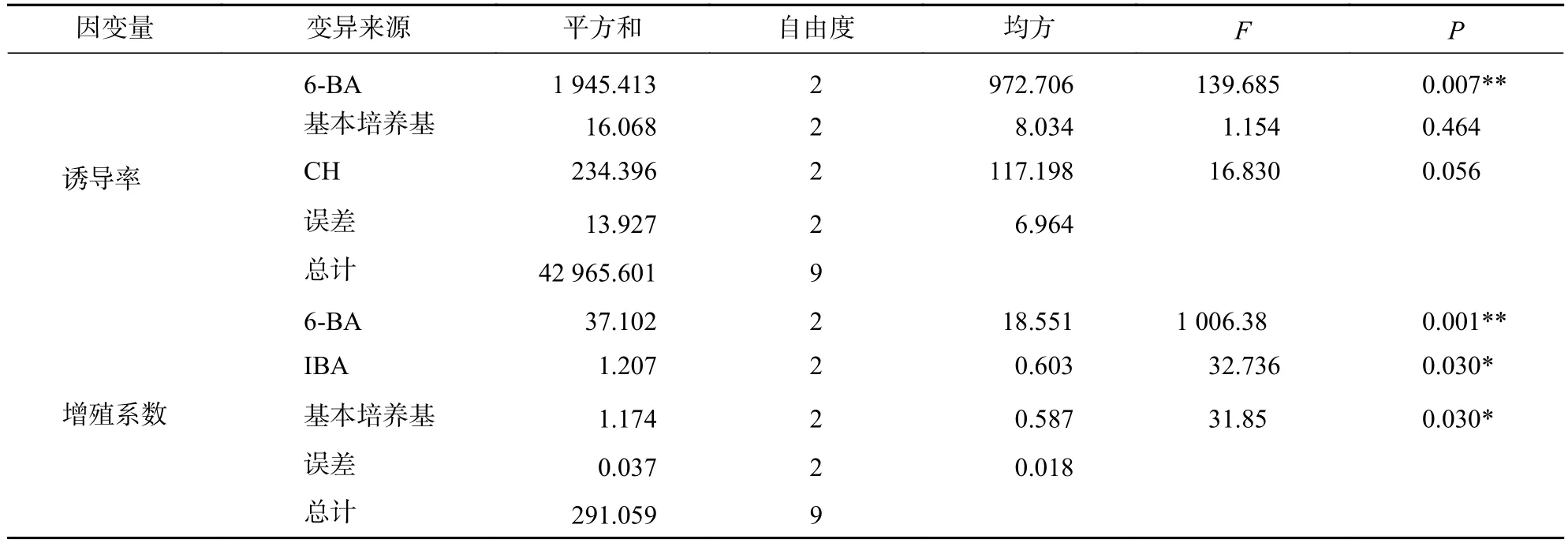
表3 不同因素对茎段不定芽诱导与增殖影响的方差分析Table 3 Variance analysis on the induction and proliferation of adventitious buds
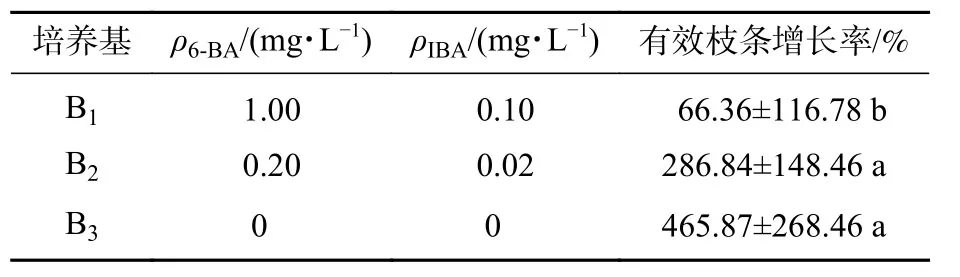
表4 不同质量浓度植物生长调节剂对不定芽伸长的影响Table 4 Effects of different concentrations of plant growth regulators on elongation of adventitious buds
2.3 不同培养基对柳杉不定根发生的影响
待枝条生长到2~3 cm时剪下,插入生根培养基进行生根培养。结果表明(表5):幼苗在2种基本培养基中生根情况无显著差异。当培养基中添加0.10 mg·L−1IBA时,枝条的生根率达到100%,生根速度较快,根多且健壮。平均生根数随着NAA质量浓度的升高而增加,但平均根长减小(图1G )。当培养基中添加少量NAA时,幼苗基部先分化出少量愈伤组织,随后从愈伤组织中分化出根,根条细弱,根数较多,根长度较短。随着NAA质量浓度升高,生根率逐渐降低,愈伤组织增多;至0.10 mg·L−1时,幼苗基部分化出大量愈伤组织,生根受到抑制,茎段发黄,最终整株死亡。C1处理下柳杉幼苗生根率较高,根长度大,与其他处理差异显著。因此,DCR+0.10 mg·L−1IBA为生根的最适培养基。幼苗在最佳不定根诱导培养基中生长,7 d左右长出白色的根尖,之后根迅速伸长,30 d后形成良好根系。由图1G可知:无性系在C1培养基中生根情况最好。

图1 柳杉茎段的不定芽诱导和植株再生Figure 1 Adventitious buds induction and plant regeneration of C. fortunei sterile seedlings

表5 不同培养基对生根的影响Table 5 Effects of different mediums on the percentage of rooting
2.4 炼苗与移栽
组培苗经炼苗移栽,约15 d后发出新芽。检查根部有新根长出即移栽成活,移栽成活率达96.70%,成活植株长势较好且一致。图1H可知:无菌苗移栽1、15和40 d后生长良好。
2.5 分段培养效果
将诱导与继代增殖的不定芽进行分段培养。首先,将经消毒的外植体接入诱导与增殖培养基进行不定芽的诱导与增殖;接着,将诱导与增殖的不定芽接入伸长培养基进行伸长培养;然后,将经过伸长培养的枝条剪下,一部分接入生根或增殖不定芽,进行分段循环培养;最后,将生根完成的无菌苗移栽炼苗,投入常规容器苗培育。经分段培养的组培苗,各无性系不定芽得到有效利用,有效枝条比例显著提升,单个外殖体的繁殖潜能高达 3 865 株·株−1·a−1。
3 讨论与结论
3.1 讨论
植物组织培养中,基本培养基的区别主要在于无机盐的种类和含量的不同[17]。MS培养基中无机盐和离子浓度较高,具有较稳定的离子平衡,养分的数量和比例合适,因而适用范围比较广,是多数植物组织培养快速繁殖的基本培养基。相较于MS培养基,DCR与WPM培养基均是低盐培养基。本实验结果表明:DCR与WPM培养基的诱导效果均优于常用的MS基本培养基;不定芽诱导中DCR培养基效果最佳,不定芽增殖中WPM效果最佳。这与低盐培养基更适合于外植体生长和增殖的报道相符[18]。
植物生长调节剂尤其生长素和细胞分裂素在调控离体器官发生中起关键作用[19]。本研究中选用6-BA和IBA作为植物生长调节剂,选用CH作为营养物质,研究不同组合在柳杉芽诱导过程中的作用。结果表明:6-BA最佳质量浓度为1.00 mg·L−1,同时添加少量的IBA(0.10 mg·L−1)诱导率可达100%,增殖系数达到9.0以上。有研究[20]表明:CH对猕猴桃Actinidia chinensis芽苗的生长有一定促进作用;本研究中,添加CH的处理组合其诱导与增殖效果均无明显差异,可见CH不适用于柳杉不定芽的诱导与增殖。
有研究认为:繁殖系数过高,不定芽过度增殖会引起组培苗弱化,生长势变差[21]。崔佩荣[22]在对紫萼Hosta ventricosa继代增殖培养时发现:有效芽增殖系数随着植物生长调节剂质量浓度增加呈先上升后再下降规律,影响有效芽增殖。本研究采用高质量浓度植物生长调节剂培养基与低质量浓度植物生长调节剂培养基交替继代,对柳杉组培苗进行分段培养,可有效解决上述问题,显著加快柳杉组织培养进程,为工厂化育苗提供了有效途径。
大量研究[23]表明:培养基的无机盐质量浓度降至一半,可有效提高大多数植物的生根能力;WPM和DCR培养基是低盐培养基,因此常和不同质量浓度植物生长调节剂配合诱导组培苗生根。本实验利用WPM和DCR培养基配合低质量浓度的IBA诱导生根,柳杉幼苗生根率高达100%,同时生根较快,根系健壮。生根的无菌苗移栽至V(泥炭)∶V(蛭石)=1∶1的基质中,浇透水,保持相对湿度90%~100%,30 d后存活率达96.70%。
3.2 结论
本研究建立的柳杉外植体分段培养再生体系,主要包括丛生芽诱导、伸长、生根及移栽等。不定芽诱导与增殖阶段,无性系在WPM+1.00 mg·L−16-BA+0.10 mg·L−1IBA中培养,不定芽诱导率(100%)和增殖系数(9.13)显著高于其它处理;不定芽伸长阶段采用高-低质量浓度植物生长调节剂培养基交替分段培养,柳杉无性系继代增殖效果良好,有效枝条增长率可达到456.87%;生根培养阶段,无性系离体生根的最适宜培养基为DCR+0.10 mg·L−1IBA,且3个无性系生根率最高可达100%;炼苗移栽阶段,生根的无菌苗移栽至V(泥炭)∶V(蛭石)=1∶1的混合基质,经过15~20 d炼苗,成活率高达96.70%。从不定芽的诱导到生根仅需4~5个月,繁殖潜能高达3 865株·株−1·a−1。综上所述,柳杉分段培养的组培模式可有效解决柳杉外植体丛芽分化能力强而芽伸长不足的问题。
