百合灰霉病对东方百合不同抗性品种的生理影响1)
2020-08-24李芳乐管玲玲胡凤荣
李芳乐 管玲玲 胡凤荣
(南京林业大学,南京,210037)
百合(Liliumspp.)是单子叶植物亚纲百合科(Liliaceae)百合属(Lilium)所有种类的总称。作为世界著名观赏花卉之一,应用广泛。东方百合(LiliumorientalHybrid)作为百合的知名栽培品种之一,花色丰富、花形较大且具特殊香味,观赏及应用价值高。随着百合栽培面积的不断扩大,病害的发生日趋严重。而引起百合病害的种类很多,其发病症状各异,较常发生且研究较多的几种病害有灰霉病、炭疽病、枯萎病以及由镰刀菌引起的根腐病、基腐病、斑点病等。
百合灰霉病是百合的主要病害之一,其病原菌为椭圆葡萄孢(Botrytiselliptica(Berk.) Cooke)[1]。它能侵染百合叶、茎秆、花及鳞茎,造成叶片枯萎,花蕾腐烂,植株提早死亡,影响鳞茎质量,严重遏制百合的生产,一般产量损失20%~30%,严重时可造成失收[2]。由于长期大量依赖杀菌剂防治灰霉病,已使灰霉菌对各种杀菌剂产生抗药性,也成为生产上亟待解决的一大难题。选育和利用抗病品种,则是一种更为经济、有效、安全的方法。但由于大量的研究工作只注重于药剂防治,对灰霉菌引发的病害缺乏机制等方面的深入研究,更没有筛选到有效的抗原材料,致使百合抗灰霉病的育种工作进展缓慢。
目前,关于植物受病害胁迫后,细胞内物质新陈代谢变化的报道较多,如黄瓜(CucumissativusLinn.)枯萎病[3]、番茄(LycopersiconesculentumMiller)灰霉病[4]、苹果(MaluspumilaMill.)褐斑病[5],此外,在棉花(GossypiumherbaceumL.)[6]、玉米(ZeamaysL.)[7]等其他植物中也有相关研究。总之,由于植物抗病机制的复杂性,不同植物感染病原菌后各生理指标的变化规律均不尽相同。百合灰霉病是我国百合地上部分普遍发生且危害严重的病害之一,但目前关于百合灰霉病发病后抗病品种体内相关生理指标的变化报道较少。本研究对东方百合不同抗性品种接种百合灰霉菌后体内相关生理指标进行测定分析,以探讨东方百合品种抗灰霉病的生理机制,以期为百合灰霉病的抗病育种提供理论依据。
1 材料与方法
1.1 试验材料
以对百合灰霉病具有不同抗性的东方百合品种为试验材料[8],即高抗(HR)品种:‘索邦’(‘Sorbonne’)、‘康斯坦萨’(‘Constanta’)和‘西伯利亚’(‘Siberia’),抗性由大到小的顺序为‘Sorbonne’、‘Constanta’、‘Siberia’;高感(HS)品种‘法兰西’(‘Francia’)为对照组。
供试菌种灰葡萄孢(Botrytiscinerea)(灰霉病菌),由金陵科技学院植物保护教研室提供,分离于南京地区。
1.2 试验方法
试验在南京林业大学温室进行,保持灰霉病发病最适宜的温湿度,随机区组设计。每个品种3次重复,共12个小区,每小区10 m2,种植百合40株,常规栽培管理。
用无菌水将在马铃薯葡萄糖琼脂(PDA培养基)上生长7 d的灰霉菌孢子洗出,并调成1×105~5×105菌落·mL-1的菌悬液,采用喷雾法接种,喷水套袋后放入高湿的培养箱中20 ℃培养。
1.2.1 采样
分别于接种当天,即第1天(接菌前)和接种后第3、第5、第7、第9天采样。每品种每小区随机选取10株,分上、中、下随机摘取百合叶片,洗净晾干,剪去叶柄,将叶片剪成约1.0 cm×1.5 cm大小,分别迅速称质量,即0.3 g·包-1和1.0 g·包-1,放入冰箱超低温冷冻备用。
1.2.2百合叶片RE,C及渗透调节物质测定方法
RE,C采用电导率仪测定法、MDA质量摩尔浓度采用硫代巴比妥酸显色法、可溶性蛋白质量分数采用考马斯亮蓝-G250染色法、可溶性糖质量分数采用蒽酮比色法、Pro质量分数采用酸性茚三酮法测定[9]。
1.2.3 百合叶片防御酶测定方法
3种防御酶的粗酶提取:选用pH值7.0磷酸盐缓冲液作为粗酶提缓冲液,可达到同时提取SOD、POD和CAT三种防御酶的目的[10]。
3种防御酶活性测定:SOD活性测定采用氮蓝四唑法(NBT)[9];POD活性测定采用愈创木酚比色法[9];CAT活性测定采用紫外分光光度法[11]。
PAL活性测定:按孙红梅等[12]的方法进行PAL的提取和活性测定。
1.2.4 百合叶片植物激素质量分数测定方法
采用酶联免疫吸附检测法(ELISA)测定植物激素质量分数[9]。
1.3 数据处理
运用Excel软件对试验数据进行处理;应用SPSS软件对数据进行方差显著性分析。
2 结果与分析
2.1 接菌前后东方百合抗感品种叶片表型变化
对接菌前及接菌后不同时期各抗感品种的生理指标进行测定,观察到高感品种‘Fancia’发病早,发病严重且病情发展速度快,而高抗品种发病晚,发病较轻且病情发展缓慢。接菌后高感品种叶片出现圆形或椭圆形,中央灰白色、边缘红褐色的病斑,病斑面积占整个叶片面积的50%以上,且随着接种时间的延长病斑面积逐渐扩大,第7天叶片布满霉层,开始枯萎凋落(图1);高抗品种接菌前无病斑出现,第5天才开始出现少量病斑,病斑面积占叶片面积的5%以下,第9天仅有少量叶片枯萎,对灰霉病表现出较强抗性(图2)。但不论抗性强弱,接菌后各抗感品种叶片生理指标都会发生一定变化。
2.2 接种百合灰霉菌后百合叶片RE,C和渗透调节物质的变化
本研究对东方百合高抗和高感品种接种百合灰霉菌后各叶片的RE,C,MDA质量摩尔浓度,Pro、可溶性糖和可溶性蛋白质量分数进行测定,统计分析见表1。

表1 百合灰霉菌对东方百合叶片RE,C和代谢产物的影响
由表1可见,接种百合灰霉菌后,除了高抗与高感品种的RE,C间存在极显著差异,‘Francia’和‘Sorbonne’的Pro质量分数间存在极显著差异外,其他指标品种间均未达到极显著水平,表明百合灰霉病抗性与RE,C和Pro质量分数之间均可能存在一定相关性。
2.3 接种百合灰霉菌后百合体内防御酶活性变化
本研究对东方百合高抗和高感品种接种百合灰霉菌后各叶片的SOD、POD、CAT和PAL活性进行测定,统计分析见表2。

表2 百合灰霉菌对东方百合叶片4种防御酶活性的影响
由表2可见,接种百合灰霉菌后,高抗与高感品种的SOD、CAT活性间均存在极显著差异;‘Constanta’和‘Francia’的POD、CAT活性间分别存在极显著差异;‘Siberia’和‘Francia’的CAT、PAL活性间分别存在极显著差异;高抗品种除POD活性间存在极显著差异外,其余的酶活性间均未达到极显著差异,表明百合灰霉病抗性和4种高防御酶活性之间可能有一定相关性。
2.4 接种百合灰霉菌后百合体内相关植物激素质量分数变化
本研究对东方百合高抗和高感品种接种百合灰霉菌前后各叶片植物激素质量分数进行测定,统计分析见表3。

表3 百合灰霉菌对东方百合叶片4种植物激素质量分数的影响
由表3可见,接种百合灰霉菌后,高抗品种和高感品种在4种植物激素质量分数上均存在极显著差异,表明百合灰霉病抗性和4种植物激素间均可能存在一定相关性。
2.5 不同百合灰霉病菌胁迫时间下不同抗性东方百合品种各生理指标的变化
2.5.1叶片RE,C
由表4可知,接菌后第9天各抗感品种均低于接菌前。方差分析表明,接菌后第9天与接菌前相比,各抗感品种RE,C间均差异显著。高感品种‘Francia’接菌前RE,C最大,达34.21%,接菌后迅速下降,至第5天达到最低,显著降低了15%。各高抗品种接菌后,RE,C为15.86%~31.13%,均呈先上升后下降再上升再下降的趋势,在第5天出现最低值。
2.5.2 叶片MDA质量摩尔浓度
由表4可知,接菌后第9天高抗品种‘Sorbonne’和高感品种‘Francia’MDA质量摩尔浓度较接菌前下降,其余品种均高于接菌前。方差分析表明,接菌后第9天与接菌前相比,各抗感品种MDA质量摩尔浓度的变化差异均未达显著水平。接菌后,各高抗品种叶片MDA质量摩尔浓度均迅速上升,第3天达到最大值后下降至第5天与接菌前MDA质量摩尔浓度相当,之后‘Sorbonne’ MDA质量摩尔浓度继续下降,‘Constanta’和‘Siberia’均缓慢上升,‘Constanta’在接菌第3天MDA质量摩尔浓度达最大值,为接菌前的2.86倍;而高感品种‘Francia’ MDA质量摩尔浓度呈先下降后上升再下降后上升的趋势,在第7天出现最小值,比接菌前显著降低了46%。接菌前和接菌后第3天测定叶片MDA质量摩尔浓度的差异可作为鉴定抗感品种的指标。
2.5.3 叶片Pro质量分数
由表4可知,接菌后第9天各抗感品种Pro质量分数均较接菌前下降。方差分析表明,接菌后第9天与接菌前相比,各抗感品种Pro质量分数的变化差异均未达显著水平。接菌前,高抗品种‘Sorbonne’叶片Pro质量分数较低。接菌后各抗感品种叶片Pro质量分数总体呈下降趋势。高感品种‘Francia’接菌后先下降后缓慢上升,第7天达到最低,下降了1.741 μg·g-1。高抗品种‘Constanta’和‘Siberia’接菌后叶片Pro质量分数下降较快,‘Constanta’到第3天降至最低,下降了3.335 μg·g-1,‘Siberia’到第7天达到最低,下降了2.448 μg·g-1
接菌后高抗品种反应较快,Pro质量分数迅速下降,高感品种下降较慢。
2.5.4 叶片可溶性糖质量分数
由表4可知,接菌后第9天各抗感品种可溶性糖质量分数均较接菌前上升。方差分析表明,接菌后第9天与接菌前相比,仅高抗品种‘Sorbonne’可溶性糖质量分数的变化差异显著。接菌后,高抗品种‘Siberia’和‘Sorbonne’叶片可溶性糖质量分数变化趋势一致,均呈先上升后下降再上升的趋势。而‘Constanta’则呈现先下降后上升再下降的趋势,接菌后叶片可溶性糖质量分数迅速下降,在第5天达到最低值,比接菌前显著降低了50%,第7天达到最大值,显著上升了51%;高感品种‘Francia’接菌后呈先降后升的趋势,在第7天达到最大值。各抗感品种受病菌侵染后,可溶性糖在体内积累,并随侵染时间的延长,糖积累量增加,高抗品种积累较快,高感品种积累缓慢。
2.5.5 叶片可溶性蛋白质量分数
由表4可知,接菌第9天各抗感品种可溶性蛋白质量分数与接菌前质量分数相当,且接菌后,各抗感品种可溶性蛋白质量分数均变化平缓。方差分析表明,接菌后,在病菌胁迫时间水平上,各抗感品种可溶性蛋白质量分数均差异不显著。
2.5.6 SOD活性
由表4可知,接菌第9天各抗感品种SOD活性均较接菌前上升。方差分析表明,接菌后第9天与接菌前相比,各抗感品种SOD活性均差异显著。接菌后,各抗感品种SOD活性均呈现先升后降的趋势。高抗品种SOD活性迅速升高,其中‘Constanta’在第3天达到最大值,比接菌前上升了146.077 U·g-1,‘Sorbonne’和‘Siberia’在第5天达到最大值,比接种前分别上升了178.532和220.249 U·g-1;高感品种‘Francia’在第5天达到最大值,比接菌前上升了107.469 U·g-1。
2.5.7 POD活性
由表4可知,接菌第9天各抗感品种POD活性均较接菌前上升。方差分析表明,接菌后第9天与接菌前相比,各抗感品种POD活性均差异显著。高抗品种‘Sorbonne’接菌后POD活性呈现先上升后下降再上升的趋势,在第9天达到最大值,较接菌前显著上升。其余各抗感品种POD活性均呈上升趋势。接菌第9天各高抗品种比接菌前显著上升了8.000~10.000 U·g-1·min-1,高感品种显著上升了24.334 U·g-1·min-1。
2.5.8 CAT活性
由表4可知,接菌第9天各抗感品种CAT活性均较接菌前下降。方差分析表明,接菌后第9天与接菌前相比,高抗品种‘Constanta’和‘Siberia’ CAT活性差异显著。接菌前,高抗品种叶片内CAT活性显著高于高感品种。接菌后各抗感品种CAT活性均呈现先升后降的规律,高抗品种CAT活性均在第3天达到最大值,之后持续下降至第9天达到最低值,显著低于接菌前,且3个品种CAT活性相近;高感品种‘Francia’在第5天达到最大值,CAT活性比接菌前提高了4倍,在第7天后CAT活性与接菌前相当,接菌前和接菌后第3天测定百合叶片CAT活性可作为鉴定抗感品种的指标。
2.5.9 PAL活性
由表4可知,接菌后各抗感品种PAL活性总体较接菌前上升。方差分析表明,接菌后第9天与接菌前相比,各抗感品种PAL活性均差异不显著。接菌后,高抗品种‘Siberia’和‘Sorbonne’ PAL活性呈先下降后上升的趋势,分别于第3天和第7天PAL活性达到最低值,之后酶活性持续上升。高感品种‘Francia’PAL活性呈现先上升后下降的趋势。接菌第9天各抗感品种PAL活性与接菌前相当。
2.5.10 脱落酸(ABA)质量分数
由表4可知,接菌第9天各抗感品种ABA质量分数均较接菌前上升。方差分析表明,接菌后第9天与接菌前相比,各抗感品种ABA质量分数均差异显著。接菌前,高感品种ABA质量分数低于高抗品种。高抗品种‘Sorbonne’和高感品种‘Francia’接菌第7天后ABA质量分数迅速上升,至第9天比接菌前分别显著提高了1.99倍和3.45倍;高抗品种‘Constanta’和‘Siberia’ABA质量分数变化则较为平缓。

表4 不同灰霉病菌胁迫时间下不同抗性东方百合品种各生理指标

时 间Pro质量分数/μg·g-1‘索邦’‘康斯坦萨’‘西伯利亚’‘法兰西’可溶性糖质量分数/%‘索邦’‘康斯坦萨’‘西伯利亚’‘法兰西’第1天(4.246±0.390)a(7.712±0.720)a(5.946±0.470)a(7.367±0.490)a(0.0029±0.0004)c(0.0065±0.0004)b(0.0045±0.0005)b(0.0047±0.0006)b第3天(4.336±0.460)a(4.377±0.470)b(3.811±0.470)b(6.604±0.480)ab(0.0057±0.0005)b(0.0050±0.0003)d(0.0069±0.0004)a(0.0039±0.0002)b第5天(4.073±0.480)a(5.289±0.510)b(3.687±0.490)b(6.234±0.390)ab(0.0050±0.0006)b(0.0032±0.0003)c(0.0045±0.0003)b(0.0039±0.0003)b第7天(3.581±0.500)a(4.427±0.500)b(3.498±0.350)b(5.626±0.480)b(0.0083±0.0003)a(0.0098±0.0006)a(0.0045±0.0003)b(0.0064±0.0003)a第9天(4.151±0.470)a(4.961±0.340)b(4.057±0.420)b(6.291±0.380)ab(0.0088±0.0008)a(0.0065±0.0002)b(0.0056±0.0006)ab(0.0051±0.0002)b

时 间可溶性蛋白质量分数/mg·g-1‘索邦’‘康斯坦萨’‘西伯利亚’‘法兰西’SOD活性/U·g-1‘索邦’‘康斯坦萨’‘西伯利亚’‘法兰西’第1天(22.564±0.620)a(20.559±0.760)ab(21.703±0.600)a(22.133±1.230)a(75.732±0.620)e(82.158±0.880)e(30.293±0.750)e(91.336±1.120)e第3天(21.708±0.570)a(19.713±0.500)b(23.041±0.570)a(22.077±0.490)a(179.608±0.730)b(228.235±1.430)a(171.765±1.180)c(109.020±1.360)d第5天(22.041±0.860)a(20.99±0.590)ab(21.687±0.300)a(21.59±0.280)a(254.264±1.210)a(119.474±0.780)bc(250.542±0.470)a(198.805±0.930)a第7天(21.405±0.580)a(21.908±0.450)a(22.318±0.670)a(22.631±0.620)a(131.794±0.730)c(121.324±0.550)b(224.788±0.370)b(168.745±0.680)c第9天(21.467±0.490)a(21.215±0.520)ab(22.01±0.340)a(21.687±0.660)a(125.033±0.870)d(116.911±0.630)c(157.235±1.120)d(174.309±0.800)b

时 间POD活性/U·g-1·min-1‘索邦’‘康斯坦萨’‘西伯利亚’‘法兰西’CAT活性/U·g-1‘索邦’‘康斯坦萨’‘西伯利亚’‘法兰西’第1天(2.667±0.390)c(9.000±0.240)c(5.667±1.160)c(2.333±0.580)d(0.500±0.050)c(1.375±0.130)b(1.063±0.030)a(0.084±0.030)b第3天(8.333±0.380)b(9.333±0.960)c(10.333±0.940)b(3.529±0.690)cd(1.584±0.140)a(1.833±0.110)a(1.667±0.230)b(0.208±0.060)ab第5天(3.667±0.960)c(12.333±0.330)b(12.667±0.180)a(5.000±0.400)c(1.251±0.120)b(1.251±0.030)b(0.833±0.020)b(0.333±0.100)a第7天(7.445±0.060)b(11.667±0.220)b(10.000±0.100)b(9.333±0.380)b(0.584±0.040)c(0.833±0.040)c(0.333±0.090)c(0.084±0.020)b第9天(10.667±1.150)a(19.000±0.880)a(14.000±0.520)a(26.667±0.340)a(0.333±0.010)c(0.251±0.020)d(0.251±0.030)c(0.081±0.010)b

时 间PAL活性/U·g-1‘索邦’‘康斯坦萨’‘西伯利亚’‘法兰西’GA质量分数/ng·g-1‘索邦’‘康斯坦萨’‘西伯利亚’‘法兰西’第1天(34.972±0.460)a(36.972±0.290)c(34.472±0.590)a(45.056±0.370)bc(14.966±0.460)c(13.782±0.640)b(18.686±0.700)a(12.685±0.700)a第3天(35.861±0.090)a(49.667±0.330)b(27.722±0.740)c(49.639±0.360)a(10.824±0.360)d(13.644±0.600)b(10.046±0.580)c(10.949±0.500)ab第5天(30.583±0.760)b(49.194±0.470)b(31.333±0.490)b(45.806±0.470)b(11.213±0.430)d(15.135±0.630)b(10.392±0.640)c(9.043±0.640)c第7天(24.611±0.170)c(51.472±0.250)a(35.028±0.440)c(45.167±0.480)bc(16.773±0.180)b(15.400±0.680)b(13.193±0.690)b(9.911±0.630)bc第9天(35.861±0.230)a(37.944±0.570)c(35.889±0.290)a(44.056±0.550)c(19.641±0.420)a(21.643±0.360)a(8.650±0.610)c(11.778±0.310)ab

时 间IAA质量分数/ng·g-1‘索邦’‘康斯坦萨’‘西伯利亚’‘法兰西’ABA质量分数/ng·g-1‘索邦’‘康斯坦萨’‘西伯利亚’‘法兰西’第1天(31.551±0.850)c(103.729±0.500)a(102.806±0.850)e(69.285±0.590)d(94.862±0.800)c(129.610±0.770)b(97.913±0.760)e(80.642±0.780)e第3天(27.538±0.780)d(55.557±0.530)b(145.186±1.290)b(74.225±0.660)c(83.021±0.550)d(124.129±0.720)c(133.559±0.640)b(97.596±1.170)d第5天(22.146±0.700)e(46.168±0.430)c(153.692±1.080)a(78.875±1.070)b(109.465±0.500)b(109.626±1.400)d(129.947±0.930)c(110.571±0.770)c第7天(35.297±0.990)b(56.276±0.560)b(128.782±0.820)c(53.794±0.500)e(107.611±0.800)b(140.990±0.340)a(137.144±0.620)a(144.971±0.500)b第9天(93.708±0.330)a(56.116±0.600)b(123.321±1.110)d(152.193±1.040)a(188.416±0.920)a(142.393±0.630)e(103.174±0.620)e(278.535±0.480)a
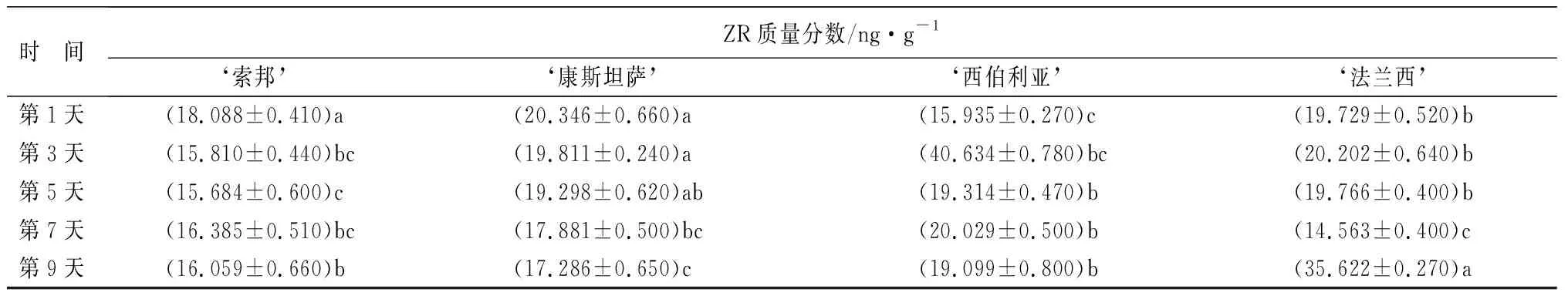
时 间ZR质量分数/ng·g-1‘索邦’‘康斯坦萨’‘西伯利亚’‘法兰西’第1天(18.088±0.410)a(20.346±0.660)a(15.935±0.270)c(19.729±0.520)b第3天(15.810±0.440)bc(19.811±0.240)a(40.634±0.780)bc(20.202±0.640)b第5天(15.684±0.600)c(19.298±0.620)ab(19.314±0.470)b(19.766±0.400)b第7天(16.385±0.510)bc(17.881±0.500)bc(20.029±0.500)b(14.563±0.400)c第9天(16.059±0.660)b(17.286±0.650)c(19.099±0.800)b(35.622±0.270)a
2.5.11 赤霉素(GA)质量分数
由表4可知,接菌第9天各抗感品种GA质量分数变化不一致。方差分析表明,接菌后第9天与接菌前相比,高抗品种GA质量分数均差异显著。接菌后,高抗品种‘Siberia’ GA质量分数总体呈下降趋势,至第9天较接菌前显著下降了10.036 ng·g-1,高抗品种‘Constanta’和‘Sorbonne’均呈上升趋势,至第9天分别显著上升了7.861 ng·g-1和4.675 ng·g-1;高感品种‘Francia’ GA质量分数先降后升,第5天达到最低值,较接菌前显著下降了3.642 ng·g-1,其GA质量分数变化比高抗品种平缓。
2.5.12 生长素(IAA)质量分数
由表4可知,接菌第9天除高抗品种‘Constanta’ IAA质量分数较接菌前下降,其余各品种均较接菌前上升。方差分析表明,接菌后第9天与接菌前相比,各抗感品种IAA质量分数均差异显著。接菌后,高抗品种‘Sorbonne’和高感品种‘Francia’IAA质量分数总体呈上升趋势,至第9天分别是接菌前的2.970倍和2.300倍。接菌后‘Sorbonne’在第7天IAA质量分数迅速上升,高抗品种‘Siberia’和‘Constanta’接菌后IAA质量分数分别呈先上升再下降和先下降再上升的趋势,在第5天分别达到最大值和最小值。
2.5.13 玉米素核苷(ZR)质量分数
由表4可知,接菌第9天高抗品种‘Siberia’和高感品种‘Francia’ ZR质量分数较接菌前上升,其余品种均较接菌前下降。方差分析表明,接菌后第9天与接菌前相比,各抗感品种ZR质量分数间均差异显著。‘Constanta’和‘Sorbonne’接菌前后ZR质量分数变化较小,而‘Siberia’接菌后ZR质量分数迅速上升,至第3天达到最大值,是接菌前的2.55倍,而后又迅速下降,第5天后叶片ZR质量分数变化较小。接菌第9天3个品种ZR质量分数接近。
2.6 各抗性指标相关性及主成分分析
单一指标不能完全反应植物抗病能力大小,且各指标之间既不完全独立,也不完全相关,为弥补单一指标对百合抗病能力评定产生的片面性,对各指标反映出的物种间的差异进行主成分分析,从而提取少数几个相对独立的综合指标最大程度反映原有指标提供的物种之间差异。各单一指标的相关系数矩阵见表5。
由表5可知,可溶性糖质量分数与GA质量分数之间呈显著正相关;RE,C与Pro质量分数间、RE,C与ABA质量分数间以及Pro质量分数与ABA质量分数间分别达极显著正相关。通过对百合灰霉病抗病指标相关性分析,筛选出与抗病能力相关性强的指标,对其进行主成分分析。主成分分析可以简化原有复杂数据,实现指标降维,各指标主成分分析见表6。
由表6可知,东方百合在整个胁迫期共有3个主成分入选,累计方差贡献率达100%,说明这3个主成分代表的信息已经把这几种东方百合对灰霉菌抗性信息100%表达出来了。第一主成分的贡献率为44.266%,主要包括RE,C和Pro质量分数,PAL活性,ABA、IAA和ZR质量分数表达的信息;第二主成分的贡献率为34.848%,主要包括RE,C和Pro质量分数,POD、PAL活性以及ABA质量分数表达的信息;第三主成分的贡献率为20.886%,主要包括MDA质量摩尔浓度,POD活性,IAA、ZR质量分数表达的信息;从贡献率来看,各主成分依次递减,说明各主成分代表的信息重要性递减。
从贡献率来看,各主成分间贡献率相差不大,说明东方百合对灰霉病的抗性是各种指标综合反映的结果,不能相互替代。
3 结论与讨论
植物受到胁迫时,膜的结构和功能会遭到破坏,膜透性增大,从而使细胞内的电解质外渗,以致RE,C增大。同时胁迫会导致膜脂过氧化作用增强,MDA为膜脂过氧化的最终产物[13],它的高低可反映植物在逆境下的受害程度。本试验结果显示,各高抗品种接菌后MDA质量摩尔浓度均迅速上升,且叶片RE,C和MDA质量摩尔浓度变化同步,与前人研究结果一致[14]。接菌后,高抗品种对胁迫反应敏感,而高感品种对胁迫反应相对滞后,多在染病后的第5~第7天内表现出明显不同。
胁迫条件下,植物体内大量积累的Pro是主要的渗透调节物质之一,能提高植物抗逆性[15]。本研究中,各抗感品种在接菌后,Pro质量分数呈下降趋势,与以往文献报道有较大差异[16-17]。在最初的5 d高抗品种叶片Pro质量分数的下降幅度大于高感品种,说明可能该品种对灰霉病的抗性与叶片Pro质量分数无关,其抗性强弱可能取决于病菌入侵后的应激反应,高抗品种反应快,高感品种反应慢,其具体机制还有待进一步研究。
可溶性糖也是植物体内重要的渗透调节物质,因而,在植物抗性生理试验中常被用作指标加以测定。本研究结果显示,高抗品种受侵染后,防卫反应比高感品种迅速,代谢速度加快,使糖主要供给植物的生长,增强其抗性。但其变化规律呈波动式上升,与前人研究的变化规律不同[18-19],这可能是由于百合在受灰霉菌侵染初期会产生一种应激性反应,随胁迫时间的延长,植物适应这种环境后,就会诱导细胞可溶性糖质量分数升高,从而有利于提高其抗性。
植物受到病害胁迫后,会导致体内活性氧代谢失调。这时体内的保护酶系就会发挥作用,减轻胁迫给植物带来的伤害。研究表明,它们在植物体内发挥作用不是单一的,而是彼此协同发挥清除活性氧的作用,因此应综合考虑其作用[20]。
本试验结果表明,侵染后,高抗品种SOD活性被迅速激活上升,以清除或阻止病原菌造成的伤害,高感品种SOD活性上升较慢。随着胁迫时间的延长,活性氧积累加剧了对保护酶系的损害,SOD活性开始下降。植物体内SOD活性先上升后下降的过程与刘佳等[21]研究规律一致。
接菌后,高感品种叶片POD活性比高抗品种增强的幅度大,说明高感品种受病原菌侵染后产生较多的自由基,比高抗品种更易受病菌胁迫。接菌后各抗感品种体内的POD活性均呈上升趋势,与一般研究规律一致[22-23],但相对SOD活性变化具有滞后性,这可能是由于SOD是植物受侵染后发挥抵抗作用的第一道防护所致,并且POD能将SOD酶促反应终产物H2O2有效分解清除。
CAT活性初期上升可能是植物的一种应激反应,而后CAT活性均下降,说明随胁迫时间的延长酶调节能力有限。胁迫后期,各抗感品种酶活性均比接种前低,预示着细胞的衰老死亡。接菌后高抗品种CAT活性高于高感品种,且上升快,与李方方等[24]研究结果一致。
植物激素具有质量分数低但对植物生长发育具有重大作用的特点。接菌后,植物激素质量分数变化无规律性,这可能与品种类型、激素的合成部位和运输方式等有关。同时植物激素质量分数的增加是病菌侵染后刺激植物合成的,还是病菌自身合成的,还是二者兼有都有待做进一步的验证。
综上所述,东方百合各抗感品种接菌后各生理指标变化不完全一致,且测定接菌前和接菌后第3天MDA质量摩尔浓度和CAT活性可作为初步鉴定抗感品种的生理指标。由方差分析可以看出,各抗感品种的RE,C,SOD、POD活性,ABA、IAA、ZR质量分数以及高抗品种的可溶性糖质量分数、CAT活性、GA质量分数在时间水平上的变化均达显著水平;而高感和高抗品种间除了MDA质量摩尔浓度,可溶性糖、可溶性蛋白质量分数未达极显著水平,其余指标均达极显著水平。各抗性指标相关性及主成分分析显示,东方百合在整个胁迫期共有3个主成分入选;从贡献率来看,各主成分间贡献率相差不大。因此,可以推测不同东方百合品种对灰霉病的抗性并不是单一指标作用的结果,可能是多种生理反应协同作用的结果,要想全面了解百合灰霉病的生理生化机制,还需要作进一步的探讨研究。
