SND1在膀胱癌组织中的表达及临床意义
2020-08-21卢湧湧陶利萍武志刚张棋蒋斌浩
卢湧湧 陶利萍 武志刚 张棋 蒋斌浩


[摘要] 目的 研究葡萄球菌核酸酶样结构蛋白1(SND1)在膀胱癌组织内的基因及蛋白表达,并探讨其临床意义。方法 对GEO数据库进行深入挖掘,观察SND1基因在膀胱癌中的表达,并分析其与患者临床信息及预后的关系;收集115例膀胱癌患者的临床预后资料,免疫组化法检测癌组织内SND1蛋白的表达,分析患者的临床预后与SND1蛋白之间的关系。 结果 115例GSE31684数据集中膀胱癌组织中SND1表达升高,且与患者的肿瘤大小、肿瘤分期、组织学类型、淋巴结转移相关,SND1高表达患者的总生存率及无复发生存率均低于SND1低表达患者。结论 在膀胱癌组织中SND1表达升高与患者预后不良相关,SND1可能是预测膀胱癌进程与预后的潜在分子标志物。
[关键词] SND1;膀胱癌;预后;总生存率;无复发生存率
[中图分类号] R737.14 [文献标识码] A [文章编号] 1673-9701(2020)18-0005-04
Expression and clinical significance of SND1 in bladder cancer
LU Yongyong1 TAO Liping2 WU Zhigang1 ZHANG Qi1 JIANG Binhao1
1.Department of Urology,the First Affiliated Hospital of Wenzhou Medical University,Wenzhou 325000,China;2.Department of Gastroenterology,the First Affiliated Hospital of Wenzhou Medical University,Wenzhou 325000,China
[Abstract] Objective To study the gene and protein expression of staphylococcal nuclease domain-containing protein 1(SND1) in bladder cancer and to explore its clinical significance. Methods The GEO database was deeply mined. The expression of SND1 gene in bladder cancer was observed. Its relationship with clinical information and prognosis of patients was analyzed. The clinical prognostic data of 115 patients with bladder cancer were collected. SND1 in cancer tissues was detected by immunohistochemistry. The relationship between clinical prognosis and SND1 protein was analyzed. Results The expression of SND1 in bladder cancer tissue of 115 cases of GSE31684 data set was increased, and it was related to the tumor size, tumor stage, histological type, and lymph node metastasis. The overall survival rate and relapse-free survival rate of patients with high SND1 expression were lower than those with low expression of SND1. Conclusion The increased expression of SND1 in bladder cancer tissue is related to the poor prognosis of patients. SND1 may be a potential molecular marker to predict the progression and prognosis of bladder cancer.
[Key words] SND1;Bladder cancer;Prognosis;Overall survival rate;Relapse-free survival rate
膀胱尿路上皮癌(膀胱癌)是泌尿生殖系統发病率最高的恶性肿瘤之一[1],据估计2012年全世界新增42.98万例膀胱癌患者,死亡165 100例[2],在我国膀胱癌发病率呈上升趋势。尽管约75%的患者在最初诊断时为非肌浸润性膀胱癌,但在接受各种手术与辅助治疗后,有10%~30%的患者不仅复发而且发展为肌浸润性膀胱癌,在进一步接受复杂的根治性膀胱切除术和盆腔淋巴结清扫术后,约30%最终会发展为转移性疾病,这是造成多数膀胱癌患者肿瘤特异性死亡的主要原因[3-6]。因此,临床上迫切需要一种能够准确预测膀胱癌进程与预后的分子标志物,可以早期识别可能发展为肌浸润性膀胱癌的患者,实现早期诊断,改善预后[7]。
葡萄球菌核酸酶样结构蛋白1(SND1),也称为“Tudor葡萄球菌核酸酶”或“P100”,是一种多功能蛋白质,在人类及其他物种中存在广泛表达,具有保守性。SND1参与转录调节、mRNA剪接、RNA编辑和miRNA介导的mRNA降解等功能,是RNA诱导的沉默复合物(RISC)中的核酸酶,SND1可以作为转录共刺激因子促进转录因子与基础转录复合体的结合[8-12]。有研究表明其在肝癌、乳腺癌、结肠癌等多个癌种中存在过表达现象,且与肺癌、肝癌和前列腺癌的远处转移密切相关[13-18]。然而目前尚无SND1与膀胱癌的相关研究,因此本研究对GEO数据库进行数据挖掘,评估SND1基因在膀胱癌中的表达,并结合我院现有的临床随访及标本数据库,对膀胱癌组织中SND1蛋白的表达进行免疫组化染色观察,了解SND1蛋白表达与膀胱癌临床病理因素及患者预后的关系。
1资料与方法
1.1 一般资料
通过对GEO数据库中进行数据检索,下载膀胱癌基因表达数据集GSE42089、GSE3167、GSE31684的基因表达矩阵进行后续分析。GSE42089包含10例膀胱癌组织与8例正常膀胱组织的基因表达数据,GSE3167包含41例膀胱癌组织与9例正常膀胱组织的基因表达数据,而GSE31684不仅包含93例行膀胱全切术的膀胱癌患者的基因表达数据,并附带了详细的临床信息(包括患者的年龄、性别、肿瘤分期、组织学类型、淋巴转移、远处转移以及患者的生存信息等)。
收集我院2012年1月~2014年12月间确诊膀胱癌患者的临床病理及预后资料,共115例,年龄39~81岁,平均63.4岁,男85例,女30例,其中行膀胱全切术(RC)45例,行经尿道膀胱肿瘤电切术(TURBT)70例。纳入标准:术后病理确诊为膀胱尿路上皮癌。排除标准:①合并其他膀胱疾病史;②合并其他肿瘤病史;③合并其他可能影响研究结果的疾病史。
1.2方法
利用GSE42089、GSE27448数据集,比较SND1的基因表达水平在正常膀胱组织及膀胱癌组织中的差异情况。利用GSE31684数据集,比较SND1的基因表达水平与膀胱癌临床病理因素的关系,并分析SND1基因表达水平与患者预后的关系,其中SND1高、低表达组的分组依据为GSE31684数据集中的SND1表达值的中位数。
免疫组化研究分析115例膀胱癌患者癌组织标本,并建立临床病理及预后资料数据库,病理分期基于2009 TNM分期系统[19],肿瘤组织学分级基于2004年WHO分类系统[20]。SP法免疫組化染色按常规进行,简要流程如下:蜡块切片(4 μm/片),常规脱蜡水化,胃蛋白酶消化,EDTA抗原液修复,一抗(1:200; ab65078,Abcam)孵育过夜(4℃),二抗(50 μL,带生物素标记)孵育20~30 min,加入卵白素室温下孵育,确定显色适时终止。IHS法半定量分析:①染色强度,以多数细胞呈现的染色强弱计分(记为a):无明显着色0分,淡黄色1分,棕黄色2分,棕褐色3分;②阳性细胞率,即5个视野(每400×高倍视野计数100个此类细胞)的阳性细胞的平均数(记为b):1%~10%计1分,11%~50%计2分,51%~75%计3分,>75%计4分;③a×b乘积为IHS评分,IHS评分≤6分为低表达,>6分为高表达。
1.3 统计学方法
采用SPSS 22.0统计学软件进行数据分析,计数资料以[n(%)]表示,采用χ2检验,计量资料以(x±s)表示,采用t检验;生存分析统计及作图采用Graphpad Prism6软件和Log-rank检验;P<0.05为差异有统计学意义。
2 结果
2.1 SND1基因在膀胱癌组织中的表达情况
见图1。在数据集GSE42089与GSE3167膀胱癌组织中的SND1基因高于正常组织,差异有统计学意义(P=0.0139、0.0025)。
2.2 SND1基因表达与膀胱癌患者临床病理因素之间的关系
见表1。在GSE31684数据集中,SND1高、低表达组患者在性别、年龄方面无明显差异(P=0.926、0.331)。SND1高表达组患者在肿瘤分期、淋巴结转移、肿瘤远处转移方面与SND1低表达组间有显著性差异(P=0.012、0.022和0.008),在肿瘤组织学类型上,高级别膀胱癌患者中SND1高表达占比(45/87)高于低级别膀胱癌患者(1/6),但差异无统计学意义(P=0.215)。
2.3 SND1基因表达水平与膀胱癌患者临床预后相关性
见图2。GSE31684数据集中SND1高表达组患者的总生存率(OS)与无复发生存率(RFS)均显著低于SND1低表达组(OS:HR=1.673, 95%CI:1.048~2.790,P=0.0347;RFS:HR=1.965,95%CI:1.039~3.652,P=0.0383)。
2.4 SND1蛋白表达水平与膀胱癌患者临床病理因素之间的关系
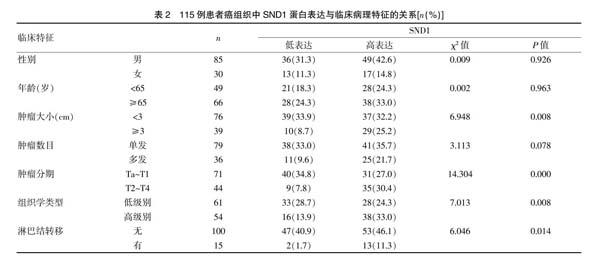
对115例膀胱癌组织的免疫组化观察发现,SND1蛋白主要定位于膀胱癌细胞胞浆内(封三图1),SND1蛋白高、低表达组患者在性别、年龄、肿瘤数目方面无明显差异(P=0.926、0.963和0.078)。SND1高表达组患者在肿瘤大小、肿瘤分期、组织学类型、淋巴结转移方面与SND1低表达组之间存在显著差异(P=0.008、0.000、0.008和0.014),见表2。
2.5 SND1蛋白表达水平与膀胱癌患者临床预后相关性
见图3。45例膀胱全切患者中,SND1高表达组的OS显著低于SND1低表达组(HR=2.552,95%CI:1.033~5.976,P=0.0270);RFS亦显著降低(HR=2.723, 95%CI:1.021~6.484,P=0.0461),70例TURBT患者中,SND1高表达组的RFS显著低于SND1低表达组(HR=2.577,95%CI:1.160~5.011,P=0.0209),OS亦低于SND1低表达组,但差异无统计学意义(HR=2.316,95%CI:0.9583~5.119,P=0.0667)。
3讨论
本研究中对GEO数据库进行深入挖掘,免疫组化法检测115例膀胱癌组织中SND1蛋白的表达,结果发现相对于正常膀胱黏膜组织,膀胱癌组织中的SND1基因表达明显升高,提示SND1高表达可能与膀胱癌的发生有关,与SND1在乳腺癌、肝癌中的高表达相似[13,14]。进一步分析表明,肌浸润性膀胱癌患者及淋巴浸润患者不论SND1基因水平还是蛋白水平均高于非肌浸润性膀胱癌患者和无淋巴浸润患者。SND1蛋白水平在不同肿瘤组织学分级上存在显著差异,但 SND1基因水平在此差异尚未达到统计学意义,可能与GSE31684数据集中的研究人群绝大多数(87/93)为高级别肿瘤患者有关,存在一定的选择偏倚。GSE31684的数据还表明SND1基因表达与肿瘤远处转移相关,而115例患者的数据则表明SND1蛋白表达与肿瘤大小相关。
SND1的表達在膀胱癌不同分期、分化、转移方面的差异提示SND1可能与膀胱癌的预后相关,促使进一步分析SND1表达与患者预后的关系,结果显示在GSE31684中SND1高表达组患者的OS与RFS均显著低于SND1低表达组,而115例患者中也存在类似的差异,虽然TURBT患者中SND1高、低表达组患者间的OS尚未达到统计学差异,这可能与TURBT患者病情随访时间相对不长有关(一般来说,TURBT患者肿瘤分期相对较低、分化较好,因此总生存率相对较长)。
目前虽然没有SND1与膀胱癌的报道,但有多个研究报道SND1与其他癌种的关系。与正常肝组织相比,74%(81/109)的肝癌组织中SND1表达升高,SND1可能通过降解肿瘤抑制基因mRNAs及激活胰岛素样生长因子信号而促进肝癌细胞增殖[21]。在结肠癌中SND1参与RNA诱导的沉默复合物,影响E-cadherin转录,从而促进肿瘤的发生和转移[16]。在不同的乳腺癌细胞系中,SND1的表达水平与细胞系的侵袭能力呈正相关[22];SND1可上调SMURF1(Smad泛素化调节因子1),破坏细胞骨架F-肌动蛋白在肿瘤细胞中的粘附能力,从而增加乳腺癌细胞转移的可能性[23, 24]。在30例晚期乳腺癌的活检中,有9例远处灶呈SND1高表达,而原发灶却是SND1低表达,提示在乳腺癌的远处转移过程中,SND1的表达被诱导和上调[13]。虽然在膀胱癌中,目前尚不清楚SND1的具体作用机制,但鉴于SND1存在物种间的广泛表达与保守性,推测在膀胱癌中SND1可能存在类似的作用机制。
总之,本研究发现膀胱癌组织中SND1表达升高,且与肿瘤的分期、分化、转移相关,与患者的不良预后相关,SND1可能是预测膀胱癌进程与预后的潜在分子标志物,但需要更多中心更多临床病例的证实,其具体作用机制也需要进一步深入研究。
[参考文献]
[1] 韩苏军,张思维,陈万青,等. 中国膀胱癌发病现状及流行趋势分析[J]. 癌症进展,2013,11(1):89-95.
[2] Torre LA,Bray F,Siegel RL,et al. Global cancer statistics,2012[J]. CA Cancer J Clin,2015,65(2):87-108.
[3] Burger M,Catto JW,Dalbagni G,et al. Epidemiology and risk factors of urothelial bladder cancer[J]. Eur Urol,2013,63(2):234-241.
[4] Babjuk M,Burger M,Zigeuner R,et al. EAU guidelines on non-muscle-invasive urothelial carcinoma of the bladder:Update 2013[J]. Eur Urol,2013,64(4):639-653.
[5] Tomaszewski JJ,Smaldone MC. Emerging intravesical therapies for management of nonmuscle invasive bladder cancer[J]. Open Access J Urol,2010,2:67-84.
[6] Siegel RL,Miller KD,Jemal A. Cancer statistics,2019[J]. CA Cancer J Clin,2019,69(1):7-34.
[7] 尉春晓. 膀胱癌的分子生物学研究进展及其在分子标记物诊断中的应用[J]. 泌尿外科杂志(电子版),2018, 10(2):48-54,61.
[8] García-López J,Hourcade JD,Del MJ. Reprogramming of microRNAs by adenosine-to-inosine editing and the selective elimination of edited microRNA precursors in mouse oocytes and preimplantation embryos[J]. Nucleic Acids Res,2013,41(10):5483-5493.
[9] Blanco MA,Ale■kovi■ M,Hua Y,et al. Identification of staphylococcal nuclease domain-containing 1 (SND1) as a metadherin-interacting protein with metastasis-promoting functions[J]. J Biol Chem,2011,286(22):19982-19992.
[10] Emdad L,Janjic A,Alzubi MA,et al. Suppression of miR-184 in malignant gliomas upregulates SND1 and promotes tumor aggressiveness[J]. Neuro Oncol,2015,17(3):419-429.
[11] Wan L,Lu X,Yuan S,et al. MTDH-SND1 interaction is crucial for expansion and activity of tumor-initiating cells in diverse oncogene-and carcinogen-induced mammary tumors[J]. Cancer Cell,2014,26(1):92-105.
[12] 黃丽,尹洁,丁建民,等. p100蛋白慢病毒干扰载体及p100沉默的HepG2稳定细胞系的构建[J]. 天津医药,2012,40(6):529-532,后插1.
[13] Gu X,Xue J,Ai L,et al. SND1 expression in breast cancer tumors is associated with poor prognosis[J]. Ann N Y Acad Sci,2018,1433(1):53-60.
[14] Jariwala N,Rajasekaran D,Mendoza RG,et al. Oncogenic role of SND1 in development and progression of hepatocellular carcinoma[J]. Cancer Res,2017,77(12):3306-3316.
[15] Azuara D,Aussó S,Rodriguez-Moranta F,et al. New methylation biomarker panel for early diagnosis of dysplasia or cancer in high-risk inflammatory bowel disease patients[J]. Inflamm Bowel Dis,2018,24(12):2555-2564.
[16] Wang N,Du X,Zang L,et al. Prognostic impact of Metadherin-SND1 interaction in colon cancer[J]. Mol Biol Rep,2012,39(12):10497-10504.
[17] Xing A,Pan L,Gao J. P100 functions as a metastasis activator and is targeted by tumor suppressing microRNA-320a in lung cancer[J]. Thorac Cancer,2018,9(1):152-158.
[18] Ngollo M,Lebert A,Daures M,et al. Global analysis of H3K27me3 as an epigenetic marker in prostate cancer progression[J]. BMC Cancer,2017,17(1):261.
[19] Sobin LH,Gospodarivicz M,Wittedkind C. TNM calssification of malignant tumors. UICC International Union Against Cancer. 7th edn[M]. Wiley-Blackwell,2009:262-265.
[20] Sauter G,Algaba F,Amin M. Tumour of urinary system:Nov-invasive urothelial neoplsia. In Eble JN,Sauter G,Epsein JI,Sesterhenn,eds WHO Classification of Tumour of urinary system and male genital organs[M]. Lyon:IARCC Press,2004.
[21] Yoo BK,Santhekadur PK,Gredler R,et al. Increased RNA-induced silencing complex(RISC) activity contributes to hepatocellular carcinoma[J]. Hepatology,2011,53(5):1538-1548.
[22] Dai X,Cheng H,Bai Z,et al. Breast cancer cell line classification and its relevance with breast tumor subtyping[J]. J Cancer,2017,8(16):3131-3141.
[23] Yu L,Di Y,Xin L,et al. SND1 acts as a novel gene transcription activator recognizing the conserved Motif domains of Smad promoters,inducing TGFβ1 response and breast cancer metastasis[J]. Oncogene,2017,36(27):3903-3914.
[24] Yu L,Liu X,Cui K,et al. SND1 acts downstream of TGFβ1 and upstream of smurf1 to promote breast cancer metastasis[J]. Cancer Res,2015,75(7):1275-1286.
(收稿日期:2019-12-03)
