基质辅助激光解吸电离-飞行时间质谱法表征大肠杆菌O77 O抗原寡糖单位生物合成路径
2020-08-21储健贾添元拱忠影董晨影周大炜
储健 贾添元 拱忠影 董晨影 周大炜


摘 要 大肠杆菌O抗原寡糖单位生物合成路径的研究对于阐明特异性O抗原在细菌生长和致病中所发挥的作用具有重要意义。本研究利用基质辅助激光解吸电离-飞行时间质谱(MALDI-TOF MS)技术研究了大肠杆菌O77 O抗原寡糖单位的生物合成路径,考察了两个甘露糖糖基转移酶(WbaD 和WbaC)在大肠杆菌O77 O抗原寡糖单位生物合成过程中的作用,建立了高效、灵敏的细菌 O抗原寡糖重复单位生物合成路径初步表征方法。首先采用MALDI-TOF MS技术,在负离子模式下,监测WbaD 和WbaC酶促反应产物-脂寡糖形成,初步探索了WbaD 和WbaC的作用方式,应用碰撞诱导解離 (CID)技术对酶促反应产物-脂寡糖的化学结构进行了初步表征。结果表明,WbaD 和WbaC是O77 O-寡糖重复单位合成所需的仅有的两个糖基转移酶,WbaD与O77的O抗原中d-Man-d-GlcNAc糖键的形成相关,WbaC与O77的O抗原中其余两个d-Man-d-Man糖键的形成相关; WbaD 和WbaC之间同时存在协同合作和交替作用方式。本研究建立的细菌 O抗原寡糖重复单位生物合成路径高效表征方法为深入探索细菌O抗原生物合成机制和应用生物工程技术大规模合成功能性糖链奠定了实验基础。
关键词 O抗原寡糖重复单位; 酯寡糖; 生物合成路径; 基质辅助激光解吸离子化-飞行时间质谱
1 引 言
某些致病菌株可以引起人、畜、禽、兽共患的传染性疾病,在人群密集和卫生条件较差的区域爆发的潜在可能性较大, 特别是近年来,耐多药和广泛耐药菌株的出现,迫切需要寻找新药物及药物作用靶点。O抗原是革兰氏阴性细菌细胞壁最外层的主要成分,由寡糖重复单位组成(几个到几十个),构成O-寡糖抗原决定簇,是动物免疫系统对入侵的革兰氏阴性菌首先识别及攻击的目标,在致病性细菌侵染宿主细胞过程中起重要作用[1]。在细菌的感染过程中,体液和细胞的免疫应答通常由特异性O-寡糖抗原决定簇决定,从而可确定细菌再次感染时机体可产生的免疫反应[2]。
大肠杆菌细菌表面O抗原寡糖单位的生物合成中,糖基转移酶将高能核苷二磷酸单糖供体中的单糖转移到延伸中的寡糖单位上。确定糖基转移酶基因的特定功能是准确表征O抗原寡糖重复单位生物合成路径的关键。近期的研究表明,细菌糖蛋白多糖部分的变化与细菌感染紧密相关,其生物合成路径涉及的糖基转移酶与细菌表面O抗原寡糖单位密切相关[3]。表征糖基转移酶基因特定功能的常规方法是:首先在大肠杆菌中表达假定的糖基转移酶基因克隆产物,随后将表达产物、受体底物(脂载体)和供体底物(NDP-糖)孵育,应用液相色谱监测酶活性并纯化制备酶促反应产物,应用一维和二维核磁共振(NMR)技术鉴定糖基转移酶基因的特定功能[4]。然而,常规方法样品需要量大,并且实验过程繁琐。
基质辅助激光解吸电离-飞行时间质谱(MALDI-TOF MS)技术可提供更灵敏、精准和高重现性的结构信息,为高通量快速检测糖复合物提供了技术平台[5~10]。近年来,碰撞诱导解离(CID)MALDI-TOF MS技术不断发展和完善,如通过应用特异性糖苷外切酶[11]、新型基质的研发[12,13]、定性数据库的不断完善[14]以及离子淌度[15]和糖芯片[16,17]的应用等,进一步拓宽了研究领域,并获得了尽可能多的糖复合物定性信息。
在破译肠出血性大肠杆菌(EHEC)O77的O抗原基因簇序列基础上,结合O抗原寡糖重复单位的化学结构,通过搜索序列的同源性,本研究组在前期工作中推测出O77 O抗原寡糖重复单位生物合成途径涉及β-1,3-甘露糖糖基转移酶(WbaD)和α-1,2-α-1,2-甘露糖糖基转移酶(WbaC)(见图1)。在此基础上,利用电喷雾碰撞诱导解离串联质谱(CID-ESI-MSn)技术[18]研究了上述两个糖基转移酶的功能。本研究以WbaD和WbaC为研究对象,利用MALDI-TOF质谱技术证明了各自酶促反应产物的形成,进一步应用高能CID-MALDI-TOF质谱技术对相应酶促反应产物的化学结构进行了初步表征,在此基础上,建立了新的高效、灵敏的细菌 O抗原寡糖重复单位生物合成路径的初步表征方法。
2 实验部分
2.1 仪器与试剂
4700 Applied Biosystems基质辅助激光解析电离飞行时间质谱仪(美国ABI公司)。甲醇、乙腈(色谱纯,美国Thermo Fisher公司); α-氰基-4-羟基肉桂酸(α-CHCA,美国Fluka公司); 2-吗啉乙磺酸(2-(N-morpholino)ethanesulfonic acid, MES)、GDP-Man(美国Sigma-Aldrich公司); 实验用水为二次蒸馏水。 大肠杆菌O77 O抗原中wbaD 基因和wbaC基因的克隆、含相应重组质粒的细菌培养及酶促反应细胞膜提取物的制备的方法均参照文献[18]。由于WbaD和WbaC与细胞膜之间存在相互作用,本研究利用含wbaD或wbaC基因的重组质粒细胞膜部分作为酶的来源,进行酶促反应。
2.2 酶活性测定反应体系
2.2.1 单酶酶促反应体系 1 mmol/L 受体GlcNAc-PP-PhU(或WbaD 酶促反应产物,空白对照以水替代), 75 mmol/L MES 缓冲液(pH 6.5), 5 mmol/L MnCl2, 5 mmol/L GDP-Man和10μL 细菌膜提取物(1~12μg,阴性对照分别以大肠杆菌DH5α和 BL21代替细菌膜提取物)。37℃水浴中反应30 min后,沸水浴中加热3 min,离心(12000 r/min,5 min)。取0.3μL稀释200倍,取上清待测液与等体积基质,滴于样品探头靶心,室温干燥结晶后,直接分析测试。
2.2.2 双酶(WbaD 和WbaC)偶联酶促反应体系 含1 mmol/L 受体GlcNAc-PP-PhU(空白对照以水替代)、 5 mmol/L MnCl2、 75 mmol/L MES缓冲液(pH 6.5), 5 mmol/L GDP-Man和10μL 细菌膜(WbaD 和WbaC)提取物(1~24μg,分别以大肠杆菌DH5α和 BL21代替细菌膜提取物为阴性对照)。37℃水浴反应一定时间后,沸水浴中加热3 min,离心(12000 r/min,5 min)。取0.3μL稀释200倍后,取上清待测液与等体积基质,滴于样品探头靶心,室温干燥结晶后,直接分析测试。
2.3 MALDI-TOF MS条件
Nd:YAG激光器, 波长355 nm, 基质为α-CHCA,反射模式,负离子谱检测。碰撞诱导解离(CID)质谱实验中,碰撞小室内碰撞气体为空气, 其压力3.33×104 Pa, 碰撞能量1 kV。为方便质谱解析,本研究将预期的酶促反应产物苯氧基十一烷基二磷酸二和四糖视为五和七糖(寡糖),苯氧基十一烷基和二磷酸基相应地分别代表一个和两个糖环。所有碎片应用Domon-Costello命名法识别[19]。
3 结果与讨论
3.1 WbaD和WbaC酶活性的质谱监测
在负离子模式下,WbaD 酶促反应产物的MALDI-TOF MS分析結果见图2C,丰度最高的准分子离子峰 m/z 789.2134 [M-H]与Man-GlcNAc-PP-PhU(苯氧基十一烷焦磷酸化二糖)的分子量相对应, 表明WbaD具有明显的甘露糖转移酶活性; WbaC酶促反应产物的MALDI-TOF MS分析结果见图2D,丰度最强的准分子离子峰 m/z 1113.5176 [M-H]与Man-Man-Man-GlcNAc-PP-PhU的分子量相对应, 表明WbaD 酶促反应产物在WbaC催化下,甘露糖基被连续转移到Man-GlcNAc-PP-PhU受体上,最终生成Man-Man-Man-GlcNAc-PP-PhU。以大肠杆菌BL21(不含质粒)的细胞膜作为酶促反应的负对照,以水代替给予体底物进行酶促反应的空白对照,均未检测到相应的糖基转移酶活性(图2A和2B)。
3.2 WbaD 酶活性的初步表征
在负离子模式下,WbaD产物的二级质谱图见图3。以m/z 789.4332 [M-H]为前驱离子(图3), 观察到4个源于磷酸二脂键部分碎裂的MS2产物离子,分别为m/z 444.5749 [M-H- P-PhU]、m/z 524.6265 [M-H-PhU]、m/z 462.6034 [C3]和m/z 405.5491 [M-Man-H2O-GlcNAc-H]。源于糖苷键断裂的产物离子有m/z 241.2966 [M-H-P-PhU-Man-Ac]和m/z 423.5699 [M-H-Man-GlcNAc]。 m/z 79.1739 [PO3]和m/z 159.0979 [HPO3PO3]源于磷酸二脂键部分两个键的同时碎裂; m/z 691.1074[M-H3PO4-H]源于m/z 789.4332 脱掉1个H3PO4分子。未发现涉及开环的产物离子。
对于WbaD产物, MS2 谱图(图3) 中特征碎片离子m/z 423和 405分别对应[PP-PhU-H]及该碎片离子失去水分子得到的碎片离子, 与已发表的PP-PhU 数据一致[18,20], 同时证明初始受体底物的PP-PhU 基团并未受到酶促反应的影响; 焦磷酸化二糖部分存在3个特征碎片离子m/z 444 [M-H-P-PhU], m/z 524 [M-H-PhU]和m/z 462.6034 [C3],可以推断WbaD催化转移一个甘露糖残基到GlcNAc-PP-PhU上,形成了Man-GlcNAc-PP-PhU。
3.3 双功能酶WbaC 酶活性的初步表征
在负离子模式下,双功能酶WbaC酶促反应中间产物及终产物的二级质谱如图4和图5所示。
以m/z 951.5690 [M-H]为WbaC 酶促反应中间产物的前驱离子, 观察到4个源于磷酸二脂键部分碎裂的MS2产物离子(图3),分别为m/z 606.6842 [M-H-P-PhU]、 m/z 686.7902 [M-H-PhU]、m/z 624.7021 [C3]和m/z 405. 4538 [M-H-Man-GlcNAc-H2O-Man]。源于糖苷键断裂的产物离子有m/z 423.4701 [M-H-Man-GlcNAc-Man]。m/z 79.1707 [PO3]和m/z 159.0580 [HPO3PO3]源于磷酸二脂键部分两个键的同时碎裂; m/z 853.1914[M-H3PO4-H]源于m/z 951.5690 脱掉1个 H3PO4分子。未发现涉及开环的产物离子。
对于WbaC 酶促反应中间产物, 同样在MS2 谱图(图4)中, 特征碎片离子m/z 423和 405分别对应[PP-PhU-H]及此碎片离子失去水分子得到的碎片离子, 与已发表的PP-PhU 数据一致[18,20], 同时证明初始受体底物的PP-PhU 基团并未受到酶促反应的影响; 3个特征碎片离子m/z 606 [M-H-P-PhU]、 m/z 686 [M-H-PhU]和m/z 624 [C3]的存在,可以推断WbaC催化转移一个甘露糖残基到Man-GlcNAc-PP-PhU上,形成了Man-Man-GlcNAc-PP-PhU。
以m/z 1113.5828 [M-H]为WbaC 酶促反应终产物的前驱离子(图5), 观察到4个源于磷酸二脂键部分碎裂的MS2产物离子,分别为m/z 768.8329 [M-H-P-PhU]、4 m/z 848.8521 [M-H-PhU]、 m/z 786.8129 [C3]和m/z 405. 4028 [M-H-Man-GlcNAc-H2O-Man-Man]。m/z 423.4065 [M-H-Man-GlcNAc-Man-Man]为源于糖苷键断裂的产物离子。 m/z 79.1664 [PO3]和m/z 159.0576 [HPO3PO3]源于磷酸二脂键部分两个键的同时碎裂; m/z 1015.3563 [M-H3PO4-H]来源于离子m/z 1113.5828 脱掉 1个H3PO4分子。未发现涉及开环的产物离子。
对于WbaC 酶促反应终产物, 同样在MS2 谱图中(图5), 特征碎片离子m/z 423和 405分别对应[PP-PhU-H]及此碎片离子失去水分子得到的碎片离子, 与已发表的PP-PhU 数据一致[18,20], 同时证明初始受体底物的PP-PhU 基团并未受到酶促反应的影响; 3个特征碎片离子m/z 768 [M-H-P-PhU]、 m/z 848 [M-H-PhU]和m/z 786 [C3]的存在,可以推断双酶(WbaD 和WbaC)连续催化转移3个甘露糖残基到 GlcNAc-PP-PhU上,形成了Man-Man-Man-GlcNAc-PP-PhU。上述结果表明,WbaC不仅能添加第二个甘露糖残基,而且能添加第三个甘露糖残基,具有双甘露糖糖基转移酶功能。双功能糖基转移酶并不多见,到目前为止,得到明确表征的双功能糖基转移酶有以相同的或不同的糖苷键连接方式催化转移单独一种单糖的双功能糖基转移酶(如Alg11,GDP-Man)[21], 也有以相同的或不同的糖苷键连接方式催化转移两种不同单糖的双功能糖基转移酶(如AtGALS1,UDP-Gal 和UDP-Arap)[22]。
通过质量数分析发现,WbaD(m/z 789.4332)和WbaC(m/z 1113.5828)产物离子的高能CID MALDI-TOF/TOF MS碎片离子都主要源于磷酸二酯键部分的断裂, 提供的脂寡糖骨架信息可证实新的单糖残基已经成为脂寡糖的一部分。虽然缺少可提供重要的区域选择性信息的跨环断裂碎片离子和源于寡糖部分糖苷键断裂的Y型离子, 无法确定脂寡糖中的寡糖序列和新加入单糖残基与相邻单糖残基间糖苷键的链接方式,但MALDI-TOF-MS技术能测定完整的糖链分子质量, 同时还可以应用CID技术证明新的单糖残基被转移到相应的底物脂寡糖,借助已知细菌表面O抗原寡糖单位生化合成途径涉及的糖基转移酶生物信息学分析结果,可以实现细菌表面O抗原寡糖重复单位生化合成途径的高通量初步表征。
需要特别指出的是,针对脂寡糖糖链精细结构的表征,现有软硬件条件下CID-MALDI-TOF/TOF和CID-ESI-MSn都无法表征异头构型(SymbolaA@或SymbolbA@)。MALDI和ESI质谱在CID 模式下产生的脂寡糖串联质谱图均主要表现为源于磷酸二酯键部分的断裂[18, 20]。在涉及脂寡糖中寡糖的连接顺序和连接方式的确定时, CID-ESI-MSn提供的结构信息更细致(图6和图7)。首先, ESI-MS/MS源于糖苷键断裂的Y型离子是对脂寡糖中的寡糖连接顺序进行确认的重要依据之一。其次, 对于糖链结构的解析,CID-ESI-MSn 离子阱的多级质谱可提供重要的区域选择性信息的跨环断裂碎片离子, 确认脂寡糖中寡糖的连接方式(图6和图7); 而CID-MALDI-TOF/TOF中呈现出一个断层。再次,CID-MALDI-TOF/TOF能耐受较高浓度的盐、缓冲剂和其它难挥发成分, 大大地降低了对样品预处理的要求; 样品用量少,仅需微升级的样品溶液; 以单电荷峰为主, 碎片峰少, 有利于对复杂混合物的检测; 由于在灵敏度、分辨率、速度、通量等指标占绝对优势,在分析珍稀生物样品时非常有力。而CID-ESI-MSn方式进行样品预处理需严格除盐,样品用量为毫升级, 脂寡糖的跨环断裂碎片离子需要三级及以上质谱确定。在硬件条件许可的条件下,两条路线互补使用,在O-重复单位生物合成路径完整表征的研究中十分必要。
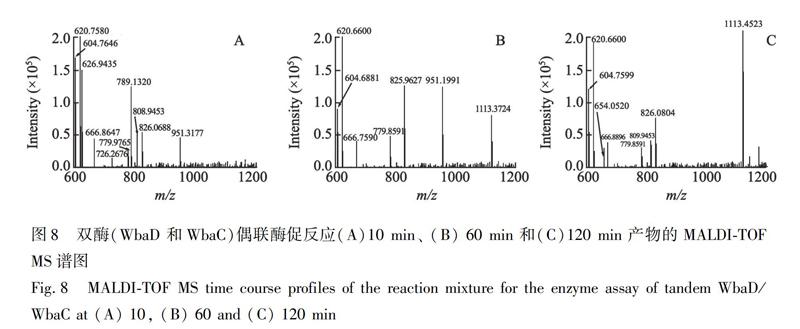
3.4 细菌 O抗原寡糖重复单位生物合成涉及的全部糖基转移酶作用方式初步探索
高尔基体内多糖的合成不仅依赖糖基转移酶的催化活性,还取决于其正确的定位及彼此间的时空相互作用[23]。文献报道的糖基转移酶间相互作用有协同[24,25]和交替[26,27]两种方式。借助时间推移分析[28,29],初步考察了两个糖基转移酶的作用方式。初始受体底物为GlcNAc-PP-PhU,給体底物GDP-Man过量,WbaD 和WbaC同时存在条件下,反应开始10 min(图8A),同时出现Man-GlcNAc-PP-PhU(相对丰度大)和Man-Man-GlcNAc-PP-PhU(相对丰度小)两个质谱峰,表明与WbaD协同合作,WbaC催化转移了第一个甘露糖残基; 随后,初始受体底物(GlcNAc-PP-PhU)质谱峰不断降低,伴随着WbaD 产物(Man-GlcNAc-PP-PhU)先后彻底消失,然后出现Man-Man-Man-GlcNAc-PP-PhU峰(相对丰度小)(图8B),表明WbaC催化转移第二个甘露糖残基,与WbaD以交替方式形成重复单位; 120 min后,随着Man-Man-Man-GlcNAc-PP-PhU峰强度不断增加,Man-Man-Man-GlcNAc-PP-PhU成为唯一的终产物(图8C)。
4 结 论
在负离子模式下,对大肠杆菌O77两个甘露糖基转移酶酶促反应产物(wbaD基因和wbaC基因编码的)混合物的MALDI-TOF和CID MALDI-TOF/TOF分析结果证明WbaD和WbaC涉及脂多糖的合成:WbaD转移Man残基到GlcNAc, 而WbaC连续转移两个Man残基到Man。本方法可方便地用于O-抗原合成涉及的其它糖基转移酶的分析。除通用的糖基转移酶(WecA)之外, WbaD 和WbaC是O77 O-重复单位合成所需的仅有的两个糖基转移酶。为深入考察O抗原寡糖重复单位的生物合成机制,本研究初步探索了两个糖基转移酶的作用方式,发现协同合作和交替方式同时存在。本研究结果为阐明细菌O抗原合成机理,探索O抗原在细菌生长和致病中的作用,以及重组疫苗和应用生物工程技术大规模合成功能性糖链提供了实验依据。
References
1 Erridge C, Bennett-Guerrero E, Poxton I R. Microbes Infect., 2002, 4(8): 837-851
2 Lindberg A A, Wollin R, Bruse G, Ekwall E, Svenson S B. Am. Chem. Soc. Symp. Ser., 1983, 231: 83-118
3 Hug I, Feldman M F. Glycobiology, 2011, 21: 138-151
4 Yuan S, Yin S, Liu M, Kong J Q. Sci. Rep., 2018, 8: 5886
5 Palmigiano A, Bua R O, Barone R, Rymen D, Regal L, Deconinck N, Dionisi-Vici C, Fung C W, Garozzo D, Jaeken J, Sturiale L. J. Mass Spectrom., 2017, 52(6): 372-377
6 Arai T, Biely P, Uhliarikova I, Sato N, Makishima S, Mizuno M, Nozaki K, Kaneko S, Amano Y. J. Biosci. Bioeng., 2019, 127(2): 222-230
7 Benktander J D, Gizaw S T, Gaunitz S, Novotny M V. J. Am. Soc. Mass Spectrom., 2018, 29(6): 1125-1137
8 Jacobson A N, Choudhury B P, Fischbach M A. MBIO, 2018, 9(2): e02289-17
9 Casabuono A C, Czibener C, Del Giudice M G, Valguarnera E, Ugalde J E, Couto A S. J. Am. Soc. Mass Spectrom., 2017, 28(12): 2716-2723
10 Brijesha N, Nishimura S I, Aparna H S. J. Agric. Food Chem., 2017, 65(8): 1496-1506
11 Weigel P H, Baggenstoss B A, Washburn J L. Glycobiology, 2017, 27(6): 536-554
12 Lee C, Ni C K. J. Am. Soc. Mass Spectrom., 2019, 30: 1455-1463
13 Jovanovic M, Peter-Katalinic J. J. Mass Spectrom., 2016, 51(2): 111-122
14 Jovanovic M, Tyldesley-Worster R. Rapid. Commun. Mass Spectrom., 2017, 31(10): 873-885
15 Phillips N J, John C M, Jarvis G A. J. Am. Soc. Mass Spectrom., 2016, 27(7): 1263-1276
16 Martini F, Eckmair B, Stefanic S, Jin C S, Garg M, Yan S, Jimenez-Castells C, Hykollari A, Neupert C, Venco L, Silva D V, Wilson I B H, Paschinger K. Nat. Commun., 2019, 10: 75
17 Hykollari A, Malzl D, Eckmair B, Vanbeselaere J, Scheidl P, Jin C S, Karlsson N G, Wilson I B H, Paschinger K. Mol. Cell. Proteomics, 2018, 17(11): 2177-2196
18 Zhou D W, Chen C, Xu L L, Utkina N, Danilov L, Torgov V, Veselovsky V, Liu B, Feng L. Carbohyd. Res., 2016, 424: 24-29
19 Domon B, Costello C E. Glycoconjugate J., 1988, 5: 397-409
20 Zhou D W, Utkina N, Li D G, Dong C Y, Druzhinina T, Veselovsky V, Liu B. Carbohyd. Res., 2013, 381: 43-50
21 Absmanner B, Schmeiser V, Kampf M, Lehle L. Biochem. J., 2010, 426: 205-217
22 Laursen T, Stonebloom S H, Pidatala V R, Birdseye D S, Clausen M H, Mortimer J C, Scheller H V. Plant J., 2018, 94(2): 340-351
23 Khoder-Agha F, Harrus D, Brysbaert G, Lensink M F, Harduin-Lepers A, Glumoff T, Kellokumpu S. J. Biol. Chem., 2019, 294(39): 14383-14393
24 Salem S M, Weidenbach S, Rohr J. ACS Chem. Biol., 2017, 12(10): 2529-2534
25 Malmierca M G, Perez-Victoria I, Martin J, Reyes F, Mendez C, Olano C, Salas J A. Appl. Environ. Microb., 2018, 84(18): e01462-18
26 DeAngelis P L, Oatman L C, Gay D F. J. Biol. Chem., 2003, 278(37): 35199-35203
27 Vionnet J, Vann W F. Glycobiology, 2007, 17(7): 735-743
28 Xiang Z, Block M, Lofman C, Nilsson G. J. Allergy Clin. Immunol., 2001, 108(1): 116-121
29 Devaux M F, Jamme F, Andre W, Bouchet B, Alvarado C, Durand S, Robert P, Saulnier L, Bonnin E, Guillon F. Front. Plant Sci., 2018, 9: 200
Characterization of Biosynthetic Pathway of Tetrasaccharide Repeating
Unit of Escherichia Coli O77 O-antigen by Matrix-assisted Laser
Desorption-Ionization Time-of-Flight Mass Spectrometry
CHU Jian1, JIA Tian-Yuan2,3, GONG Zhong-YING4, DONG Chen-Ying 2,3, ZHOU Da-Wei*2,3
1(School of Automation and Electrical Engineering, Tianjin University of Technology and Education, Tianjin 300222, China)
2(TEDA Institute of Biological Sciences and Biotechnology, Nankai University, Tianjin 300457, China)
3(Key Laboratory of Molecular Microbiology and Technology, Ministry of Education, Nankai University, Tianjin 300457, China)
4(Department of Neurology, Tianjin First Center Hospital, Nankai University, Tianjin 300192, China)
Abstract Mass spectrometry is a rapid, sensitive and accurate approach for the direct monitoring of enzyme-catalyzed reaction that does not require chromophore or radiolabeling, and thus provides a viable alternative to existing analytical techniques. Herein, a simple and efficient assay for characterization of E. coli O77 O-unit biosynthetic pathway by using matrix-assisted laser desorption-ionization (MALDI) mass spectrometry with collision-induced dissociation (CID) was demonstrated by WbaD and WbaC (two glycosyltransferases from E. coli O77 O antigen) lipooligosacharide enzymatic products, respectively. The rapid and direct monitoring of the enzymatic reaction was achieved by subjecting a small amount (0.3 μL) of the reaction mixture to MS analysis without chromatographic separation or desalting steps, and subsequent MS-MS analyses of their lipooligosacharide enzymatic products via collision-induced dissociation enabled the structure of the products of enzyme-catalyzed reaction to be determined. The results demonstrated that WbaD catalyzed the transfer of the first Man residue to GlcNAc-PP-PhU and formed Man-GlcNAc-PP-PhU, and WbaC acted actted after WbaD, adding two Man residues to the growing polymer. Furthermore, the model for E. coli O77 O-unit biosynthesis was studied with the help of time-lapse analysis, and it was proposed that WbaC and WbaD acted in both cooperative and alternating fashion to form the repeat unit and WbaC did not act in tandem with WbaD. Collectively, these data demonstrated that a high-energy CID MALDI-TOF/TOF MS-based platform was applicable to the facile characterization of biosynthetic pathways of O-unit and offered significant advantages over current methods in terms of speed, sensitivity, reproducibility, automation and reagent costs, which would open new way for the future mechanistic study of O-unit biosynthesis and exploitation of these fascinating glycocatalysts.
Keywords O-antigen oligosaccharide repeating unit; Lipooligosaccharide; Biosynthetic pathway; Matrix-assisted laser desorption-ionization time-of-flight mass spectrometry
(Received 29 December 2019; accepted 12 June 2020)
This work was supported by the Fundamental Research Funds for the Central Universities, Nankai University (No. 63191133) and the Tianjin Enterprise Science and Technology Commissioner Project (No. 18JCTPJC65600).
2019-12-29收稿; 2020-06-12接受
本文系中央高校基本科研業务费专项资金项目(No.63191133) 和天津市企业科技特派员项目(No. 18JCTPJC65600) 资助
* E-mail: daweizhou@nankai.edu.cn
