金纳米棒免疫层析试纸条定量检测前列腺特异性抗原
2020-08-21张婳李群刘桂锋
张婳 李群 刘桂锋
摘 要 建立了一种基于金纳米棒(GNR)的免疫层析方法,用于快速定量检测前列腺特异性抗原(PSA)。以GNR为标记探针,通过包裹羧基化的聚合物后,采用共价偶联的方式连接抗PSA单克隆抗体形成偶联物,以鼠抗PSA单克隆抗体和羊抗鼠IgG分别喷涂硝酸纤维素膜,形成试纸条的检测线和质控线,采用三明治夹心法构建GNR免疫层析试纸条,用于PSA的定量检测。结果表明,GNR免疫层析试纸条特异性强,稳定性好,灵敏度高,对PSA检测的线性范围为0.1~50 ng/mL,检出限为0.1 ng/mL,批内和批间变异系数均小于10%,且具有良好的保存稳定性。本方法可用于检测血清中PSA的浓度水平,对于前列腺癌的早期診断、监测治疗及预后判断具有重要意义。
关键词 金纳米棒; 免疫层析; 前列腺特异性抗原; 定量检测
1 引 言
前列腺癌是男性泌尿生殖系统最常见的恶性肿瘤,占恶性肿瘤男性病死率的第二位,最常用的检查是前列腺特异性抗原(Prostate specific antigen, PSA)筛查,即测定血清中的PSA浓度水平[1,2]。PSA作为前列腺癌的标志物,具有敏感性和特异性强及检查的无创性等特点,在前列腺癌的诊断中发挥了重要作用。PSA是一种主要由前列腺泡和导管上皮细胞分泌的单链糖蛋白,在功能上属于类激肽释放酶的一种丝氨酸蛋白酶,参与精液的液化过程,被分泌入前列腺液或精液中,以有活性的游离形式(f-PSA)存在,而血清中的PSA主要以结合形式(c-PSA)存在,通常以f-PSA与c-PSA之和代表血清总的PSA水平[3,4]。血清PSA测定的准确度高、稳定且重复性好,是常规临床用于前列腺良性与恶性疾病诊断及前列腺癌患者术后跟踪的重要指标。在正常生理条件下,前列腺导管系统与周围环境在屏障作用下,血清中仅有微量的PSA; 当肿瘤、增生或炎症发生时,正常腺管结构遭到破坏,引起血清中PSA浓度升高[5]。血清PSA正常浓度低于4.0 ng/mL; PSA浓度高于10 ng/mL时,患前列腺癌的危险性增加,需要进行前列腺活组织穿刺检查[6]。检验血清中PSA的水平有助于前列腺癌的早期诊断、监测治疗及预后判断,对高危人群,尤其是50岁以上男性前列腺癌的普查具有重要意义。目前已发展了一系列高灵敏的检测方法用于PSA的检测,如电化学发光法[7]、表面增强拉曼光谱法[8,9]、比色分析法[10]、光电化学免疫分析法[11,12]等,但这些方法多需要昂贵的仪器设备、专业的操作人员和复杂的处理过程,且耗时较长。临床上对血清PSA的检测方法有放射免疫分析法、酶联免疫分析法和化学发光免疫分析法,其中,放射免疫分析法具有较高的灵敏度、准确度和精确度,但试剂存在放射性污染,并且标记物半衰期短; 酶联免疫分析法操作步骤相对繁琐,灵敏度有待提高; 化学发光免疫分析法虽可实现全自动化检测,灵敏度高,但发光强度受环境因素影响较大,工作曲线随时间漂移。因此,有必要发展一种快速、简便且灵敏的PSA检测方法。
免疫层析技术是一种简便、快速的诊断方法,也是现场即时检测(Point of care testing, POCT)的重要工具[13~15],最早用于人绒毛膜促性腺激素HCG的检测,以此作为早期怀孕的诊断依据。免疫层析技术主要借助免疫层析试纸条完成,其检测原理分为双抗体夹心法和竞争反应法,其中,双抗体夹心法适于检测大分子物质(如肿瘤标志物、酶等),而竞争法适于检测小分子物质(如毒素、毒品等)[16,17]。免疫层析技术不仅操作简便、检测快速、特异性强、稳定性好,而且携带方便,已广泛应用于临床诊断、食品安全、药物检测、环境污染等领域[18~20]。目前,市场上基于免疫层析检测产品的数量持续上升,主要是由于试纸条的各组件价格低廉,性价比高,适合现场快速检测和诊断。近年来,一些纳米材料(如量子点、磁纳米粒子、上转换纳米粒子等)被应用于免疫层析检测研究中[21~23],提高了检测的灵敏度,并实现了定量检测。贵金属纳米粒子,特别是金和银纳米粒子,具有与其自身及外界环境相关的局域表面等离子体共振(LSPR)光散射性质,适于作为光散射分析探针。近年发展最为成熟的胶体金免疫层析技术,是以胶体金纳米颗粒作为免疫标记物的一种免疫层析检测方法,结果判读直观,并且无需任何仪器设备,因而引起了广泛关注[24~26]。尽管胶体金免疫层析技术具有偶联过程简单、可肉眼直接观察结果等优点,但胶体金通过疏水键与蛋白偶联形成免疫标记探针,其稳定性易受环境中离子浓度和pH值的影响,且胶体金免疫层析试纸条的灵敏度普遍不高,难以实现定量测定,因此,许多研究工作围绕着寻找新的标记材料而展开。
相比于球形的胶体金纳米粒子,一维金纳米棒(GNR)具有独特的光学性能、催化活性强、稳定性和生物相容性好等优点,其消光系数(~109 L/(mol·cm))高于球形金纳米粒子(~108 L/(mol·cm))。由于各向异性的形状,GNR表现出两个LSPR吸收峰(横向和纵向吸收峰),分别由沿着纳米粒子宽端和长端的电子振荡产生[27],且可通过改变长径比,使纵向吸收峰位于可见光区域至近红外区域,对周围环境介电性质的变化更加敏感[28~30]。因此,GNR用于生物分子检测时更灵敏。本研究结合GNR标记技术和免疫层析技术,构建了基于GNR的免疫层析试纸条用于PSA的检测,建立了一种快速、灵敏的PSA定量检测技术,为前列腺癌等疾病的筛查及早期诊断提供了新方法。
2 实验部分
2.1 仪器与试剂
UVmini-1240紫外-可见分光光度计(日本岛津公司); ELAN 9000/DRC电感耦合等离子体质谱仪(ICP-MS,美国Thermo Fisher Scientific公司); HITACHI H-600型透射电子显微镜(日本Hitachi公司); Arrayit微阵列扫描仪(美国Telechem公司); 5415R型高速冷冻离心机(德国Eppendorf公司); Nano-ZS粒度仪(英国Malvern公司); HPC-250CL恒温恒湿箱(上海申贤恒温设备厂); SG-ZKX250真空干燥箱(上海大恒光学精密机械有限公司); HM3030 XYZ三维划膜仪、ZQ2002微电脑斩切机、GD300滚动式手动裁纸刀(上海金标生物科技公司); 硝酸纤维素膜(NC膜,135 s)、样品垫(CFSP001700)、结合垫(GFDX203000)、吸水垫(CFSP223000)及PVC底板(HF000MC100)均购自美国Millipore公司。
N-羟基琥珀酰亚胺(NHS)、1-乙基-3-(3-二甲氨基丙基)碳二亚胺盐酸盐(EDC)、聚丙烯酸钠(PAA)、HAuCl4·3H2O(上海阿拉丁生化科技股份有限公司); NaBH4、AgNO3(北京化工厂); 抗坏血酸(AA,上海蓝季生物); 十六烷基三甲基溴化铵(CTAB)、2-(N-吗啉)乙磺酸(MES)、牛血清白蛋白(BSA)(北京鼎国昌盛生物技术有限责任公司); PSA、鼠抗PSA单克隆抗体(L1C00401,cAb)、鼠抗PSA单克隆抗体(L1C00402,dAb)、羊抗鼠IgG、AFP、CA125、CA19-9(上海领潮生物科技有限公司); 其它试剂均为分析纯。实验用水為Milli-Q纯水系统(美国Millipore公司)制备的超纯水(18.2 MΩ cm)。
2.2 金纳米棒-抗体(GNR-dAb)偶联物的制备
采用种子生长法合成GNR[26],再包裹上PAA后,用于抗体的偶联,具体步骤如下:取1 mL GNR溶液,与100 μL 1% PAA混合搅拌2 h,9000 r/min离心后,分散于10 mmol/L MES缓冲溶液(pH=7.0)中,加入10 μL 100 mmol/L EDC和10 μL 100 mmol/L NHS活化30 min,再加入10 μg dAb,继续反应3 h,加入10 μL 10 mg/mL BSA封闭30 min,离心,沉淀重新分散在100 μL 20 mmol/L Tris-HCl(pH=8.0,含1% BSA,0.2 mg/mL NaN3,20%蔗糖和5%海藻糖)中,即得到GNR-dAb偶联物。
2.3 GNR免疫层析试纸条的制备及检测过程
将NC膜贴在带有粘性的PVC底板对应区域,利用HM3030三维划膜仪将羊抗鼠IgG(1 mg/mL)和PSA单克隆抗体cAb(1 mg/mL)按1 μL/cm划线量分别喷涂于NC膜上作为质控线(C线)和检测线(T线),37℃烘干过夜。然后,将样品垫、结合垫和吸水垫粘贴在PVC底板相应位置,其中样品垫预先用处理液(20 mmol/L Tris-HCl, pH=8.0, 0.1% Tween 20, 0.5% PVP)浸泡后,于37℃真空干燥2 h,利用ZQ2002自动斩切机将大板切割成3 mm宽试纸条,室温干燥,保存备用。将适量GNR-dAb加到试纸条结合垫上,37℃干燥0.5 h,将待测样品滴加到样品垫上,15 min后观察结果,并利用Arrayit微阵列扫描仪采集信号。
2.4 GNR免疫层析试纸条灵敏度考察
分别用0.01 mol/L PBS(pH=7.4)配制浓度为0、0.1、1、5、10、50和100 ng/mL的PSA溶液,滴加至样品垫上进行检测,15 min后进行信号采集,每个浓度重复检测3次。
2.5 GNR免疫层析试纸条特异性考察
分别配制PSA(100 ng/mL)、甲胎蛋白AFP(100 ng/mL)、肿瘤标志性糖类抗原CA-125(100 U/mL)和CA-199(100 U/mL)及其混合液,滴加至样品垫上进行检测,15 min后观察显色情况并进行信号采集,每个样品重复检测3次,判断试纸条的特异性。
2.6 GNR免疫层析试纸条性能评价
血清样本取自吉林大学第一医院某男性病人,无前列腺疾病,患者已知情同意。分别向血清中加入PSA至其终浓度为1、10和50 ng/mL,血清浓度均为20%,将混合溶液滴加到样品垫上,孵育15 min后进行信号采集,每个浓度重复检测3次,考察试纸条的准确度和精密度。
将试纸条密封,于4℃保存不同时间,分别取出用于PSA的检测,考察其保存稳定性。取同一批次和不同批次的试纸条分别对不同浓度PSA进行检测,评价试纸条的批内稳定性和批间稳定性。
3 结果与讨论
3.1 GNR免疫层析试纸条的检测原理
采用双抗体夹心法构建GNR免疫层析试纸条的检测流程如图1所示。当待测样品中含有PSA时,首先与结合垫上的GNR-dAb结合,再层析到NC膜上T线区域与鼠抗PSA单克隆抗体cAb结合,形成双抗体夹心免疫复合物,T线显色,其颜色深浅/信号强度与PSA浓度正相关,未与cAb结合的偶联物继续层析至C线区域,
与羊抗鼠IgG相结合而C线显色,判定为阳性结果; 反之,当待测样品中不含PSA时,样品与偶联物不反应,不能被T线上的单克隆抗体捕获,无法形成夹心,进而T线不显色,仅C线显色,判定为阴性结果。若C线不显色,则检测无效。反应完成后,利用微阵列扫描仪采集信号并提取相应强度值,实现对PSA的定量检测。
3.2 GNR-dAb偶联物的制备及表征
采用种子生长法制备的GNR为棒状结构(图2A),分散性良好,尺寸为(45±3)nmSymboltB@(10±2)nm。图2B为GNR的吸收光谱图,在519和743 nm处有两个明显的吸收峰,分别对应GNR横向和纵向的吸收峰。在GNR表面修饰上dAb后,横向吸收峰和纵向吸收峰均明显红移,分别位移至526 nm和755 nm,这主要是由于连接上抗体后,纳米粒子表面的介电性质发生改变,这也表明dAb成功地连接在GNR表面,形成了偶联物。
3.3 GNR免疫层析试纸条的优化
GNR-dAb偶联物的用量及待测样品用量均会影响GNR试纸条检测的灵敏度。分别将4、6、8、10 μL GNR-dAb滴加至结合垫上,在样品垫上滴加60 μL 100 ng/mL PSA溶液进行检测,从图3可见,随着GNR-dAb偶联物体积的增加,信噪比(S/N,目标物T线信号强度与空白T线信号强度的比值)逐渐增大,当体积为8 μL时达到最大。继续增加偶联物体积,S/N反而下降,可能是由于偶联物数量过多,大量分布在NC膜上,导致背景信号过高,影响定量检测的准确性。选择GNR-dAb偶联物的用量为8 μL。在试纸条样品垫上分别滴加40、60、80和100 μL PSA溶液(50 ng/mL)的进行检测。当在样品垫上滴加40 μL样品时,由于结合垫上偶联物未能完全释放,C线和T线上信号都很微弱; 滴加100 μL样品时,由于大量溶液停滞在NC膜上,未能向吸水垫迁移,主要是由于液体量超过了吸水垫的吸收能力; 只有使用60和80 μL样品量时,偶联物很好地被释放且沿着NC膜顺利迁移至吸水垫,C线和T线均显示出较强的信号。考虑到样品的消耗量,选择60 μL为样品检测的最佳体积。
3.4 GNR免疫层析试纸条检测PSA的灵敏度
在优化的实验条件下,利用构建的GNR免疫层析试纸条分别对不同浓度的 PSA溶液进行检测,观察显色情况并采集信号,结果如图4所示。T线颜色随PSA浓度的增加而逐渐加深,S/N值随着PSA浓度的增加而增大,且在0.1~50 ng/mL浓度范围内呈良好的线性,线性方程为y=0.064x+3.349(R2=0.994)。当PSA浓度低于0.1 ng/mL时,微阵列扫描仪采集不到T线信号强度值,因此对PSA检测的检出限为0.1 ng/mL。与临床常用酶联免疫分析方法和化学发光免疫分析方法相比,GNR免疫層析试纸条操作简便,检测快速(仅需15 min),且不需昂贵的设备及专业的操作的人员,适合于现场检测。
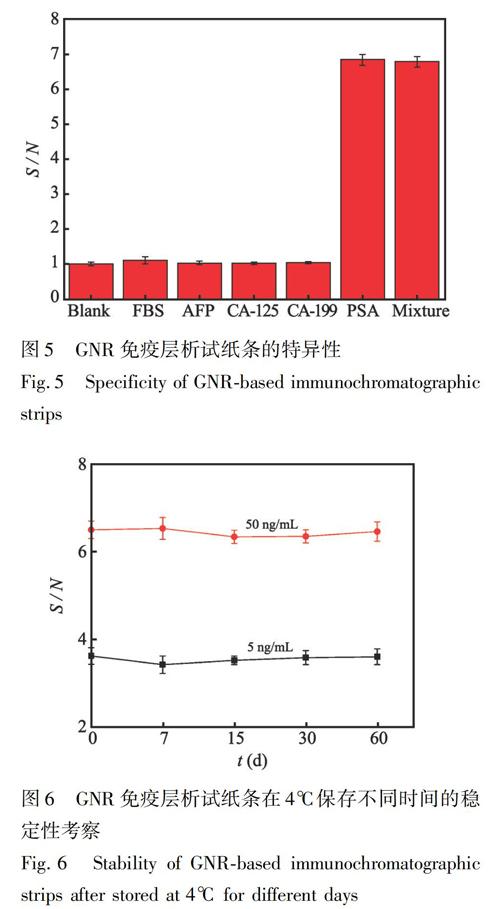
3.5 GNR免疫层析试纸条的特异性
利用GNR试纸条分别对PSA、AFP、CA-125、CA-199,及其混合液进行检测,由图5可见,只有滴加PSA和含PSA的混合液的试纸条均出现明显的T线和C线,而滴加AFP、CA-125和CA-199的试纸条只出现C线,表明此试纸条与其它蛋白没有交叉反应,对PSA检测具有较好的特异性。此外,为了考察构建的GNR试纸条用于血清检测时样品基质的抗干扰特性,对10%胎牛血清(FBS)进行了检测,也仅出现C线而无T线,表明FBS中成分对GNR试纸条检测无影响。
3.6 GNR免疫层析试纸条性能评价
采用GNR免疫层析试纸条进行血清样品的检测。在血清样本中添加不同浓度的PSA,利用GNR免疫层析试纸条进行检测,结果如表1所示,加标回收率在97.9%~113.1%之间, RSD在2.2%~5.9%之间,表明GNR免疫层析试纸条检测血清中的PSA具有良好的回收率及准确度,可用于快速、灵敏地定量检测血清中PSA。
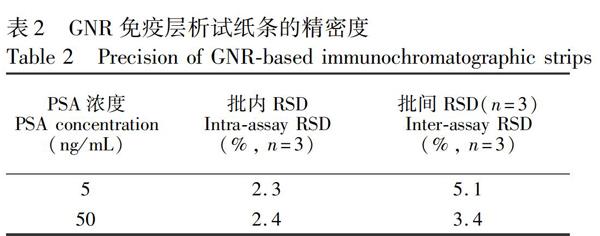
将GNR免疫层析试纸条密封,于4℃保存一定时间后,分别对5和50 ng/mL PSA溶液进行检测,由图6可见,60天内信号值未发生明显的变化,说明GNR免疫层析试纸条在4℃条件下保存稳定性良好。
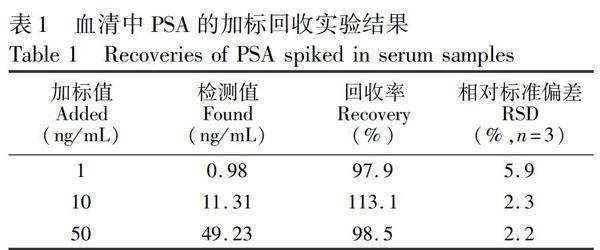
此外,考察了同一批次和不同批次的试纸条分别对5和50 ng/mL PSA溶液检测结果,由表2可知,批内和批间变异系数(Coefficient of variation, CV)均小于10%。以上结果表明,本方法具有较好的准确性和精确度。
4 结 论
构建了一种基于GNR的免疫层析试纸条用于PSA的快速定量检测,此试纸条具有灵敏度高、特异性强和稳定性好等优点。以GNR作为标记探针,抗体通过共价键结合在GNR表面形成的偶联物具有更好的稳定性。GNR免疫层析试纸条可实现直观可视的判读结果,也可利用GNR优异的LSPR光散射信号实现定量检测。对PSA的检出限为0.1 ng/mL, 线性范围为0.1~50.0 ng/mL,批间和批内变异系数均小于10%,在15 min即可完成检测,适合于即时、快速检测。本方法具有高的灵敏度、准确性、可靠性和稳定性,检测时间短,具有良好的实用价值和应用前景。
References
1 Siegel R, Ma J, Zou Z, Jemal A. CA Cancer J. Clin., 2014, 64(1): 9-29
2 Cuzick J, Thorat M A, Andriole G, Brawley O W, Brown P H, Culig Z, Eeles R A, Ford L G, Hamdy F C, Holmberg L, Ilic D, Key T J, Vecchia C L, Lilja H, Marberger M, Meyskens F L, Minasian L M, Parker C, Parnes H L, Perner S, Rittenhouse H, Schalken J, Schmid H, Schmitz-Drger B J, Schrder F H, Stenzl A, Tombal B, Wilt T J, Wolk A. Lancet Oncol., 2014, 15(11): e484-e492
3 Vasarainen H, Salman J, Salminen H, Valdagni R, Pickles T, Bangma C, Roobol M J, Rannikko A. World J. Urol., 2015, 33(11): 1735-1740
4 Koie T, Mitsuzuka K, Yoneyama T, Narita S, Kawamura S, Kaiho Y, Tsuchiya N, Tochigi T, Habuchi T, Arai Y, Ohyama C, Yoneyama T, Tobisawa Y. Int. J. Clin. Oncol., 2015, 20(1): 176-181
5 Salman J W, Schoots I G, Carlsson S V, Jenster G, Roobol M J. Adv. Exp. Med. Biol., 2015, 867: 93-114
6 Chen R, Huang Y R, Cai X B, Xie L P, He D L, Zhou L Q, Xu C L, Gao X, Ren S C, Wang F B, Ma L L, Wei Q, Yin C J, Tian Y, Sun Z Q, Fu Q, Ding Q, Zheng J H, Ye Z Q, Ye D W, Xu D F, Hou J Q, Xu K X, Yuan J L, Gao X, Liu C X, Pan T J, Sun Y H. PLoS One, 2015, 10(6): e0130308
7 Cao J T, Yang J J, Zhao L Z, Wang Y L, Wang H, Liu Y M, Ma S H. Biosens. Bioelectron., 2018, 99: 92-98
8 Wang J R, Xia C, Yang L, Li Y F, Li C M, Huang C Z. Anal. Chem., 2020, 92(5): 4046-4052
9 Cheng Z, Choi N, Wang R, Lee S, Moon K C, Yoon S Y, Chen L, Choo J. ACS Nano, 2017, 11(5): 4926-4933
10 Tan F, Yang Y, Xie X X, Wang L Q, Deng K Q, Xia X D, Yang X M, Huang H W. Analyst, 2018, 143(20): 5038-5045
11 Zhang K Y, Lv S Z, Lin Z Z, Li M J, Tang D P. Biosens. Bioelectron., 2018, 101: 159-166
12 Zhang L J, Luo Z B, Zeng R J, Zhou Q, Tang D P. Biosens. Bioelectron., 2019, 134: 1-7
13 Sajid M, Kawde A N, Daud M. J. Saudi Chem. Soc., 2015, 19(6): 689-705
14 XU Jun-Li, LIU Bei-Bei,WANG Yu-Long, LI Pan, YANG Kang, WU Qin, JIANG Lan, ZHANG Hao-Ran, YANG Li-Fei, ZHANG Cun-Zheng. Chinese J. Anal.Chem., 2019, 47(11): 1823-1831
許俊丽, 刘贝贝, 王玉龙, 李 盼, 杨 康, 吴 勤, 蒋 岚, 张皓然, 杨立飞, 张存政. 分析化学, 2019, 47(11): 1823-1831
15 Le T T, Chang P, Benton D J, McCauley J W, Iqbal M, Cass A E G. Anal. Chem., 2017, 89(12): 6781-6786
16 Fang C C, Chou C C, Yang Y Q, Wei-Kai T, Wang Y T, Chan Y H. Anal. Chem., 2018, 90(3): 2134-2140
17 Chen Y Q, Chen Q, Han M M, Liu J Y, Zhao P, He L D, Zhang Y, Niu Y M, Yang W J, Zhang L Y. Biosens. Bioelectron., 2016, 79: 430-434
18 Chen J H, Zhou S G, Wen J L. Anal. Chem., 2014, 86(6): 3108-3114
19 Yao Y, Guo W, Zhang J, Wu Y, Fu W, Liu T, Wu X, Wang H, Gong X, Liang X J, Chang J. ACS Appl. Mater. Interfaces, 2016, 8(35): 22963-22970
20 Wang C Y, Hou F, Ma Y C. Biosens. Bioelectron., 2015. 68: 156-162
21 You P Y, Li F C, Liu M H, Chan Y H. ACS Appl. Mater. Interfaces, 2019, 11(10): 9841-9849
22 Yang Y Q, Yang Y C, Liu M H, Chan Y H. Anal. Chem., 2020, 92(1): 1493-1501
23 Liu Q Y, Cheng S M, Chen R, Ke J M, Liu Y W, Li Y F, Feng W, Li F Y. ACS Appl. Mater. Interfaces, 2020, 12: 4358-4365
24 Parolo C, Escosura-Muiz A, Merkoi A. Biosens. Bioelectron., 2013, 40: 412-416
25 López-Marzo A M, Pons J, Blake D A, Merkoi A. Biosens. Bioelectron., 2013, 47: 190-198
26 Xu H, Chen J, Birrenkott J, Zhao J X J, Takalkar S, Baryeh K, Liu G D. Anal. Chem., 2014, 86(15): 7351-7359
27 Zhang H, She Z, Su H, Kerman K, Kraatz H B. Analyst, 2016, 141(21): 6080-6086
28 Moon H, Kumar D, Kim H, Sim C, Chang J H, Kim J M, Kim H, Lim D K. ACS Nano, 2015, 9(3): 2711-2719
29 Tebbe M, Maennel M, Fery A, Pazos-Perez N, Alvarez-Puebla R A. J. Phys. Chem. C, 2014, 118(48): 28095-28100
30 Rao W Y, Li Q, Wang Y Z, Li T, Wu L J. ACS Nano, 2015, 9(3): 2783-2791
Gold Nanorods-based Immunochromatographic Strip for Rapid
and Quantitative Detection of Prostate Specific Antigen
ZHANG Hua2, LI Qun1, LIU Gui-Feng*1
1(Department of Radiology, China-Japan Union Hospital of Jilin University, Changchun 130033, China)
2(State Key Laboratory of Electroanalytical Chemistry, Changchun Institute of Applied Chemistry,
Chinese Academy of Sciences, Changchun 130022, China)
Abstract A gold nanorod (GNR)-based immunochromatographic strip was developed for rapid and quantitative detection of prostate specific antigen (PSA). GNR was used as the labeled probe and coated with sodium polyacrylate. Then the anti-PSA monoclonal antibody (dAb) was immobilized on the surface of GNR through covalent attachment to form the GNR-dAb conjugates. The mouse anti-PSA monoclonal antibody and the goat anti-mouse IgG were sprayed onto the nitrocellulose membrane as test line and control line, respectively. The resultant GNR-dAb conjugates were introduced to construct the immunochromatographic strip for the quantitative detection of PSA by a sandwich method. The proposed GNR-based immunochromatographic strip exhibited good specificity, high stability and high sensitivity. The experimental results indicated that GNR-based immunochromatographic strip showed a good linear range from 0.1 ng/mL to 50 ng/mL with a limit of detection of 0.1 ng/mL, and the relative standard deviation was less than 10%. The established assay could be successfully applied for PSA detection in serum, which was beneficial for early diagnosis, treatment and prognosis of prostate cancer.
Keywords Gold nanorod; Immunochromatography; Prostate specific antigen; Quantitative detection
(Received 14 March 2020; accepted 20 May 2020)
This work was supported by the National Natural Science Foundation of China (No.61901438).
2020-03-14收稿; 2020-05-20接受
本文系國家自然科学基金项目(No. 61901438)资助
* E-mail: gfliu@jlu.edu.cn
