氨基-酰胺类智能超分子水凝胶农药载体制备
2020-08-19郝丽黄丹丹关梅周红军周新华
郝丽,黄丹丹,关梅,周红军,周新华
(1 仲恺农业工程学院化学化工学院,广东广州510225; 2 广东省普通高校农业绿色精细化学品重点实验室,广东广州510225)
引 言
刺激响应凝胶的智能性使其能够在受到外界刺激(如光、热、酸碱度、电力、磁场等)时产生自身物理化学性质、胶体性质和流变性质等方面的可逆变化[1-5]。由于这类凝胶的可调控性和多功能性,使其在生物医学、药物控释、化妆品、生物传感器和化工分离等领域有很好的应用前景[6-8]。超两亲分子是基于非共价键相互作用或动态共价键而构建的两亲分子,超两亲分子本身对环境的刺激作用较为敏感,所以将超两亲性材料和刺激响应凝胶结合成为研究热点,过去十多年间,文献报道了多种超分子凝胶,大多数是基于亲水多糖、吡啶、尿素、氨基酸、β-环糊精、蒽基衍生物、寡肽、类固醇、树枝状大分子等[9-14]。Cordier 等[15]设计并合成了超分子类橡胶体系,小分子通过氢键结合在一起形成分子链和交联键,通过将破裂的表面放在一起进行简单的修复,保证凝胶在破裂或切割后自行愈合。超分子凝胶具备动态可逆、自修复能力、形状记忆特性、易降解等独特的性质[16-18],使其在智能纳米载体领域具有应用潜力。但刺激响应凝胶的快速响应问题及凝胶中溶质的浓度较高,是研究新型刺激响应水凝胶亟待解决的问题。
传统农药在使用过程中利用率较低,且会带来生物危害及环境污染等问题,通过农药缓控释技术是有效途径之一[19-20]。而农药多为疏水性,如何以水为分散介质进行喷雾,降低有机溶剂的使用,是目前存在的挑战之一[21-22]。为了减少农药流失,提高疏水性农药的水分散性,本文使用绿色环保材料硬脂酸、柠檬酸、马来酸作为原料构筑超分子水凝胶,并且使用少量[5.8%(质量)]两亲性氨基-酰胺制备了快速刺激响应的超分子水凝胶,形成的超两亲水凝胶具有环境相容性且成本低廉[23-25],将此类超分子水凝胶用于农药装载和缓控释,可实现农药水基化分散,而其基于氨基-酰胺与多元羧酸的超分子自组装和解组装可以快速响应温度和pH,从而使农药在外界环境的刺激下实现智能装载和释放。
1 实验材料和方法
1.1 试剂与仪器
N,N'-二甲基-1,3-丙二胺(DMPDA,>98%),氟化 钠(NaF,98%),氧 化 铝(Al2O3,分 析 纯),硬 脂 酸(98%),柠檬酸(分析纯),顺丁烯二酸(马来酸,99%)购于上海麦克林生化科技有限公司。盐酸(HCl,37%),购于上海凌峰化学试剂有限公司。氢氧化钠(NaOH,97.0%),丙酮(分析纯),无水乙醇(分析纯)购于天津大茂化学试剂有限公司。农药阿维菌素(AVM,工业级,纯度为95%)购于河北威远生物化工有限公司。所有化学药品未经处理直接使用,实验过程中使用Milli-Q 净化装置处理。
紫外分光光度计,UV-2550 型,日本岛津公司;激光粒度仪/Zeta 电位分析仪,90PlusPALS 型,美国布鲁克海文仪器公司;傅里叶红外光谱分析仪,Spectrum-100型,美国铂金埃尔默有限公司;差式扫描量热仪,DSC-Q20 型,美国TA 仪器有限公司;扫描电子显微镜(SEM),EVO18,德国卡尔蔡司公司;500 MHz 液体核磁共振谱仪 ,Bruker AvanceIIIHD500 型,瑞士布鲁克仪器公司;旋转流变仪,Thermo HAAKE(LI),赛默飞世尔科技(中国)公司。
1.2 氨基-酰胺中间体的合成与表征
首先在三颈烧瓶中加入DMPDA,再加入硬脂酸,硬脂酸和DMPDA 加入的量按摩尔比2∶3。加入少量的NaF 作为催化剂,少量Al2O3作为脱水剂,在160℃的油浴锅进行缩合反应10 h,此反应在氮气保护下进行,避免不必要氧化副产物的生成。反应完成后,过量的DMPDA 使用冰丙酮洗涤除去,产物纯化三次,40℃下真空干燥24 h 得到N-[3-(二甲基氨基)丙基]硬脂酰胺(标记为A 或氨基-酰胺)[26-27]。氨基-酰胺的合成路线如图1(a)所示。
利用红外光谱仪分析氨基-酰胺的化学结构,采用溴化钾(KBr)压片法在4000~450 cm-1波长范围内扫描;采用差示扫描量热法(DSC)对氨基-酰胺的相行为进行测试和表征,以10℃/min 的速率在氮气氛围下由10℃加热到150℃,再由150℃冷却到10℃,进行加热-冷却-加热循环。
1.3 刺激响应超两亲分子体系的组装与表征
将氨基-酰胺(A)加入去离子水中,在水浴锅下加热溶解,趁热加入柠檬酸(标记为B),氨基-酰胺和柠檬酸的摩尔比为2∶1,而加入水后使得最终的氨基-酰胺浓度控制在5.8%~6.3%(质量)之间。在90℃恒温磁力搅拌器下,搅拌直至混合均匀呈透明黏稠状。之后放入马弗炉中,90℃保温2 h,组装得到具有温度响应溶胶-凝胶转换的超分子体系,标记为氨基-酰胺/柠檬酸或C。调控温度发现温度响应超分子处于70~80℃时转变为透明的水凝胶态,不具有流动性;当温度低于25℃或高于90℃时,透明的水凝胶态转变为乳白色且具有一定黏度的溶胶态。氨基-酰胺/柠檬酸超分子组装体的合成路线如图1(b)所示。
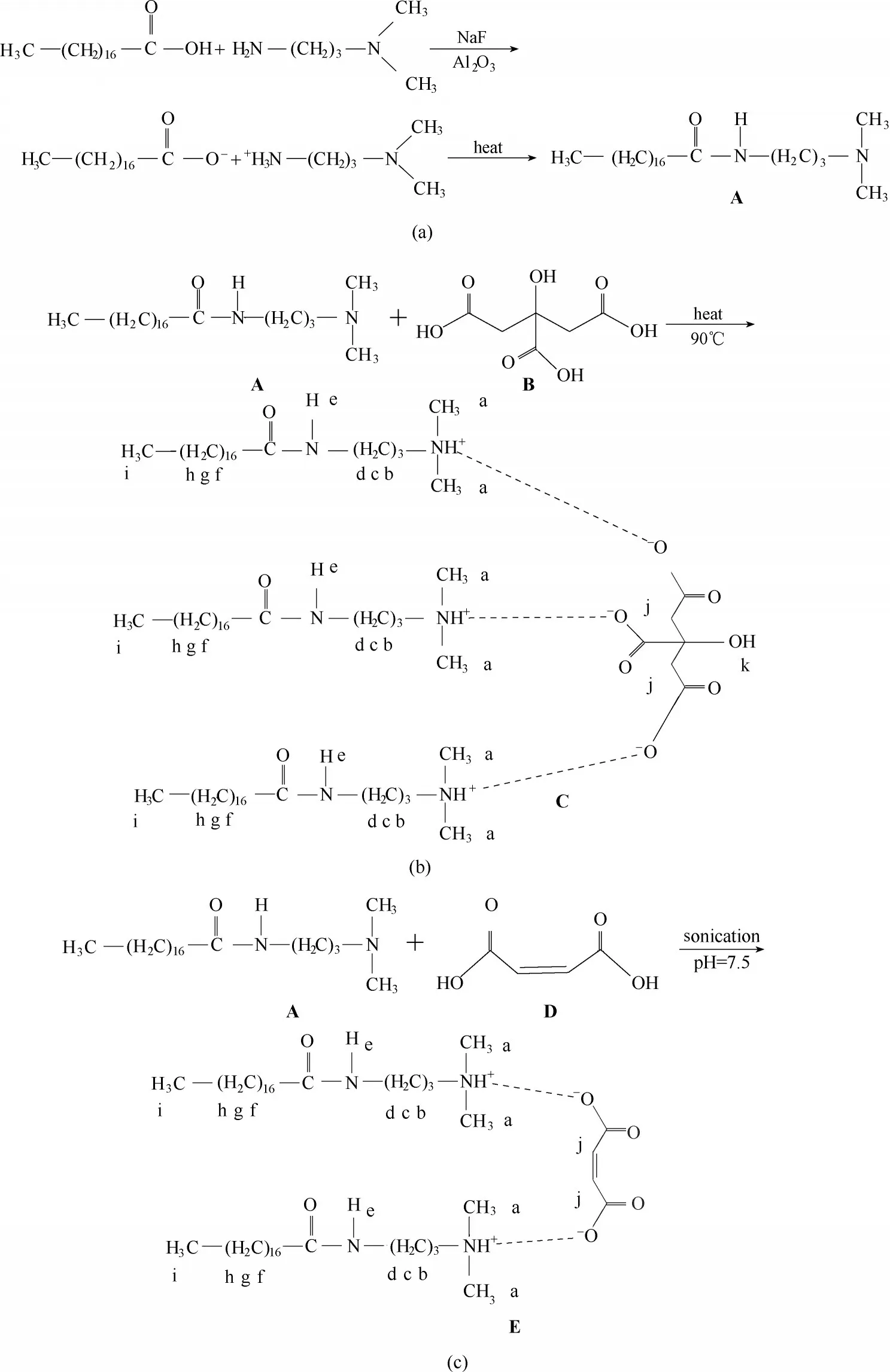
图1 合成路线:硬脂酸与DMPDA缩合反应生成氨基-酰胺(a);氨基-酰胺与柠檬酸组装形成温度响应超分子(b);氨基-酰胺与马来酸组成形成pH响应超分子(c)Fig.1 Synthesis routes:stearic acid and DMPDA condensation to form amino-amide(a);amino-amide and citric acid assemble to form temperature-responsive supramolecule(b);amino-amide and maleic acid to form pH-responsive supramolecule(c)
采用相似方法制备pH 响应凝胶,将氨基-酰胺(A)加入去离子水,使得氨基-酰胺质量浓度控制在5.8%(质量)。在70℃的恒温水浴锅里溶解,趁热加入一定比例的马来酸(D),用1 mol/L NaOH 调节pH为7.5,室温下超声、搅拌均匀,组装得到具有pH 响应溶胶-凝胶转换体系,标记为氨基-酰胺/马来酸或E,产品呈透明微黄色凝胶态。用1 mol/L HCl 及1 mol/L NaOH 调节pH,发现当pH<6 时,透明溶液析出未溶解的晶体;当pH 为6~7 时,超分子组装体为透明微黄溶胶态;当pH 为7~8 时,透明溶液转换为透明微黄色凝胶态;当pH>8 时,凝胶转换为乳白色的乳液。氨基-酰胺/马来酸超分子组装体的合成路线如图1(c)所示。
温度和pH 响应超分子凝胶样品冷冻干燥之后通过SEM 观察微观形貌和结构,样品置于导电胶上,并进行喷金处理;利用红外光谱仪分析冷冻干燥凝胶样品的化学结构,采用KBr 压片法在4000~450 cm-1波长范围内扫描;采用氢核磁共振光谱(1H NMR)对氨基-酰胺/柠檬酸和氨基-酰胺/马来酸超两亲分子进行化学特性分析,进一步确认化学反应的发生,采用500 MHz 液体核磁共振谱仪在室温下进行表征,使用氘代氯仿(CDCl3)作为溶剂;采用DSC对氨基-酰胺/柠檬酸和氨基-酰胺/马来酸超分子体系相行为进行测试和表征,以10℃/min 的速率在氮气氛围下由10℃加热到150℃,再由150℃冷却到10℃,进行加热-冷却-加热循环;采用锥板型旋转流变仪对刺激响应超分子体系在不同温度下进行黏度测试,剪切速率固定在10 s-1,间距设置为0.05 mm,温度范围控制在30~80℃;动态激光衍射法(DLS)用来表征样品的粒径及粒度分布,散射角为90°,为保证数据的可靠性,每次测量至少重复三次。
1.4 基于氨基-酰胺超分子组装载药胶束的制备及表征
以阿维菌素(AVM)为模型农药,采用浸渍法制备载药胶束。首先,在100 ml 无水乙醇中加入1.0g AVM,在超声作用下得到浓度为10 mg/ml的AVM溶液。将AVM 乙醇溶液和超分子体系(25℃的温度响应体系或pH=6 的pH 响应体系)按体积比1∶5 超声、磁力搅拌混合均匀,疏水性农药阿维菌素在疏水作用下进入胶束内部,得到氨基-酰胺/柠檬酸超分子载药胶束和氨基-酰胺/马来酸超分子载药胶束。采用紫外-可见光谱分别在AVM 的特征波长245 nm 下测定吸光度,并根据标准曲线y=0.0378x-0.0059(标准方差R2=0.999)计算载药胶束中阿维菌素的浓度,其中y 为紫外吸光度,x 为浓度;根据式(1)计算出包封率(EE);采用激光粒度仪测定载药胶束粒径。

式中,mtotal是体系中农药总质量,mg;mfree是体系中未包封的农药质量,mg;EE是包封率,%。
取20 ml 上述载药胶束加入截留分子量为5000的透析袋中,置于200 ml 40%(质量)乙醇溶液的锥形瓶中,于25℃恒温振荡,每隔一段时间,取出1 ml透析液,同时补充1 ml 新鲜的40%(质量)乙醇溶液。采用紫外-可见光谱法测定透析液中阿维菌素在波长245 nm 的吸光度,根据标准曲线y=0.0329x-0.0026(R2=0.999)计算阿维菌素浓度,由式(2)计算累积释放率(Ri),得到载药胶束的农药释放曲线。考察环境因素对温度响应胶束和pH 响应胶束缓释率的影响,分别调节温度为30℃、40℃,pH=5、pH=7、pH=9,比较缓释效果。
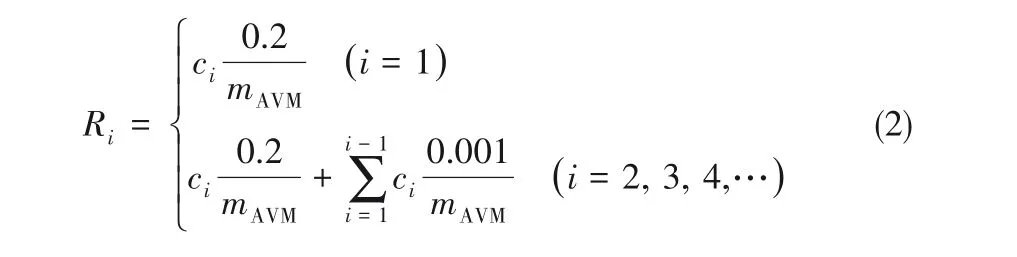
式中,ci是不同时间AVM 的质量浓度,mg/L;mAVM是锥形瓶中AVM总质量,mg。
2 实验结果与讨论
2.1 刺激响应超分子组装溶胶-凝胶转换及其流变性
温度响应超分子体系的刺激响应行为如图2(a)所示,氨基-酰胺与柠檬酸形成的超分子,其在室温状态(25℃)为乳浊溶胶态(亚稳态),在加热到75℃以上发生相变,转换成透明黏稠状凝胶态,水凝胶在容器翻转时能够支撑自身重力,保持凝胶状,而在25℃时,会由重力驱动溶胶自由流动,通过加热和冷却循环可诱导凝胶-溶胶之间的多次可逆转换,这是因为温度响应超分子体系组装形成的网络结构是由分子间的氢键相互作用形成的,并非共价键的结果,加热促进了氨基-酰胺与柠檬酸羧基的氢键作用。温度响应超两亲分子的pH 约为5.5。氨基-酰胺与柠檬酸组装的超分子在30~80℃范围内的黏度变化如图3 所示,在剪切速率一定(γ=10 s-1)的情况下,黏度随着温度呈现先升高后下降的趋势,在76℃黏度达到最大值4268 mPa·s,呈现稳定的水凝胶状态,在30℃黏度仅为58 mPa·s,为溶胶流动状态,当温度高于76℃时,氨基-酰胺与柠檬酸超分子体系因为温度过高破坏了超分子凝胶体系的三维网状结构,导致黏度逐渐降低。因此,可以确定临界凝胶化温度为76℃,高于文献中大多数热敏凝胶的临界凝胶温度。

图2 氨基-酰胺/柠檬酸温度响应超分子水凝胶溶胶-凝胶转变(a);氨基-酰胺/马来酸pH响应超分子水凝胶溶胶-凝胶转变(b)Fig.2 Amino-amide/citric acid temperature-responsive supramolecular hydrogel sol-gel transition (a);amino-amide/maleic acid pHresponsive supramolecular hydrogel sol-gel transition(b)
pH 响应超分子体系的刺激响应行为如图2(b)所示,氨基-酰胺与马来酸形成的超分子在pH 为7~8 之间,出现明显的相转变过程,随着pH 升高,逐渐出现凝胶化,且调控pH,可以实现溶胶-凝胶的多次可逆循环转化,在酸性条件下超分子出现絮状物,体系不能形成凝胶,可能原因是马来酸在酸性条件下质子化,氨基-酰胺中的—NH(CH3)2+以离子形式存在,两者之间形成分子间氢键的可能性降低,体系不能形成水凝胶,说明分子间氢键是形成水凝胶结构的关键作用力。pH=7.5 的氨基-酰胺与马来酸超分子凝胶态在温度30~80℃的黏度变化如图3 所示,剪切速率固定为10 s-1,30℃时超分子呈凝胶态,黏度较高(2101 mPa·s),在40~60℃区间内,黏度变化呈现一个山峰的形状,在46.5℃时黏度最大(3393 mPa·s),即促进了马来酸与氨基-酰胺的氢键作用,更有利于凝胶三维网状结构的增强。当温度继续升高,黏度开始下降,破坏了氢键作用力,开始出现溶胀的状态,当温度高于67.3℃时,基本呈现溶胶状态,由于锥板流变仪的测试范围限制,导致低黏度时曲线波动较大。结果表明,氨基-酰胺与马来酸形成的pH 响应超分子在pH=7.5时同时具有温度响应性,可进行双重刺激响应的凝胶-溶胶转换行为,极大地拓展了水凝胶的应用范围。
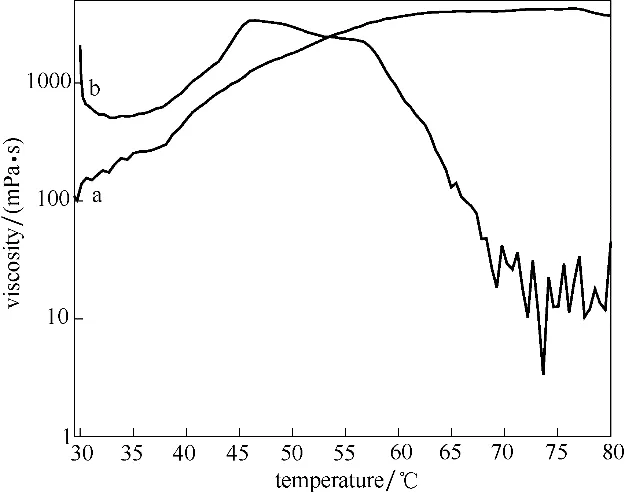
图3 氨基-酰胺/柠檬酸(a)和氨基-酰胺/马来酸(b)超分子水凝胶黏度随温度变化曲线Fig.3 Viscosity of amino-amide/citric acid(a)and aminoamide/maleic acid(b)supramolecular hydrogels vs.temperature
大多数流体的黏度随着温度升高而降低,而本文中刺激响应超分子体系具备加热诱导凝胶化的能力,这是区别于常见流体的重要特点,且在较低浓度[5.8%(质量)]下即可表现刺激响应的溶胶-凝胶转换。基于氨基-酰胺与多元羧酸之间形成的氢键数量及长度的不同,供体和受体通过氢键的相互作用促成凝胶的聚集,促进了超分子的自组装过程,长链烷基链增强了凝胶分子间的缠绕,温度变化或pH变化过程中多组氢键的形成及羧基去质子化、氨基重新质子化的高度可逆性,而导致其自由折叠和展开,使其能够响应温度和pH 进行自组装和解组装。
2.2 激响应超分子水凝胶的相行为及热性能分析
为了确定刺激响应超分子凝胶的相转变过程,将氨基-酰胺、冷冻干燥后的氨基-酰胺与柠檬酸超分子凝胶以及冻干的氨基-酰胺与马来酸超分子凝胶,进行DSC 检测,如图4 所示,三者均可在10~150℃之间形成加热-冷却循环,氨基-酰胺加热过程中,在55.7℃出现一个主链分解吸热峰,而在冷却过程中,在46.6℃出现一个放热峰,在第二次冷却过程中,同样有一个放热峰,相转变温度与第一次相近,说明氨基-酰胺本身具有热可逆性。当氨基-酰胺与柠檬酸形成超分子后,由10℃加热至150℃,相变温度变为47.7℃,同样,在冷却过程中,相变温度降为39.0℃,由于柠檬酸的加入,酰胺基团上叔胺与柠檬酸的羧基结合,形成凝胶中的氢键,超分子交联作用力较弱,使得氨基-酰胺更容易在较低的温度下发生相变,导致热稳定性降低。而氨基-酰胺与马来酸形成的超分子凝胶在加热和冷却循环中,分别出现两个吸热峰和两个放热峰,加热过程中吸热峰分别在43.6℃和51.1℃,即发生了两次主链分解,分别为胶束形成时的吸热峰和凝胶形成时的吸热峰。冷却过程中的相变温度降为39.7℃和44.6℃,且两次冷却的相变温度基本一致,说明超分子凝胶的循环可逆性及其稳定的相转变过程。
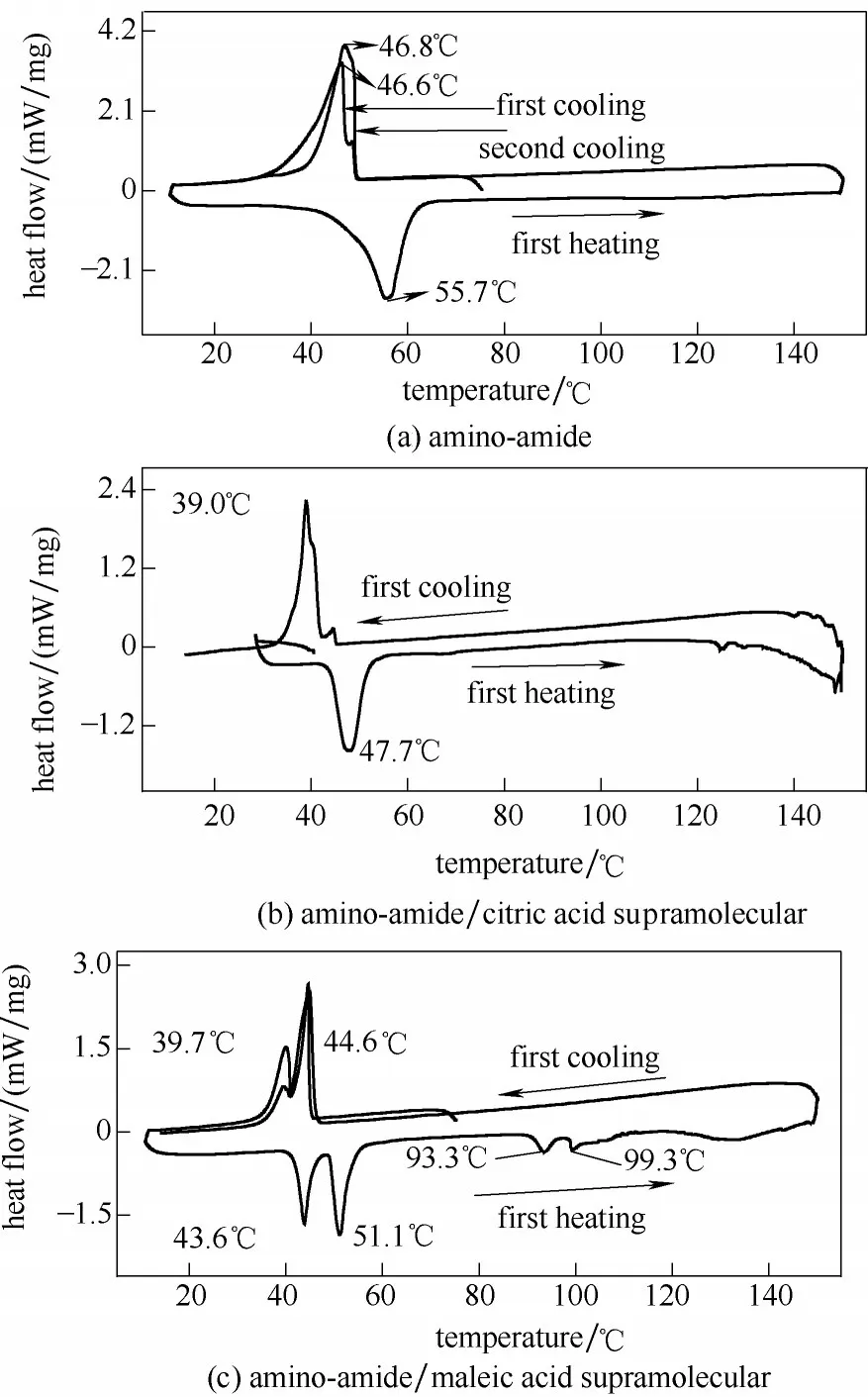
图4 氨基-酰胺及其与柠檬酸和马来酸的超分子冻干凝胶的DSC谱图Fig.4 DSC curves of amino-amide and two supramolecular lyophilized gels with citric acid and maleic acid
2.3 刺激响应超分子体系化学作用谱学分析
氨基-酰胺及其与柠檬酸和马来酸形成的超分子冻干凝胶的红外图谱见图5,考察氨基-酰胺和超分子体系之间的差异与分子间作用力。可以看出,氨基-酰胺中的叔胺—CH2—N(CH3)2在1041 cm-1出现较强伸缩振动峰,仲酰胺—CH2—CONH—CH2—由于N—H 面内弯曲振动与C—N 伸缩振动耦合,分裂为两个谱带,1267 和1232 cm-1主要是C—N 伸缩振动形成的酰胺Ⅱ吸收带,1544 cm-1主要是N—H面内变角振动,2921 和2851cm-1为—CH3和—CH2—的伸缩振动,—CH3与叔胺的N 原子相连,伸缩振动频率降低至2814 和2762 cm-1,1472 cm-1为—CH2—的变角振动频率,酰胺羰基C O 伸缩振动位于1637 cm-1,3314 cm-1为仲酰胺—NH 的伸缩振动峰,吸收强度较高,形成一个尖峰,说明氨基-酰胺成功合成。
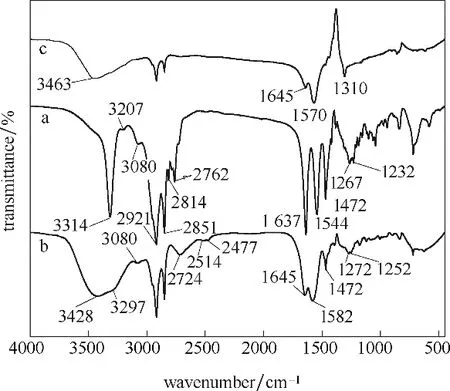
图5 氨基-酰胺及其与柠檬酸和马来酸的超分子冻干凝胶的红外光谱图Fig.5 FTIR spectra of amino-amide and its supramolecular lyophilized gels with citric acid and maleic acid a—amino-amide;b—amino-amide/citric acid;c—amino-amide/maleicacid
加入柠檬酸和马来酸后,由于羧酸中O—H 的存在,氨基-酰胺原本位于3314 cm-1的N—H尖峰分别被3428 和3463 cm-1处的宽峰合并。加入柠檬酸形成超分子后,柠檬酸生成羧酸根—COO-基团,伸缩振动频率由氨基-酰胺的1637 cm-1增加至1645 cm-1,与加入马来酸形成的超分子的振动峰位置一致。同时,加入柠檬酸后,氨基-酰胺位于2814 和2762 cm-1处的振动峰变化为2724 cm-1归属于NH+伸缩振动谱带,加入马来酸后,也在2724 cm-1形成微弱的振动峰,说明柠檬酸或马来酸的羧酸根给出质子,叔胺的N原子得到质子,通过质子化,形成氢键,而并非简单的物理混合,且氢键的长度和强度取决于与温度的线性关系和二次方关系[28-29]。与柠檬酸形成的超分子凝胶在76℃形成,升高温度也会将更多和更强的氢键引入超分子。红外分析表明氢键和质子化在超分子的温度和pH 响应凝胶化过程中具有重要作用。
图6(a)为氨基-酰胺/柠檬酸超分子组装体的1H NMR 谱图,不同基团质子标注在图1(b)分子结构式中,其中化学位移δ=7.24 的峰值与酰胺基团(e)的质子有关,化学位移δ=7.17 的峰值对应超分子组装后柠檬酸中羟基(k)的质子,化学位移δ=2.58 对应与叔胺N 相连的甲基基团(a)的质子,δ=0.86 对应长碳链末端的甲基基团(i),为三重峰,δ=3.32 为与酰胺的N原子相连的亚甲基(d)的质子,δ=2.80 为质子化的叔胺N 原子相连的亚甲基(b)的质子,δ=2.74 为与柠檬酸形成超分子后柠檬酸中亚甲基(j)的质子,位于季胺与羰基之间,同时柠檬酸的三个羧基均与氨基-酰胺通过氢键作用形成超分子,因此1H NMR 谱图中未出现羧基的质子。图6(b)为氨基-酰胺/马来酸超分子的1H NMR 谱图,不同基团质子标注在图1(c)分子结构式中,δ=6.27 出现烯氢(j),且未出现羧基的质子,说明马来酸成功的与氨基-酰胺通过氢键作用形成超分子,与图6(a)相比,δ=7.17、δ=2.74 的峰值未出现,且与叔胺N 相连的甲基基团(a)的质子化学位移向高场偏移至δ=2.47,说明氨基-酰胺与柠檬酸形成的氢键作用更强,减少了对活泼氢的屏蔽作用,使活泼氢的共振吸收移向低场,氨基-酰胺与柠檬酸在此处的化学位移较大,如前所述,氢键的形成受温度影响,氨基-酰胺/柠檬酸超分子合成反应温度更高,因此形成的氢键作用更强。
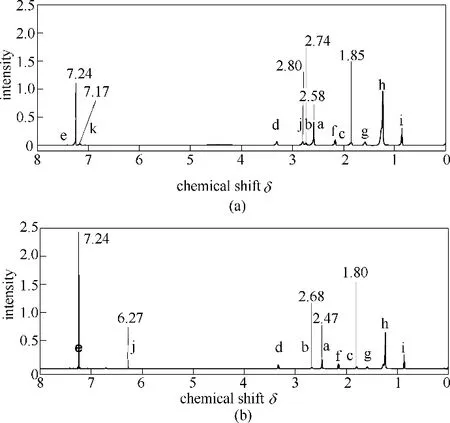
图6 氨基-酰胺/柠檬酸超分子(a)及氨基-酰胺/马来酸超分子(b)的1H NMR谱图Fig.6 1H NMR spectra of amino-amide/citric acid supramolecular(a)and amino-amide/maleic acid supramolecular(b)
2.4 刺激响应超分子水凝胶的形貌
经由冷冻干燥所得氨基-酰胺/柠檬酸和氨基-酰胺/马来酸超分子水凝胶样品的横断面形态SEM图见图7(a)和(b),可以看出在冻干凝胶中氨基-酰胺与柠檬酸或马来酸的相互作用形成三维网状交联结构。由右上角的放大内插图发现,氨基-酰胺/柠檬酸冻干凝胶呈现类似毛线球缠绕结构,大小在8~10 μm之间,众多毛线球相互交联形成图7(a)的多孔结构;而氨基-酰胺/马来酸冻干凝胶呈现柱状的囊泡结构,长度在9~10 μm左右,囊泡相互堆叠形成图7(b)的孔道结构。无论是球形缠绕还是柱状囊泡的超分子结构,其进一步多层次自组装形成类似珊瑚的多孔网状结构,将大量的水溶剂禁锢住,形成了超分子水凝胶,独特的结构可为农药分子的装载提供更大的空间。由于氨基-酰胺具有两亲性,与柠檬酸和马来酸形成的两亲性超分子具有刺激响应性,在水溶液中呈溶胶状态时,通过DLS 测定氨基-酰胺/柠檬酸和氨基-酰胺/马来酸胶束的粒径分布见图7(c),可见氨基-酰胺/马来酸溶胶胶束粒径均一,约为250 nm,而氨基-酰胺/柠檬酸溶胶胶束分布较广,分别出现11、98 和1753 nm 的粒子,这与图2所述氨基-酰胺/马来酸溶胶相对澄清,而氨基-酰胺/柠檬酸溶胶态呈现大量絮状物一致。
2.5 刺激响应超分子水凝胶对农药的装载和缓控释
氨基-酰胺/柠檬酸和氨基-酰胺/马来酸超分子装载农药阿维菌素后通过DLS 测得的胶束粒径分布如图7(d)所示,载药后氨基-酰胺/马来酸胶束粒径增大至453 nm,说明在静电作用及疏水性作用力的驱动下,带负电荷的疏水性农药阿维菌素负载至氨基-酰胺的长碳链疏水端及柱状囊泡内部,通过溶胀作用导致胶束粒径增大。载药后氨基-酰胺/柠檬酸胶束粒径分布集中在564 nm,说明阿维菌素通过电荷作用及疏水作用进入球状囊泡内部,有利于促进溶胶中絮状物的聚集。氨基-酰胺/柠檬酸和氨基-酰胺/马来酸超分子装载农药后的凝胶态通过冻干,在扫描电镜下观察的形貌分别如图8(a)和(b)所示,与载药前的凝胶态形貌[图7(a)、(b)]进行对比,发现载药后凝胶出现溶胀,体积变大,但仍分别维持球状及柱状结构,氨基-酰胺/柠檬酸载药凝胶表面存在缝隙,提供农药分子进出的通道,而氨基-酰胺/马来酸载药凝胶缠绕呈链条结构,链条形成的缝隙为农药分子提供进出的场所,相比而言,球状结构更致密,更有利于保护农药分子,而链条状结构促使农药分子更快释放。
氨基-酰胺/柠檬酸和氨基-酰胺/马来酸超分子对阿维菌素的包封率见表1,可以看出氨基-酰胺/柠檬酸超分子的包封率略高于氨基-酰胺/马来酸,可能与其结构有关,顺丁烯二酸本身是一个顺式结构且结构非常对称的质子酸,且顺丁烯二酸所含有的羧基以及双键使得形成的pH 响应超分子组装体是一个对称性较好的物质,柠檬酸本身是一个结构不对称的质子酸,它同时含有羧基、羟基,结构较氨基-酰胺/马来酸超分子更复杂,因此氨基-酰胺/柠檬酸胶束可组装形成更多更致密的孔道结构,有利于吸附并封装更多的农药分子,且柠檬酸为三元酸,相当于三只手与氨基-酰胺形成更多的空间,较二元酸马来酸相比,可以容纳更多的农药分子。氨基-酰胺/柠檬酸和氨基-酰胺/马来酸载药凝胶静置三天后,再次测量包封率发现氨基-酰胺/马来酸载药凝胶对阿维菌素的包封率显著下降,一方面由于氨基-酰胺/马来酸凝胶的孔道空间过大,促使农药分子更快逸出,另一方面由于阿维菌素的不稳定性,易于光解[30]。同时,基于氨基-酰胺类超分子的载药胶束以水为分散介质,减少了使用有机溶剂作为农药分散剂的危害。装载阿维菌素的氨基-酰胺/柠檬酸超分子和氨基-酰胺/马来酸超分子分别在40%(质量)乙醇溶液透析的缓释曲线如图9 所示。在图9(a)中,氨基-酰胺/柠檬酸载药超分子在不同温度和pH 透析液环境下,表现出缓慢释放的效果,其中在30℃、pH=9的碱性条件下,农药阿维菌素释放得最慢,因为碱性条件下柠檬酸羧基的去质子化程度升高,胶束表面负电荷增多,载药胶束体系更稳定,且胶束内部带负电的阿维菌素受表层负电荷排斥,逸出难度增大,导致累积释放率变慢。由图9(b)可以看出氨基-酰胺/马来酸载药超分子在pH 为5 和9 的酸性和碱性条件下均没有缓释趋势,释放速率极快,主要是由于电荷作用破坏了凝胶结构,同样升高温度,释放速率也较快,由于温度升高使胶束溶胀,导致农药更容易逃逸,在pH 为中性、温度为30℃的环境,超分子为凝胶态,氨基-酰胺/马来酸载药超分子表现出一定的缓释趋势,但释放速率远远快于氨基-酰胺/柠檬酸载药超分子。对比发现,三元羧酸与氨基-酰胺形成的超分子与二元羧酸相比,体系更加稳定,从结构和电荷的角度更有利于实现农药的刺激响应缓释。
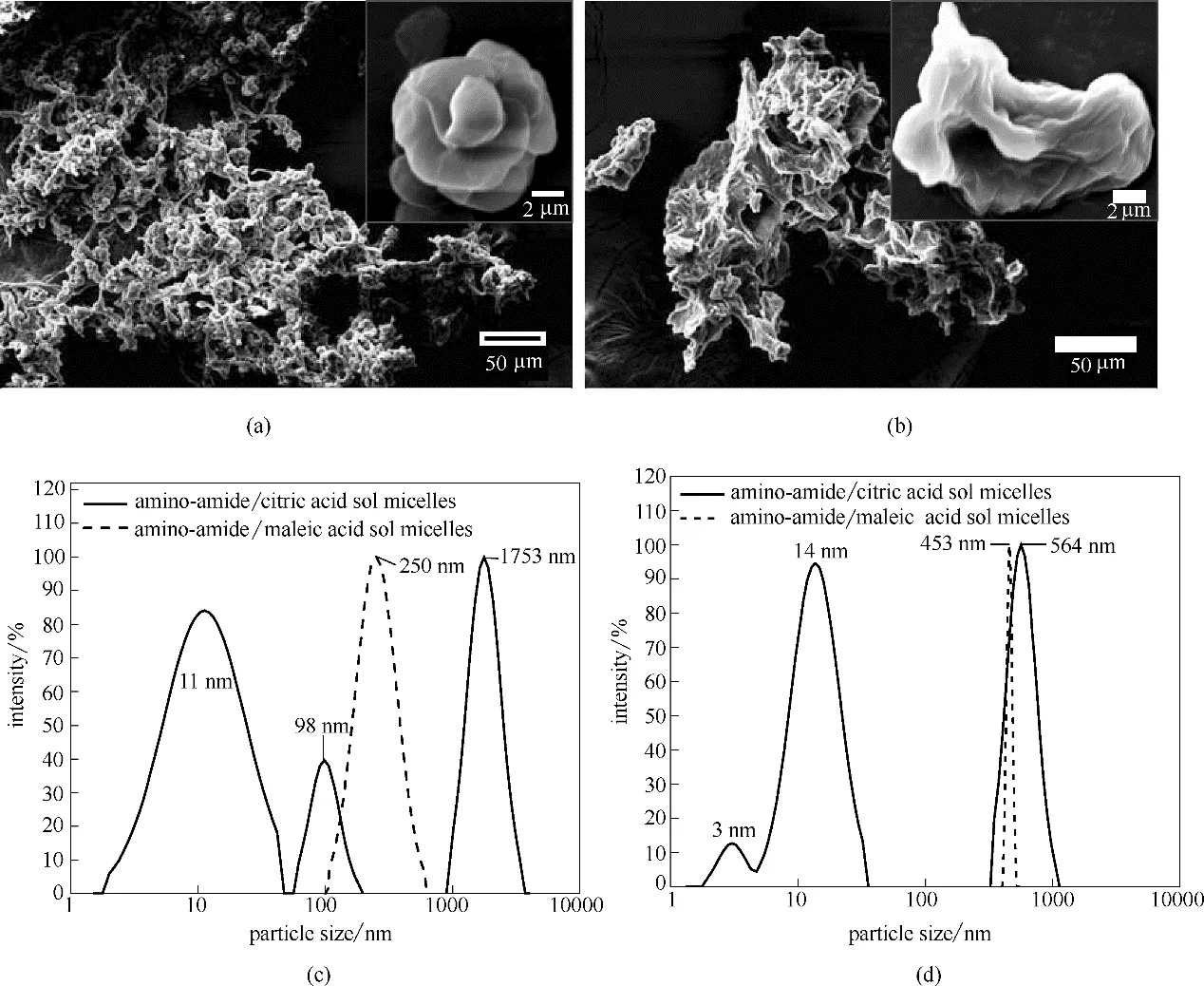
图7 氨基-酰胺与柠檬酸(a)和马来酸(b)的超分子冻干凝胶的SEM图像;氨基-酰胺/柠檬酸和氨基-酰胺/马来酸溶胶胶束的粒径分布(c);氨基-酰胺/柠檬酸和氨基-酰胺/马来酸装载农药阿维菌素后胶束的粒径分布(d)Fig.7 SEM images of amino-amide/citric acid supramolecular lyophilized gel(a),amino-amide/maleic acid supramolecular lyophilized gel(b);particle size distribution of amino-amide/citric acid and amino-amide/maleic acid sol micelles (c);micelle size distribution of amino-amide/citric acid and amino-amide/maleic acid loaded with avermectin (d)

图8 氨基-酰胺与柠檬酸(a)和马来酸(b)超分子装载阿维菌素后的冻干凝胶的SEM图像Fig.8 SEM images of amino-amide/citric acid supramolecular lyophilized gel(a)and amino-amide/maleic acid supramolecular lyophilized gel(b)after avermectin loading

表1 氨基-酰胺/柠檬酸和氨基-酰胺/马来酸超分子对农药阿维菌素的包封率及稳定性Table 1 Encapsulation efficiency and stability of avermectin by amino-amide/citric acid and amino-amide/maleic acid supramolecules
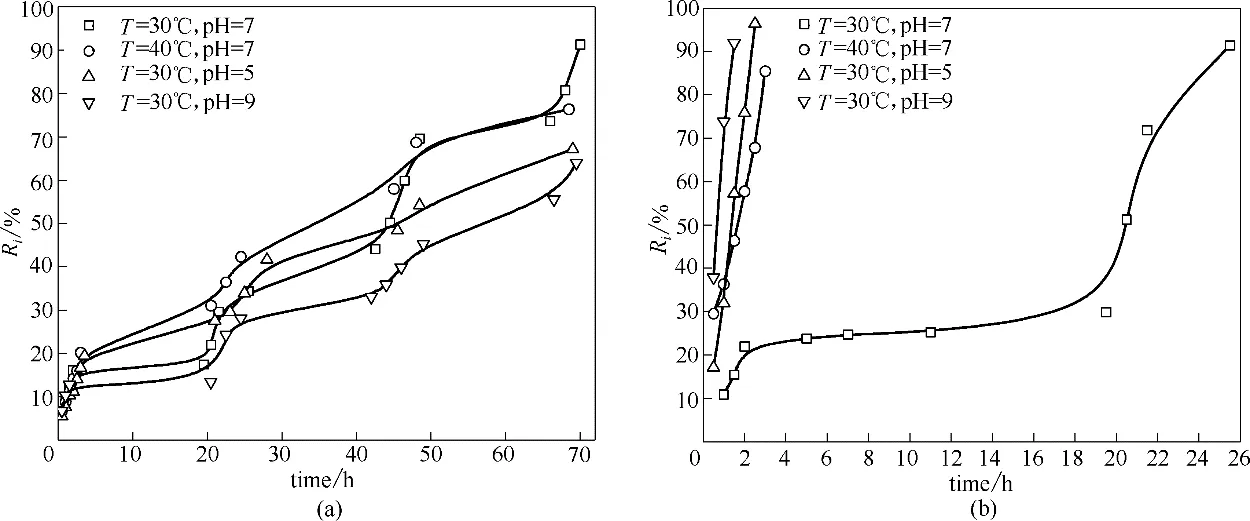
图9 阿维菌素@氨基-酰胺/柠檬酸载药超分子(a)和阿维菌素@氨基-酰胺/马来酸载药超分子(b)在不同温度、pH环境下的缓释曲线Fig.9 Sustained-release curves of avermectin loaded amino-amide/citric acid supramoleculars (a)and avermectin loaded aminoamide/maleic acid supramolecular(b)under different temperatures and pH environments
3 结 论
本文通过长链氨基-酰胺与多元羧酸的超分子层层自组装构建了一类两亲性刺激响应水凝胶,由长碳链疏水性核心和多元羧酸的亲水性外层组成,氨基-酰胺浓度控制在5.8%(质量)可形成稳定的超分子凝胶,通过DSC、FTIR、1H NMR、SEM、DLS、黏度等表征手段对比了氨基-酰胺与三元酸柠檬酸形成的温度响应超分子和与二元酸马来酸形成的pH响应超分子的性能和结构,发现氨基-酰胺/柠檬酸超分子具有溶胶-凝胶可调控的热响应相行为及可逆转换,临界凝胶化温度为76℃,高于大多数文献报道的临界凝胶化温度,高于76℃为凝胶态,氨基-酰胺/马来酸超分子具有pH 诱导的溶胶-凝胶的可逆转换,临界pH=7,在pH 为7~8 范围内超分子呈现凝胶态。氨基-酰胺与多元酸通过质子化及去质子化形成氢键,与柠檬酸形成的超分子凝胶在较高温度下形成,与三元酸和二元酸分别形成球形和柱状囊泡,进一步进行界面层层自组装形成稳定的缠绕交联三维网状结构,且氨基-酰胺/柠檬酸凝胶的孔道更多、更致密,为农药的装载提供了空间。氨基-酰胺/柠檬酸超分子对农药的包封率略高于氨基-酰胺/马来酸,马来酸是顺式且结构对称的质子酸,氨基-酰胺与马来酸形成的超分子组装体是一个对称性较好的物质,柠檬酸结构不对称,且柠檬酸为三元酸,相当于三只手与氨基-酰胺形成更多的空间,可以容纳更多的农药分子,三元羧酸与氨基-酰胺形成的超分子与二元羧酸相比,从结构和电荷的角度更有利于实现农药的刺激响应缓释效果。
符 号 说 明
A——紫外吸光度
C——农药浓度,mg/L
EE——包封率,%
mtotal,mfree,mAVM——分别为农药总质量,体系中未包封的农药质量和锥形瓶中农药质量,mg
Ri——累积释放率,%
T——温度,℃
