持续气道正压通气联合氨溴索治疗新生儿呼吸窘迫综合征的疗效分析
2020-08-17李建梁柯小莲陈东昀
李建梁, 柯小莲, 陈东昀
(江西宁都县人民医院, 江西 赣州, 342800)
新生儿呼吸窘迫综合征(NRDS)是常见的新生儿疾病, 多发于早产儿。临床检查NRDS, 病理以肺泡壁上附有嗜伊红透明膜和肺不张为特征,因此也称为肺透明膜疾病[1]。NRDS因为患儿肺表面缺乏活性物质、肺组织发育不成熟以致呼吸窘迫,临床表现为进行性呼吸困难。新生儿出生后6小时内出现呼吸窘迫,若未及时治疗会严重危害患儿生命安全。NRDS患儿死亡率高达30%, 病死率中早产儿占比可达约60%[2]。采用气管插管及机械通气可改善患儿呼吸困难的情况,但对操作者的能力有较高要求,且该治疗方法会对患儿产生较大创伤,发生肺气漏和肺部感染等并发症。持续气道正压通气(CPAP)操作简便,并发症发生率低,可调节氧浓度。氨溴索能够刺激肺泡Ⅱ型上皮细胞内细胞器的发育,促进肺泡表面活性物质的分泌与合成,因此氨溴索广泛应用于治疗新生儿呼吸窘迫综合征[3]。本研究旨在探讨CPAP联合氨溴索治疗新生儿呼吸窘迫综合征的安全性和有效性,现报告如下。
1 资料和方法
1.1 一般资料
选取2016年1月—2020年1月期间本院收治的新生儿呼吸窘迫综合征患儿60例。按照不同的临床治疗方法,将60例患儿随机分为观察组(n=30)和对照组(n=30), 观察组男17例,女13例; 胎龄28~36周,平均(32.21±3.05)周; 体重1.42~2.61 kg, 平均(1.74±0.43) kg。对照组男16例,女14例; 胎龄28~35周,平均(32.18±3.07)周; 体质量1.52~2.73 kg, 平均(1.85±0.34) kg。
纳入标准: ① 符合新生儿呼吸窘迫综合征临床诊断标准,有导致肺泡表面活性物质缺乏的因素、急性起病、呼吸窘迫、氧合指数[pa(O2)/FiO2]低于200 mmHg、肺动脉楔压低于18 mmHg、X线检查有特征性表现; ② 签署知情同意书者; ③ 获得医学伦理委员会批准者。排除标准: ① 不符合新生儿呼吸窘迫综合征临床诊断标准者; ② 资料不完整者; ③ 先天性肺部畸形或重要器质功能异常者。2组患儿基本资料比较差异无统计学意义(P>0.05), 本研究已经获得医学伦理委员会批准。
1.2 方法
所有患儿入院后均给予保温、生命体征监护、呼吸道管理、抗感染等治疗,保证液体和营养供应,稳定患儿内环境,改善机体微循环和营养状况。
对照组患儿给予CPAP治疗: 压力设置为3~8 cmH2O, 一般≤8~10 cmH2O, 气体流量最低为患儿3倍每分通气量或5 L/分,吸入气中的氧浓度分数(FiO2)则根据患儿血氧饱和度(SaO2)进行设置和调整。观察组患儿给予CPAP通气联合氨溴索治疗,患儿静脉注射氨溴索,给药间隔1次/6 h, 一次注射7.5 mg/kg, 在呼吸道症状缓解后减少剂量,治疗3~5 d。连接(CPAP)呼吸机: 压力设置为3~8 cmH2O, 一般≤8~10 cmH2O, 气体流量最低为患儿3倍每分通气量或5L/分, FiO2则根据患儿SaO2进行设置和调整。患儿临床症状缓解后,呼气末正压降低到2 cmH2O, 氧浓度降低为0.25, 撤去CPAP呼吸机。
1.3 观察指标
疗效评估标准: 患儿经过治疗后,临床症状和体征得到显著改善为有效; 患儿临床症状和体征无显著变化为无效; 患儿临床症状和体征均消失为治愈。计算总有效率公式=(治愈+有效)/样本量×100%, 比较2组患儿氧疗指数、氧疗时间和住院情况。
1.4 统计学方法
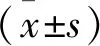
2 结 果
2.1 2组临床治疗总有效率比较
观察组临床治疗总有效率为96.67%, 显著高于对照组73.33%(P<0.05), 见表1。

表1 2组临床治疗总有效率比较
2.2 2组氧合指数、氧疗时间和住院情况比较
观察组治疗24、48 h后的OI均显著高于对照组(P<0.05), 观察组氧疗时间和住院时间均显著短于对照组(P<0.05), 观察组住院费用显著低于对照组(P<0.05), 见表2。

表2 2组氧合指数、氧疗时间和住院情况比较
3 讨 论
NRDS病因复杂,高危因素包括剖宫产、母体糖尿病、围产期窒息和早产等。NRDS是由于肺泡表面缺乏活性物质,导致呼气时肺泡塌陷,抑制功能残气量增加,发生进行性肺不张,严重者出现呼吸衰竭[4]。研究[5]表明,导致新生儿及早产儿死亡的关键因素为NRDS。CPAP依靠患儿自主呼吸,出生体质量较轻的患儿呼吸中枢发育不完善,自主呼吸浅表、不规则,呼吸肌易疲劳,易并发频繁的呼吸暂停, CPAP对体质量较重的患儿效果较好[6-7]。CPAP使呼吸窘迫综合征患儿在呼气末维持肺泡正压,避免肺泡塌陷,增加肺泡面积,维持功能残气量,减少肺内分流,改善血流、通气比例和肺顺应性及改善氧合,减少吸氧量,增加肺表面活性物质的释放,降低视网膜病变和支气管肺发育不良的发生率[8-10]。NRDS发病率较高,严重影响患儿预后,因此临床及时针对性制订合理的治疗方案十分重要。
氨溴索是具有多种生物效应的新一代黏液溶解剂,能增加呼吸道黏膜浆液腺的分泌,减少黏液腺分泌,从而降低痰液黏度,促进肺表面活性物质的分泌,增加支气管纤毛运动使痰液易于咳出,进而有效改善呼吸困难。氨溴索可刺激肺泡Ⅱ型上皮细胞内细胞器的发育,促进肺泡表面活性物质的分泌与合成,并对肺组织有高度的特异性,进而促进肺成熟,防止肺泡萎缩[11]。研究[12-14]表明,氨溴索可通过增强活性蛋白基因的表达,促进表面活性蛋白的合成,从而使内源性肺表面活性物质迅速增加,降低肺表面张力,增加肺通气量、顺应性和潮气量。两者联合治疗可促进患儿肺氧合。本研究显示,实施CPAP联合氨溴索治疗NRDS疗效显著,观察组总有效率为96.67%, 显著高于对照组73.33%(P<0.05), 提示两者联合治疗效果显著。观察组治疗24 h和治疗48 h后的OI均显著高于对照组(P<0.05), 观察组氧疗时间和住院时间均显著短于对照组(P<0.05), 观察组住院费用显著低于对照组(P<0.05)。表明CPAP联合氨溴索治疗NRDS患儿,可有效改善患儿的氧合指数,缩短患儿氧疗时间和住院时间,降低住院费用。CPAP联合氨溴索治疗NRDS可有效减少患儿因缺血、缺氧造成的肺损伤,保护患儿细胞膜,改善患儿呼吸困难症状。有研究[15]表明,氨溴索可效改善患儿的呼吸窘迫症状,并能弥散在细胞膜脂质双层结构中,以起到保护细胞膜的作用。
综上所述, CPAP联合氨溴索治疗NRDS比CPAP治疗效果更好,可显著缩短氧疗和住院时间,提高临床治疗效果,减轻患儿家庭经济负担。
