化痰清眩汤联合前列地尔治疗血管源性眩晕的疗效及其对脑血流灌注和血管内皮功能的影响研究
2020-08-17吴悦季宏陈华山马胜民
吴悦,季宏,陈华山,马胜民
血管源性眩晕是血管病变导致的眩晕和步态不稳,其发病率近年呈上升趋势,占眩晕的50%以上,以女性最为常见;其发病机制主要是动脉粥样硬化累及椎-基底动脉系统血管包括迷路血管、椎动脉、基底动脉、小脑前下动脉和前庭动脉,导致相应供血区域灌注不足而引起一系列临床症状[1]。动脉粥样硬化的主要病理生理改变是血管内皮损伤[2],其可使血管通透性增加,血小板黏附、聚集和释放各种活性物质,加重血管内皮屏障受损,最终导致血浆脂质蛋白沉积在血管壁。损伤的内皮细胞可以分泌各种细胞因子,常见的有内皮素1(ET-1)和降钙素基因相关肽(CGRP),二者均对血管具有重要调节作用[3]。羧甲基赖氨酸(CML)是晚期糖基化终末产物(AGEs)的活性成分,氧化修饰的低密度脂蛋白(ox-LDL)是低密度脂蛋白氧化修饰形成,二者均参与了动脉粥样硬化的病理生理过程[4]。血管源性眩晕的治疗主要是扩血管以增加脑部血液供应,而前列地尔属于扩血管物质,能够改善前庭系统的血液供应,控制眩晕症状。现有研究显示,在西药治疗的基础上予以中药治疗能够更有效地改善眩晕症状,提高疗效[5]。本研究旨在分析化痰清眩汤联合前列地尔治疗血管源性眩晕的疗效及其对脑血流灌注和血管内皮功能的影响,以期对血管源性眩晕的临床治疗提供参考。
1 对象与方法
1.1 研究对象 选择2016—2019年在上海市奉贤区中医医院就诊的血管源性眩晕患者102例为研究对象。纳入标准:(1)符合血管源性眩晕的诊断标准[6],并行经颅多普勒(TCD)检查予以证实。(2)符合中医眩晕的诊断标准,主症:耳鸣、耳聋、眩晕、面色苍白、视物旋转和少气懒言;次症:眼球震颤、汗出肢冷、恶心呕吐、头重如裹和胸脘满闷。主症和次症均≥2项即可确诊[7]。(3)签署知情同意书。排除标准:(1)其他原因引起的眩晕患者;(2)合并脑创伤和脑卒中患者;(3)对化痰清眩汤、前列地尔过敏的患者;(4)合并自身免疫性疾病和传染性疾病患者;(5)合并精神疾病和智力低下患者;(6)合并心、肝、肾等重要脏器功能障碍者;(7)妊娠期和哺乳期妇女。按照随机数字表法将患者分为观察组和对照组,各51例。观察组中男20例,女31例;年龄45~79岁,平均年龄(65.4±10.5)岁;体质指数(BMI)(21.3±2.2)kg/m2。对照组中男22例,女29例;年龄47~79岁,平均年龄(65.9±9.8)岁;BMI(21.1±3.2)kg/m2。两组性别、年龄、BMI比较,差异无统计学意义(χ2=0.041,P=0.841;t=0.249,P=0.804;t=0.368,P=0.714)。本研究经上海市奉贤区中医医院伦理委员会审核通过。
1.2 治疗方法 两组患者入院后均予以控制血压、血糖,强心,利尿和纠正电解质紊乱,低脂饮食和运动干预等对症支持治疗。对照组予以前列地尔(哈药集团生物工程有限公司,批号20160843)10 μg加入0.9%氯化钠溶液100 ml中静脉滴注,1次/d,2周为1个疗程,持续治疗2个疗程。观察组在对照组的基础上予以化痰清眩汤治疗。化痰清眩汤组方:薏苡仁和泽泻各20 g,茯苓15 g,陈皮、姜半夏和白术各12 g,天麻、黄芩、川芎、柴胡和赤芍各10 g,甘草和三七各6 g;脾肾阳虚者加红枣和干姜,眩晕重者加天麻和钩藤,睡眠差者加合欢皮、酸枣仁和郁金。予以水煎共500 ml,1剂/d,每天早晚服用1次,2周为1个疗程,共治疗2个疗程。
1.3 观察指标
1.3.1 疗效 治疗结束后评价患者疗效:临床症状消失,疗效指数≥95%为基本痊愈;临床症状明显好转或者仅部分消失,疗效指数为70%~94%为显效;临床症状改善,疗效指数为40%~69%为有效;临床症状无改善或者恶化,疗效指数≤39%为无效[8]。计算总有效率,总有效率=(基本痊愈例数+显效例数+有效例数)/总例数×100%。
1.3.2 治疗前后中医证候积分、眩晕评定量表的评分系统(DARS)评分和眩晕障碍量表(DHI)评分
1.3.2.1 中医证候积分 治疗前、后分别评定患者中医证候积分。分别根据眩晕证主症和次症严重程度分为正常、轻度、中度和重度,主症赋分为0、2、4、6分;次症赋分为0、1、2、3分。总分范围为0~27分,分数越高表示症状越严重。
1.3.2.2 DARS评分 治疗前、后分别采用DARS对患者进行评分。DARS包括站立时平衡失调、行走时平衡失调、现在眩晕、感到困惑或者定向障碍、病情的总体印象(医生)和病情的总体印象(患者)6个条目,每个条目得分为0~6分,总分范围为0~36分,分数越高表示眩晕症状越严重。
1.3.2.3 DHI评分 治疗前、后分别采用DHI对患者进行评分。DHI由躯体(0~32分)、功能(0~32分)和情绪(0~36分)3个维度、25个问题组成,总分范围为0~100分,分数越高表示眩晕症状越严重。
1.3.3 血液流变学指标 分别于治疗前、后抽取患者肘静脉血 2 ml,3 000 r/min 离心 15 min(离心半径 15 cm),取上清液于除酶管内,置于-70 ℃冰箱中保存。采用血液黏度分析仪检测全血高切黏度、全血低切黏度、血浆黏度、血细胞比容,严格按照试剂盒说明书进行操作。
1.3.4 脑血流灌注指标 分别于治疗前、后对患者进行TCD检查,探头频率调整为2 MHz,检测椎-基底动脉血流动力学指标即脑血流灌注指标,包括左侧椎动脉(LVA)血流速度、右侧椎动脉(RVA)血流速度、基底动脉(BA)血流速度、BA阻力指数。
1.3.5 血管内皮功能指标 分别于治疗前、后抽取患者肘静脉血 2 ml,3 000 r/min 离心 15 min(离心半径 15 cm),取上清液于除酶管内,置于-70 ℃冰箱中保存。采用酶联免疫吸附试验检测ET-1、CGRP、CML、ox-LDL,试剂盒购自罗氏(中国)有限公司,严格按照说明书进行操作。
1.3.6 不良反应 观察两组患者治疗期间肝肾功能受损、发热、皮疹、恶心呕吐和腹泻等不良反应发生情况。
1.4 统计学方法 采用SPSS 15.0统计分析软件对数据进行分析。正态分布计量资料以(x ±s)表示,两组间比较采用独立样本t检验,治疗前后组内比较采用配对t检验;计数资料以相对数表示,组间比较采用χ2检验。双侧检验水准α=0.05。
2 结果
2.1 两组疗效比较 观察组中,基本痊愈15例(29.4%),显效21例(41.2%),有效13例(25.5%),无效2例(3.9%),总有效率为96.1%(49/51);对照组中,基本痊愈11例(21.6%),显效13例(25.5%),有效17例(33.3%),无效10例(19.6%),总有效率为80.4%(41/51)。观察组总有效率高于对照组,差异有统计学意义(χ2=4.628,P=0.032)。
2.2 两组治疗前后中医证候积分、DARS评分、DHI评分比较 治疗前,两组中医证候积分、DARS评分、DHI评分比较,差异无统计学意义(P>0.05);治疗后,观察组中医证候积分、DARS评分、DHI评分低于对照组,差异有统计学意义(P<0.05)。对照组、观察组治疗后中医证候积分、DARS评分、DHI评分分别低于本组治疗前,差异有统计学意义(P<0.05,见表1)。
2.3 两组治疗前后血液流变学指标比较 治疗前,两组全血高切黏度、全血低切黏度、血浆黏度、血细胞比容比较,差异无统计学意义(P>0.05);治疗后,观察组全血高切黏度、全血低切黏度、血浆黏度、血细胞比容低于对照组,差异有统计学意义(P<0.05)。对照组、观察组治疗后全血高切黏度、全血低切黏度、血浆黏度、血细胞比容分别低于本组治疗前,差异有统计学意义(P<0.05,见表2)。
2.4 两组治疗前后脑血流灌注指标比较 治疗前,两组LVA血流速度、RVA血流速度、BA血流速度、BA阻力指数比较,差异无统计学意义(P>0.05);治疗后,观察组LVA血流速度、RVA血流速度、BA血流速度快于对照组,BA阻力指数低于对照组,差异有统计学意义(P<0.05)。对照组、观察组治疗后LVA血流速度、RVA血流速度、BA血流速度分别快于本组治疗前,BA阻力指数分别低于本组治疗前,差异有统计学意义(P<0.05,见表3)。
2.5 两组治疗前后血管内皮功能指标比较 治疗前,两组ET-1、CGRP、CML、ox-LDL比较,差异无统计学意义(P>0.05);治疗后,观察组ET-1、CML、ox-LDL低于对照组,CGRP高于对照组,差异有统计学意义(P<0.05)。对照组、观察组治疗后ET-1、CML、ox-LDL分别低于本组治疗前,CGRP分别高于本组治疗前,差异有统计学意义(P<0.05,见表4)。
2.6 不良反应发生情况 观察组治疗期间发生发热2例、皮疹1例,不良反应发生率为5.9%(3/51);对照组治疗期间发生发热1例,不良反应发生率为2.0%(1/51);两组不良反应均予以对症治疗后痊愈。两组不良反应发生率比较,差异无统计学意义(χ2=0.260,P=0.610)。
3 讨论
血管源性眩晕是临床常见病和多发病,是由椎-基底动脉系统病变所致,表现为脑动脉硬化、微小血栓形成和后循环缺血等,脑部动脉血管壁受到不良刺激导致动脉粥样硬化后血流减少、管径变窄,进而引起脑部缺血缺氧状态[8]。血管源性眩晕患者常出现恶心呕吐、眩晕和运动、感觉功能障碍等临床症状,严重影响患者的生活质量。因此,迅速改善椎-基底动脉血液供应是治疗血管源性眩晕的关键[9]。前列地尔是临床上的常用药物,主要作用有扩血管、改善微循环,对血管源性眩晕具有良好的疗效。当然目前还有其他治疗方案,但效果仍不理想,近年随着中医中药的发展,中医在治疗眩晕方面具有一定的疗效,尤其中西医结合治疗取得了良好的效果[10]。中医学理论认为,眩晕主要是气血生化不足、肝肾亏虚和肝阳上扰所致。本研究结果显示,观察组总有效率高于对照组;治疗后,观察组中医证候积分、DARS评分、DHI评分低于对照组,对照组、观察组中医证候积分、DARS评分、DHI评分分别低于本组治疗前;提示化痰清眩汤联合前列地尔能够缓解血管源性眩晕患者的眩晕症状。本研究结果显示,治疗后,观察组全血高切黏度、全血低切黏度、血浆黏度、血细胞比容低于对照组,对照组、观察组全血高切黏度、全血低切黏度、血浆黏度、血细胞比容分别低于本组治疗前;治疗后,观察组LVA血流速度、RVA血流速度、BA血流速度快于对照组,BA阻力指数低于对照组;对照组、观察组治疗后LVA血流速度、RVA血流速度、BA血流速度分别快于本组治疗前,BA阻力指数分别低于本组治疗前;提示化痰清眩汤联合前列地尔能够明显改善血管源性眩晕患者血液流变学和脑部血液循环。中医学理论认为,血管源性眩晕属于“眩晕”范畴,主要由于肝脾肾虚、浊阴不降、清阳不升和痰瘀互结等原因引起,根据《黄帝内经》记载的“诸风掉眩,皆属于肝”及《丹溪心法》中的“无痰不作眩,痰因火动”等,治疗以化痰健脾、化痰定眩和调理脾胃为主。化痰清眩汤方中泽泻、茯苓、陈皮功在降逆化痰、逐饮利水;三七、川芎具有活血祛瘀、通络定眩之功效;黄芩、姜半夏、柴胡、甘草可通利三焦、透达郁火、降浊升清;薏苡仁可健脾利湿;天麻功在祛风化痰;全方相须而用,共谱祛风定眩、化痰涤饮、祛瘀活血之曲。现代药理学研究表明,化痰清眩汤的组方具有以下功效:薏苡仁由脂类、甾醇类、木质素类和多种微量元素等成分组成,具有抗炎镇痛、调节脂质代谢、降糖和提高免疫力的作用;泽泻主要由三萜和倍半萜组成,具有利尿、降脂、降糖、抗动脉粥样硬化、调节神经内分泌、抗氧化和调节免疫等作用;茯苓主要成分为麦角甾、胡萝卜苷和茯苓酸等,具有保肝、利尿、消肿、提高免疫力等作用;陈皮主要含有右旋柠檬烯、枸橼醛等成分,具有增加心搏出量、调节心血管收缩功能、调节胃肠道平滑肌、抑制动脉粥样硬化和抗菌等作用;姜半夏主要含有生物碱、甾醇、氨基酸和挥发油等成分,具有抗炎、抗衰老、止吐、镇痛等作用;白术由挥发油、白术内酯和白术多糖等组成,具有抗炎、利尿、抗衰老和提高免疫力等作用;天麻主要含有天麻素,具有镇静、抗炎、增强免疫力、提高智力、抗衰老、改善氧供和调节脑功能等作用;黄芩主要含有黄芩素、黄芩甙和β-谷甾醇等成分,具有抗炎、抗病毒、保护神经、抗氧化、保护心血管等作用;川芎主要含酚酞、生物碱、脑苷脂和神经酰胺等成分,具有抗血栓、解除痉挛、镇静、抑菌、改善微循环等作用;柴胡主要含有柴胡苷、挥发油、脂肪油和甾醇等成分,具有镇静、解热镇痛、抗炎抑菌、降低胆固醇等作用;赤芍含有单萜类、三萜类和儿茶酚胺等成分,具有抗凝、抗血栓、抑制血小板聚集、抑制动脉粥样硬化、改善微循环等作用;甘草主要有甘草黄铜和甘草酸等成分,具有抗心律失常、抗炎、抗病毒、保护心血管和增强免疫力等作用;三七主要含有三七总皂减轻苷、三七素和三七多糖,具有改善微循环、增加血流量、减轻心脑缺氧等作用[11-14]。综上,化痰清眩汤具有改善脑部微循环、增加脑部血液供应、降脂、抗凝、抗动脉粥样硬化、解热镇痛等作用,故其能够改善血管源性眩晕的症状,改善患者脑部血液供应,从而达到提高疗效的目的。
表1 两组治疗前后中医证候积分、DARS评分、DHI评分比较(±s,分)Table 1 Comparison of TCM symptom score,DARS score and DHI score between the two groups before and after treatment
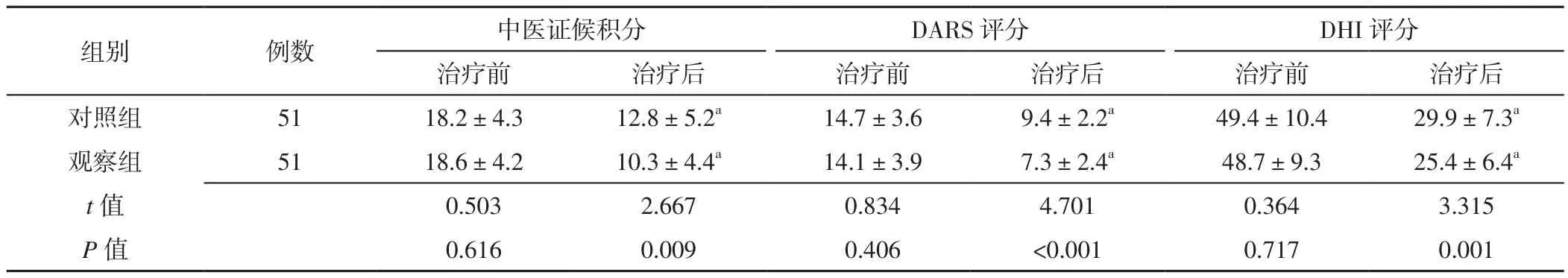
表1 两组治疗前后中医证候积分、DARS评分、DHI评分比较(±s,分)Table 1 Comparison of TCM symptom score,DARS score and DHI score between the two groups before and after treatment
注:与本组治疗前比较,aP<0.05;DARS=眩晕评定量表的评分系统,DHI=眩晕障碍量表
组别 例数 中医证候积分 DARS评分 DHI评分治疗前 治疗后 治疗前 治疗后 治疗前 治疗后对照组 51 18.2±4.3 12.8±5.2a 14.7±3.6 9.4±2.2a 49.4±10.4 29.9±7.3a观察组 51 18.6±4.2 10.3±4.4a 14.1±3.9 7.3±2.4a 48.7±9.3 25.4±6.4a t值 0.503 2.667 0.834 4.701 0.364 3.315 P值 0.616 0.009 0.406 <0.001 0.717 0.001
表2 两组治疗前后血液流变学指标比较(±s)Table 2 Comparison of hemorheology indicators between the two groups before and after treatment

表2 两组治疗前后血液流变学指标比较(±s)Table 2 Comparison of hemorheology indicators between the two groups before and after treatment
注:与本组治疗前比较,aP<0.05
组别 例数 全血高切黏度(mPa·s) 全血低切黏度(mPa·s) 血浆黏度(mPa·s) 血细胞比容(%)治疗前 治疗后 治疗前 治疗后 治疗前 治疗后 治疗前 治疗后对照组 51 5.9±0.8 5.5±0.6a 17.2±2.1 14.1±1.8a 1.8±0.4 1.7±0.4a 0.50±0.12 0.42±0.07a观察组 51 5.9±0.7 4.9±0.5a 16.9±2.2 12.1±1.8a 1.9±0.4 1.4±0.4a 0.48±0.11 0.31±0.06a t值 0.350 5.524 0.570 5.811 0.587 3.274 0.877 8.521 P值 0.727 <0.001 0.570 <0.001 0.559 0.002 0.382 <0.001
表3 两组治疗前后脑血流灌注指标比较(±s)Table 3 Comparison of cerebral blood perfusion indicators between the two groups before and after treatment
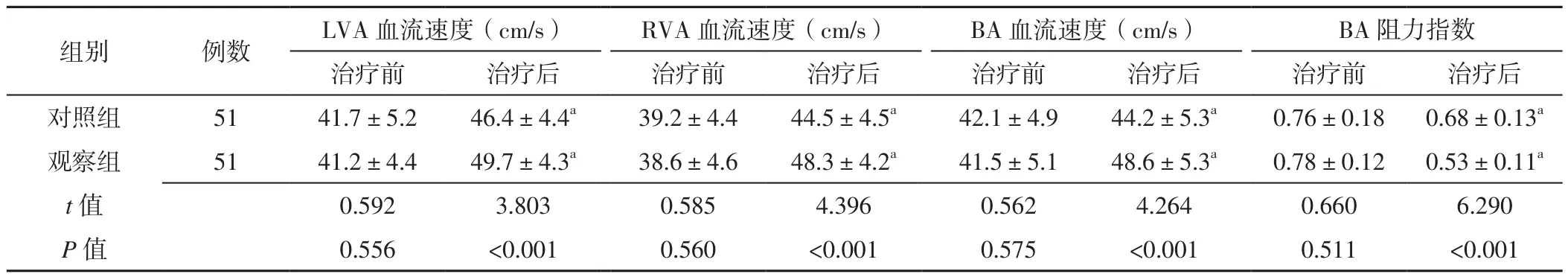
表3 两组治疗前后脑血流灌注指标比较(±s)Table 3 Comparison of cerebral blood perfusion indicators between the two groups before and after treatment
注:与本组治疗前比较,aP<0.05;LVA=左侧椎动脉,RVA=右侧椎动脉,BA=基底动脉
组别 例数 LVA血流速度(cm/s) RVA血流速度(cm/s) BA血流速度(cm/s) BA阻力指数治疗前 治疗后 治疗前 治疗后 治疗前 治疗后 治疗前 治疗后对照组 51 41.7±5.2 46.4±4.4a 39.2±4.4 44.5±4.5a 42.1±4.9 44.2±5.3a 0.76±0.18 0.68±0.13a观察组 51 41.2±4.4 49.7±4.3a 38.6±4.6 48.3±4.2a 41.5±5.1 48.6±5.3a 0.78±0.12 0.53±0.11a t值 0.592 3.803 0.585 4.396 0.562 4.264 0.660 6.290 P值 0.556 <0.001 0.560 <0.001 0.575 <0.001 0.511 <0.001
表4 两组治疗前后血管内皮功能指标比较(±s)Table 4 Comparison of vascular endothelial function indicators between the two groups before and after treatment
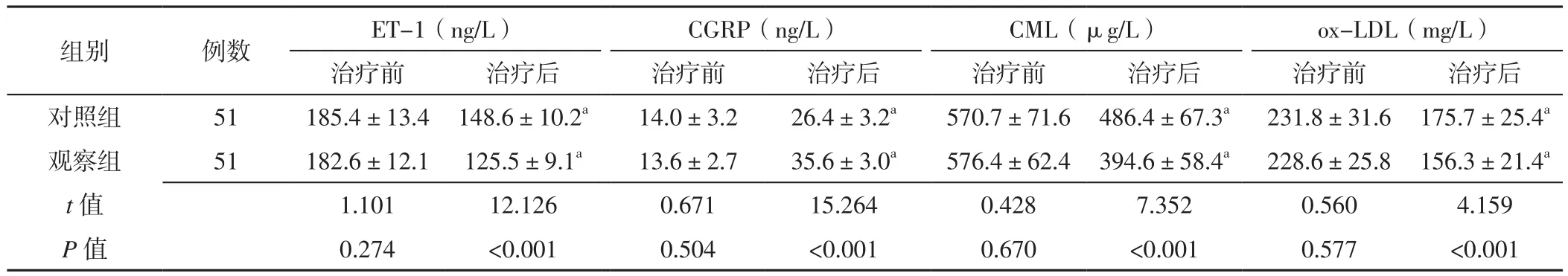
表4 两组治疗前后血管内皮功能指标比较(±s)Table 4 Comparison of vascular endothelial function indicators between the two groups before and after treatment
注:与本组治疗前比较,aP<0.05;ET-1=内皮素1,CGRP=降钙素基因相关肽,CML=羧甲基赖氨酸,ox-LDL=氧化修饰的低密度脂蛋白
组别 例数 ET-1(ng/L) CGRP(ng/L) CML(μg/L) ox-LDL(mg/L)治疗前 治疗后 治疗前 治疗后 治疗前 治疗后 治疗前 治疗后对照组 51 185.4±13.4 148.6±10.2a 14.0±3.2 26.4±3.2a 570.7±71.6 486.4±67.3a 231.8±31.6 175.7±25.4a观察组 51 182.6±12.1 125.5±9.1a 13.6±2.7 35.6±3.0a 576.4±62.4 394.6±58.4a 228.6±25.8 156.3±21.4a t值 1.101 12.126 0.671 15.264 0.428 7.352 0.560 4.159 P 值 0.274 <0.001 0.504 <0.001 0.670 <0.001 0.577 <0.001
ET-1是一种内源性血管活性多肽,具有强烈的缩血管作用,其可促进氨基酸释放、钙离子内流,导致血管痉挛[15];CGRP亦是一种内源性血管活性多肽,具有强烈的舒血管作用,其可以通过降低细胞内的钙离子内流而发挥舒血管作用[16]。正常情况下ET-1和CGRP保持动态平衡,对血管的舒张和收缩具有重要调节作用,而其在血管源性眩晕患者中同样起重要作用[17-18]。本研究结果显示,治疗后,观察组ET-1低于对照组,CGRP高于对照组;对照组、观察组治疗后ET-1分别低于本组治疗前,CGRP分别高于本组治疗前;提示化痰清眩汤联合前列地尔能够改善血管源性眩晕血管舒缩功能,解除血管痉挛,进而改善脑血流灌注。CML是从AGEs中分离出来的活性物质,能够与细胞膜上的受体结合,调节血管内皮功能,参与机体动脉粥样硬化的发生发展过程,是反映动脉粥样硬化严重程度的指标[19]。现有研究表明,CML能够诱导单核巨噬细胞分泌大量的生长促进因子,并不断吞噬大量的ox-LDL,导致血管内皮细胞增殖,并且可以促进巨噬细胞凋亡和动脉壁平滑肌细胞向成骨细胞分化,引起血管硬化[20]。ox-LDL是LDL发生氧化后,特异性地存在于动脉硬化病灶中,并且能够抑制血管内皮细胞合成舒血管物质如一氧化氮(NO)等,抑制抗凝物质的产生,促进机体动脉粥样硬化的发生[21];此外,其还能被巨噬细胞吞噬形成泡沫细胞,促进动脉粥样硬化形成,而且还可促进血小板黏附和聚集,引起血管舒张功能丧失,局部血流灌注下降,最终导致各种动脉粥样硬化性疾病的产生[22]。本研究结果显示,治疗后,观察组CML、ox-LDL低于对照组;对照组、观察组治疗后CML、ox-LDL分别低于本组治疗前;说明化痰清眩汤联合前列地尔能够降低血管源性眩晕患者CML和ox-LDL,从而抑制动脉粥样硬化的进程,改善血管弹性,增加局部组织血流灌注,尤其是脑血流灌注。
本研究结果显示,两组不良反应发生率比较无差异,说明化痰清眩汤联合前列地尔具有较高的安全性,但本研究样本量较小,结果可能存在一定偏倚,需要在后续的研究中扩大样本量,减少研究中的偏倚,进而得到更为准确的数据。
综上所述,化痰清眩汤联合前列地尔治疗血管源性眩晕疗效确切,能够提高患者脑血流灌注,改善血管内皮功能,且安全性好,值得临床推广应用。
作者贡献:吴悦进行文章的构思与设计,文章的可行性分析,文献/资料收集、整理,撰写论文,负责文章的质量控制及审校,对文章整体负责、监督管理;季宏、陈华山、马胜民进行论文的修订、英文的修订。
本文无利益冲突。
