毛竹微管蛋白的分子特征及PeTUA3的功能*
2020-08-14朱成磊李彩丽李晓佩史晶晶高志民
朱成磊 李彩丽 李晓佩 史晶晶 高志民
(1. 国际竹藤中心 国家林业和草原局/北京竹藤科学与技术重点开放实验室 北京 100102; 2. 中国医学科学院北京协和医学院药用植物研究所 北京 100193)
微管、微丝和中间纤维组成细胞骨架,其中微管的基本组成单位是微管二聚体,主要由α-微管蛋白和β-微管蛋白通过共价键作用形成的中空管状结构(Downingetal., 1998)。微管在植物生长发育过程中发挥着重要作用,不仅参与细胞分裂(Rasmussenetal., 2013)、细胞形态建成及维持(Burketal., 2002; Krtkováetal., 2016),还参与指导细胞壁物质的合成(Catteronetal., 2001),通过影响细胞壁的组分和结构调控细胞的伸长(Paredezetal., 2006; Gutierrezetal., 2009),而且在植物生物和非生物胁迫下,微管同样发挥着重要的调节作用(Hardham, 2013; Zhu, 2016)。微管蛋白通常以基因家族的形式参与调控植物的生长发育(杨洪等, 2017)。自1963年首次从植物细胞中发现微管蛋白(Ledbetteretal., 1963)以来,在模式物种拟南芥(Arabidopsisthaliana)(Kopczaketal., 1992; Snustadetal., 1992)、水稻(Oryzasativa)(Eonetal., 2000; Oshikawaetal., 2003)、毛果杨(Populustrichocarpa)(Rodneyetal., 2007)等多物种中开展了微管蛋白研究,微管蛋白在细胞的分裂、生长、细胞内物质运输及细胞壁的形成过程中均发挥着重要作用(Mckeanetal., 2001)。研究证明,小麦(Triticumaestivum)微管在高尔基体的排列及其结构完整性方面起着关键作用(Wangetal., 2012),陆地棉(Gossypiumhirsutum)的GhTUB7对纤维细胞次生壁的合成具有调控作用(曾志锋, 2016),这些成果为研究竹子微管蛋白提供了良好的借鉴。
竹子具有速生的特点,能在2个月左右的时间迅速完成竹株的增高生长,材性优良,4年能达到材性最佳,因此对于竹材材性形成的相关分子调控研究倍受关注。已报道了木质素生物合成基因COMT(李雪平等, 2007)、PePAL1(高志民等, 2009)、C4H(金顺玉等, 2010) 和PeLAC(李利超等, 2017)等的表达模式,证明了PePAL1、BoPAL2、BoPAL4表达的蛋白具有PAL/TAL双重活性(Hsiehetal., 2010; Gaoetal., 2012)。竹子纤维素合成涉及的酶基因PpCesA1(杜亮亮等, 2010)、PeCesA(邓小波等, 2011)、BeCesA1和BeCesA7(罗丹等, 2019)等的表达分析和木聚糖合成相关基因PeIRX10(王杰等, 2016)的功能分析也有研究报道。而竹子微管蛋白相关研究仅有毛竹(Phyllostachysedulis)PeTUA3原核表达的报道,发现其可能参与毛竹细胞分裂、细胞生长以及细胞壁的形成过程(李彩丽等, 2012)。随着毛竹基因组草图以及基因组数据库的完成(Pengetal., 2013; Zhaoetal., 2014; 赵广枝等, 2015),为全面了解毛竹中微管蛋白基因提供了便利。本文以毛竹为研究对象,采用生物信息学的方法对微管蛋白基因的结构特征、蛋白质理化性质和亚细胞定位、系统进化关系和组织特异性表达等进行了系统分析; 采用实时定量PCR方法,分析了毛竹微管蛋白基因在不同发育阶段毛竹笋中的表达模式; 同时采用在模式植物拟南芥中异位表达的方法,对PeTUA3的功能进行了初步研究。以期为深入研究毛竹微管蛋白基因奠定基础,为全面揭示毛竹笋快速生长的调节机制提供参考依据。
1 材料与方法
1.1 试验材料
春季毛竹发笋期,赴江西南昌采集不同生长发育阶段的笋(1.0、2.0、4.0、6.0、8.0 m),样品经液氮处理后,置于-80 ℃冰箱中,用于RNA的提取。
拟南芥野生型(Col-0)种子由本实验室保存,播种于1/2MS培养基中,春化2天后转入人工气候室(温度25~30 ℃、湿度60%~80%、光照时间16 h),8天左右移栽到营养土(腐殖土∶蛭石∶珍珠岩体积比为7∶2∶1)中继续培养4~5周,用于转基因侵染试验。
1.2 试验方法
1.2.1 毛竹微管蛋白基因的获取及理化性质分析 以拟南芥微管蛋白基因AtTUA1(AT1G64740)和AtTUB1(AT1G75780)作为诱饵,在植物基因数据库PLAZA(https:∥bioinformatics.psb.ugent.be/plaza/)(Proostetal., 2014)中进行同源比对,获取毛竹中微管蛋白基因的同源序列。筛选编码微管蛋白含有该家族标志性氨基酸保守区域“GGGTGSG”的基因,通过NCBI数据库中的保守结构域分析软件进行结构域验证,保留具有完整保守结构域的微管蛋白基因。
通过在线软件GSDS Version 2.0(http:∥gsds.cbi.pku.edu.cn/)绘制毛竹微管蛋白基因结构,用MEME(http:∥meme-suite.org/tools/meme)和ExPaSy ProtParam(https:∥web.expasy.org/protparam/)分别分析毛竹微管蛋白的保守结构域和基本理化性质,用WOLF PSORT(https:∥www.genscript.com/wolf-psort.html?src=leftbar)在线软件预测微管蛋白的亚细胞位置。
1.2.2 毛竹微管蛋白系统进化树的构建 基于MEGA 7.0内置的Clustal W对毛竹、水稻和拟南芥的微管蛋白氨基酸序列进行比对,使用MEGA 7.0构建系统发育树(Kumaretal., 2016),参数选择: 邻接法(Neighbor-Joining),分支可信度检测(Bootstrap method)为1 000次重复,氨基酸替换模型选用p-distance模型(Jonesetal., 1992),缺失位点处理方法选择完全删除(complete deletion)。
1.2.3 基于转录组数据的毛竹微管蛋白基因的表达谱分析 根据已发表的毛竹7个不同组织(叶、早花期花序、盛花期花序、鞭、根、20 cm笋、50 cm笋)的转录组数据(Pengetal., 2013),筛选出毛竹微管蛋白基因在不同组织中的RPKM(reads per kilobases per million reads)值。采用Heml 1.0软件绘制基因表达热图,用蓝到红渐变的颜色变化表示表达丰度的递增。
1.2.4 cDNA的合成与实时定量PCR 通过TRIzol 法(Gaoetal., 2006)提取不同高度笋样品以及转正义PeTUA3和野生型拟南芥不同组织(根、茎、叶和花)的总RNA,残余DNA使用Recombinant DNase I除去,按照反转录试剂盒(Promega, 美国)操作说明合成cDNA,分别用于定量分析以及基因克隆。
根据获得的毛竹微管蛋白基因同源序列,使用Primer Premier 5.0软件设计合适的定量引物,由上海生工生物工程技术服务有限公司合成(表1)。利用qTOWER 2.2(Analytik Jena, 德国) PCR仪进行微管蛋白基因表达的定量分析,以PeNTB(Fanetal., 2013)为内参,分析不同高度笋中微管蛋白基因的表达量; 以拟南芥AtActin-7(刘凯歌等, 2017)为内参,定量分析转基因拟南芥中PeTUA3表达情况。每个反应3个重复。反应体系(10 μL)为: LightCycler®480 SYBR Green I Master Mix(Roche, 美国)5.0 μL,正、反向引物各0.3 μL,cDNA 1.0 μL,ddH2O 3.4 μL。反应程序: 95 ℃ 10 min; 95 ℃ 10 s,62 ℃ 10 s,共39个循环。定量数据结果采用2-△△CT算法(Livaketal., 2001)分析,利用Excel 2016对数据进行分析并绘图。
1.2.5PeTUA3表达载体构建及农杆菌转化 根据获得的毛竹PeTUA3基因(FP100535.1) CDS序列,设计编码区引物(ORF-TUA3)(表1),以毛竹cDNA为模板进行PCR扩增。反应程序: 95 ℃ 5 min; 95 ℃ 1 min,60 ℃ 1 min,72 ℃ 1 min 40 s,35个循环; 72 ℃延伸10 min,4 ℃保存。PCR产物经电泳后用胶回收试剂盒(Biomiga, 中国)回收,并连接到pGEM-T easy(Promega, 美国)载体上,热激转化大肠杆菌(Escherichiacoli)感受态细胞(DH5α),筛选抗性克隆,提取质粒并酶切验证,同时送生工生物工程技术服务有限公司测序。

表1 PCR引物①Tab.1 Primers sequences of PCR
根据PeTUA3的CDS序列和表达载体pBI121的多克隆位点,设计正义表达引物(STUA3)和反义表达引物(ATUA3),以测序正确的质粒为模板,用正义表达引物和反义表达引物分别进行扩增。经测序验证后,再酶切分别连接到表达载体pBI121的多克隆位点,形成表达载体。将表达载体质粒分别电击转入根癌农杆菌(Agrobacteriumtumefaciens) EHA105中,用于拟南芥转化。
1.2.6 转基因拟南芥抗性筛选与表型分析 分别用含有正、反义PeTUA3表达载体质粒的农杆菌侵染拟南芥花序(Cloughetal., 1998),暗处理48 h后正常培养,成熟后收集T0代种子。种子经连续抗性筛选,得到T3代不分离的转基因植株用于后续试验。采用CTAB法(Clarke, 2009)提取转基因拟南芥的基因组DNA为模板,以ORF-TUA3引物进行PCR扩增验证,同时以野生型拟南芥为对照。分别播种正、反义转PeTUA3基因和野生型种子于1/2MS培养基,在垂直板上生长,相同条件下培养,观察生长情况并拍照,同时跟踪测定各植株主根的生长量,每次至少统计30株主根的根长。
2 结果与分析
2.1 毛竹微管蛋白基因序列和基因结构分析
通过比对分析,共获得18条具有完整保守结构域的毛竹微管蛋白基因,根据模式植物拟南芥同源基因相似度和命名规则,将其分别命名为PeTUA1-PeTUA6和PeTUB1-PeTUB12。基因结构分析表明,TUA亚家族成员的基因结构差异较大,其中PeTUA2、PeTUA3和PeTUA6均含有3个内含子,PeTUA1和PeTUA4含有4个内含子,PeTUA5的内含子最多,为8个; TUB亚家族成员均含有2~3个内含子,其中PeTUB5与PeTUB8、PeTUB1与PeTUB4以及PeTUB3与PeTUB9的内含子、外显子长度和位置分别大致相同(图1A)。蛋白基序分析表明,毛竹微管蛋白属于高度保守性蛋白,共获得14个保守基序,基序1~10和基序12为18个毛竹微管蛋白共有基序,而基序13仅在TUA亚家族成员中出现,基序11和基序14只在TUB亚家族成员中出现(图1B)。

图1 毛竹微管蛋白基因结构与保守结构域Fig.1 Gene structures and conserved domains of tubulins in Moso bamboo
2.2 毛竹微管蛋白理化性质分析及亚细胞定位预测
毛竹微管蛋白家族成员的氨基酸个数为430~634个不等,分子量在48.31~69.89 kDa之间,其中除了PeTUA5(69.89 kDa)之外,其他各成员间分子量相差不大,均在50.00 kDa左右。根据微管蛋白各家族成员的等电点预测结果可知微管蛋白家族成员均为酸性蛋白,其等电点均在4.68~5.98之间,其中TUA亚家族成员的等电点略高于TUB亚家族成员。从平均疏水系数(GRAVY)结果可以看出,18个毛竹微管蛋白均为亲水性蛋白,其中TUA亚家族成员GRAVY值在-0.162~-0.192之间,而TUB亚家族除PeTUB10为-0.168之外,其他亚家族成员GRAVY值均在-0.360左右。亚细胞定位预测分析结果表明,TUA亚家族均定位在细胞质中,而TUB亚家族则均定位在细胞核中。
2.3 毛竹微管蛋白的系统进化分析
基于毛竹、水稻、拟南芥微管蛋白的系统进化分析结果表明,所有微管蛋白家族成员分别聚类到2个亚家族(TUA和TUB)中(图2)。其中TUA亚家族有2个分支A-1和A-2,在每个分支中,所有毛竹TUA亚家族成员均与水稻的聚类在较近的位置。TUB亚家族有4个分支,其中B-1分支中包括7个毛竹TUB蛋白和3个水稻TUB蛋白,仅有1个拟南芥TUB蛋白AtTUB6; 而B-2分支只含有1个毛竹(PeTUB2)和1个水稻(OsTUB2)的TUB蛋白,包括4个拟南芥TUB蛋白; 在B-3分支中,包含4个毛竹TUB蛋白、3个水稻TUB蛋白和2个拟南芥TUB蛋白; B-4中仅包含2个拟南芥TUB蛋白。在各个分支中,毛竹微管蛋白和水稻的聚类在较近的位置,而与拟南芥的相对较远。
2.4 毛竹微管蛋白基因组织特异性表达分析
基于转录组数据的表达谱热图(图3)可以看出,毛竹微管蛋白基因在7个组织中的表达量存在一定的差异。其中PeTUA3、PeTUA6、PeTUB2、PeTUB3、PeTUB7和PeTUB96个基因在各个组织中均有较高的表达量,它们可能作为组成型基因在毛竹整个生长发育中都发挥着重要作用;PeTUA1、PeTUB1和PeTUB113个基因在根、笋和鞭中的表达量高于叶和花序中,表明这些基因可能主要与结构组织发育相关;PeTUB6、PeTUB8和PeTUB10在根和鞭中的表达量高于其他组织,表明这些基因可能与地下组织形成有关;PeTUA2和PeTUB12在各组织中的表达量均比较低; 而PeTUA4在花序中表达量相对高于其他组织,说明PeTUA4可能与花发育相关(图3)。毛竹微管蛋白基因在不同组织中的表达差异,说明它们在毛竹不同组织中或同一组织的不同生长发育阶段发挥着不同的功能。
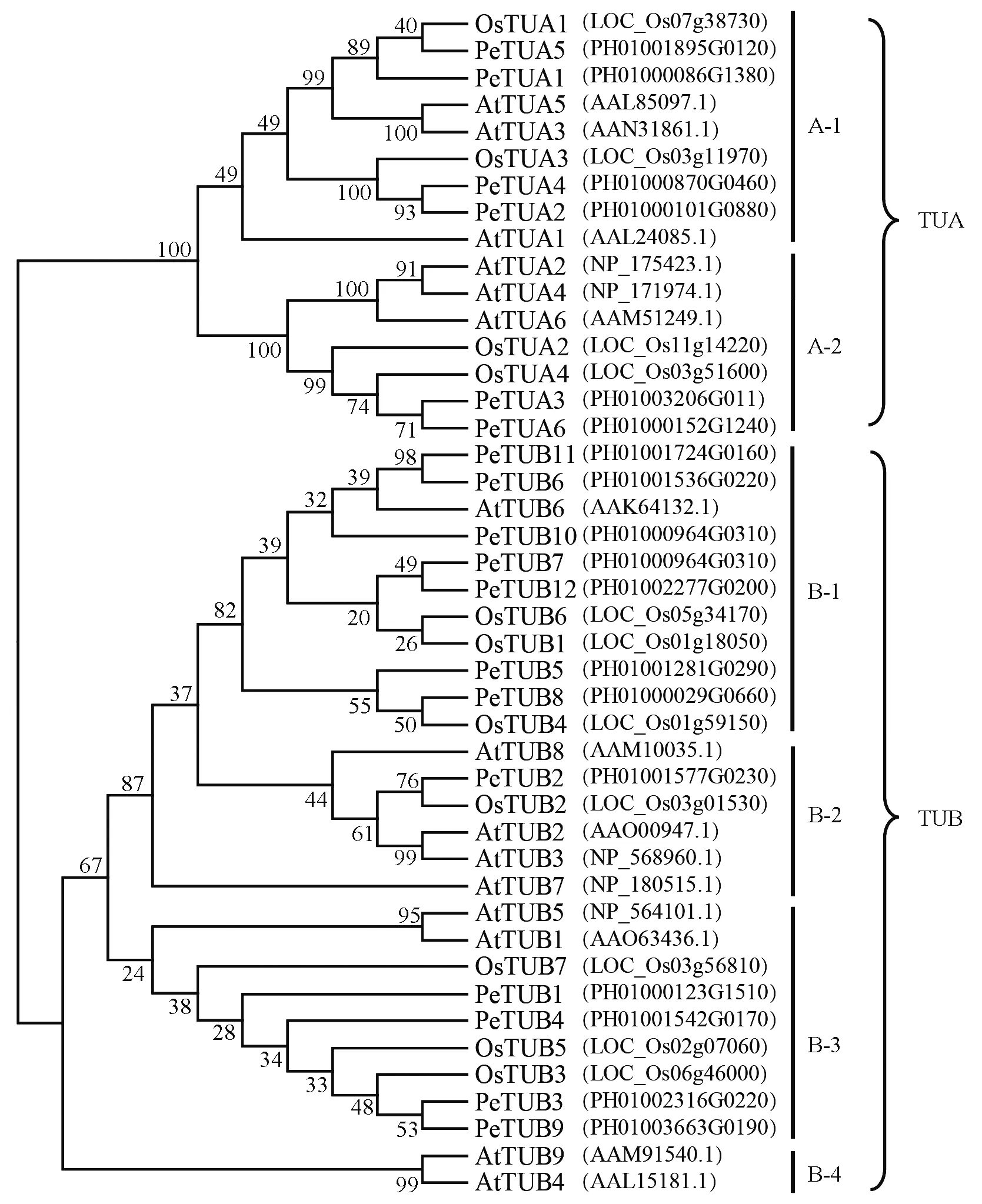
图2 基于毛竹和模式植物(水稻、拟南芥)微管蛋白氨基酸序列构建的系统发育进化树Fig.2 Phylogenetic tree based on amino acid sequences of tubulin proteins from Moso bamboo and model plants(Oryza sativa and Arabidopsis thaliana)Pe: 毛竹 Phyllostachys edulis; Os: 水稻 Oryza sativa; At: 拟南芥 Arabidopsis thaliana.

图3 微管蛋白基因在毛竹7个组织中的表达分析Fig.3 Expression analysis of tubulin genes in seven tissues of Moso bambooLe: 叶; Ei: 早花期花序; Fi: 盛花期花序; Rh: 鞭; Ro: 根; S1: 20 cm笋; S2: 50 cm笋。Le: Leaf; Ei: Early inflorescence; Fi: Flowering inflorescence; Rh: Rhizome; Ro: Root; S1: 20 cm shoot; S2: 50 cm shoot.
2.5 毛竹微管蛋白基因在笋中的表达模式分析
实时荧光定量PCR结果表明,随着笋高度的增加TUA亚家族6个基因的表达量均呈上调趋势,而TUB亚家族有8个基因的表达量呈上调趋势,4个基因的表达为波动变化(图4)。在上调表达的基因中,PeTUA4、PeTUB3、PeTUB4、PeTUB9和PeTUB105个基因的表达量呈一直上升的趋势;PeTUA1、PeTUA5、PeTUA6和PeTUB124个基因表达趋势均呈先上升后下降的趋势,均在1.0 m和2.0 m笋中表达量相对较低,在6.0 m笋中表达量达到最高,之后在8.0 m笋中略微下降;PeTUA2、PeTUB5和PeTUB7的表达量呈现呈先上升后下降,再上升再下降的趋势。在表达波动变化的基因中,PeTUB1的表达先呈现下调,至4.0 m笋中达到最低,之后在6.0 m笋中表达量迅速上调达到最高,之后在8.0 m笋中又迅速下降,但仍然高于1.0 m笋中的表达量;PeTUB6在2.0 m笋中的表达量迅速上调(约是1.0 m笋中的2.8倍),而在4.0 m笋中又迅速下降(约为1.0 m笋中的0.6倍),之后又逐渐上升,8.0 m笋中约是1.0 m笋中的2.0倍;PeTUB8和PeTUB11都是呈现先上升后下降的趋势,分别在4.0 m和2.0 m笋中表达量最高,均是在8.0 m笋中最低(低于1.0 m笋中的表达量)。综合来看,毛竹各微管蛋白基因在不同高度笋的表达模式存在着明显差异,表明它们在笋的生长过程中发挥着不同的作用。
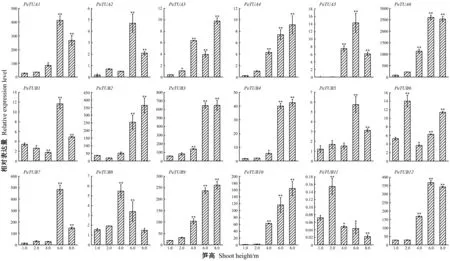
图4 微管蛋白基因在毛竹不同发育阶段笋中的表达分析Fig.4 Expression analysis of tubulin genes in different height shoots of Moso bamboo图中为平均值±标准误; 星号表示t检验结果,*表示差异显著(P< 0.05),**表示差异极显著(P < 0.01)。Values are means ± standard error. The single and double stars indicate significant difference at 0.05 and 0.01 levels of the gene expression in different shoot heights according to Student’s t test.
2.6 PeTUA3表达载体验证及转基因拟南芥植株表型分析
引物ORF-TUA3扩增的产物连接pGEM-T easy载体后测序结果表明,插入片段为1 356 bp,与FP100535.1序列完全一致。对克隆到pBI121多克隆位点的PeTUA3表达载体测序结果表明,正义表达载体多克隆位点插入序列依次包含XbaⅠ位点(6 bp)、PeTUA3编码区正向序列(1 356 bp,含终止密码子)和KpnⅠ位点(6 bp),反义表达载体插入序列依次包含XbaⅠ位点(6 bp)、PeTUA3编码区反向序列(1 356 bp,含终止密码子)和KpnⅠ位点(6 bp),PeTUA3编码区序列与FP100535.1序列完全一致,表明获得了正确的植物表达载体。对转化的拟南芥进行抗性筛选,分别获得正、反义PeTUA3转基因T3代不分离株系各7个。分别随机选取3个转基因株系进行PCR验证,结果表明转正、反义PeTUA3植株和阳性对照质粒(pGEM-T easy+PeTUA3)中均检测到目的基因,而野生型植株中没有(图5B),证明了转基因植株的真实性。
对T3代转基因植株进一步观察发现,在垂直板上正义表达的拟南芥植株生长较快,主根生长旺盛,且有一定的侧根,叶片面积大于野生型植株; 而反义表达的转基因植株生长受阻,主要表现为植株生长弱小,主根较短,侧根多且短,叶片面积略小于野生型植株(图6A)。跟踪观察测量转基因拟南芥主根生长状况表明,在第3~5天,转正、反义PeTUA3以及野生型拟南芥主根生长状况基本一致; 在第5天之后,转正义PeTUA3和野生型生长较快,平均生长速率分别为6.0、5.5 mm·d-1,转反义PeTUA3拟南芥生长非常缓慢(仅为1.0 mm·d-1),第8天之后生长几乎停滞(图6B)。

图5 PeTUA3表达载体及转基因拟南芥植株检测Fig.5 Expression vectors of PeTUA3 and the detection of transgenic Arabidopsis plantsA: 正、反义表达载体; B: PCR检测(1-3: 转基因正义植株; 4-6: 转基因反义植株; 7: 野生型对照; 8: 质粒DNA对照; M: DNA分子量标记)。A: Sense and antisense expression vectors; B: Detected by PCR(1-3: Sense transgenic plants; 4-6: Antisense transgenic plants; 7: Wild-type control; 8: Plasmid DNA control; M: DNA molecular weight marker).

图6 转PeTUA3基因拟南芥植株表型分析Fig.6 Phenotype analysis of PeTUA3 transgenic Arabidopsis plantsA: 培养10天植株的表型(a: 野生型 Col-0; b: 正义; c: 反义); B: 主根长度变化。A: Phenotype of plants cultivated for 10 d(a: Wild type Clo-0; b: Sense; c: Antisense); B: Length changes of the main roots.
2.7 转基因拟南芥不同组织中PeTUA3的定量表达分析
在转正义基因拟南芥植株的根、茎、叶和花序组织中,PeTUA3均有表达,其中以根中的表达量最高,其次是花序和茎,在叶片中的表达量最低; 在野生型中则是花序中最高,叶片中次之,根和茎相似,均比较低,但所有组织中的表达量均远低于对应的转基因植株的组织(图7)。转基因拟南芥的根、茎、叶、花中,PeTUA3的表达量分别约是野生型的6 400倍、1 700倍、190倍和300倍,均达到差异极显著水平(P< 0.01)。
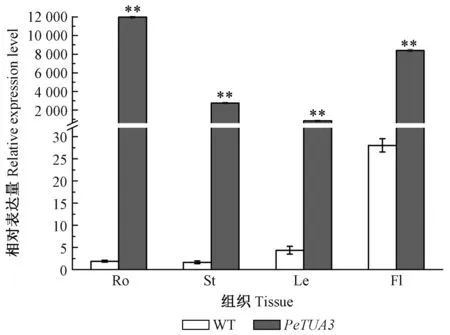
图7 PeTUA3在转基因拟南芥和野生型拟南芥中的相对表达量Fig.7 Relative expression level of PeTUA3 in transgenic and wild type of Arabidopsis thalianaRo: 根; St: 茎; Le: 叶; Fl: 花。图中为平均值±标准误; 星号表示t检验结果,**表示差异极显著(P < 0.01)。Ro: Root; St: Stem; Le: Leaf; Fl: Flower. Values are means ± standard error. The double stars indicate significant difference at 0.01 level of the gene expression in different tissues according to Student’s t test.
3 讨论
随着木材供给不足,市场需求增加,竹材在一定程度上可以替代部分木材,被广泛运用于建材、家具以及生活工艺品等各个方面(江泽慧, 2002),因此人们对竹材的形成与调控给予了高度关注。微管蛋白是植物细胞骨架的重要组成部分,指导细胞壁的生物合成和细胞生长,间接影响植物的机械强度以及材性。虽然对植物微管蛋白的研究起步较早,在包括拟南芥(Kopczaketal., 1992; Snustadetal., 1992)、水稻(Eonetal., 2000; Oshikawaetal., 2003)、毛果杨(Oakleyetal., 2007)和陆地棉(Whittakeretal., 1999; Heetal., 2008)等多种植物中得到开展,而对于毛竹微管蛋白的研究相对较少。随着现代生物技术的不断提高,基因组和转录组数据的完善与丰富,为毛竹微管蛋白成员的基因结构和功能预测提供了很好的基础(江泽慧, 2012)。本研究基于基因组和转录组数据对毛竹微管蛋白基因结构及其表达模式进行分析,同时对PeTUA3的功能进行初步研究,结果对于揭示微管蛋白基因在毛竹快速生长和优良材性中的作用具有重要的参考价值。
不同物种中微管蛋白的数量存在着一定的差异,如TUA蛋白和TUB蛋白在拟南芥中分别为6个(Kopczaketal., 1992)和9个(Snustadetal., 1992),水稻中分别为4个和8个(Eonetal., 2000; Oshikawaetal., 2003),毛果杨中分别为8个和20个(Oakleyetal., 2007)。本研究在毛竹中共鉴定出18条微管蛋白(6个TUA和12个TUB),基因结构和基序分析发现,虽然TUA亚家族和TUB亚家族成员之间存在一定的差异,但大多都包含共有的保守基序,表明毛竹微管蛋白在功能上是保守的。系统进化分析表明,毛竹微管蛋白2个亚家族成员分别聚类到6个亚组中,这与前人研究(Oakleyetal., 2007;饶国栋等, 2015)一致,其中有5对在进化树中以成对的形式出现,说明它们可能来自串联重复序列的复制(Meagheretal., 2003; 饶国栋等, 2015)。而且毛竹微管蛋白均与水稻的聚类在较近的位置,表明在进化过程中毛竹与水稻的亲缘关系较近(Pengetal., 2013),聚类在一起的成员可能具有相似的功能。利用生物信息学方法对毛竹微管蛋白基因的筛选和分析,对于了解毛竹微管蛋白基本特征具有重要价值,为进一步深入研究其功能提供了参考依据。
基因的表达是其发挥生物学功能的重要表现形式之一。根据转录组数据得到的组织特异性表达结果表明,不同微管蛋白基因在毛竹不同组织中表达量各不相同,对它们在不同高度笋中的定量表达分析进一步证实了它们时空表达的差异性,表明它们在不同组织中发挥功能存在一定的差异。TUA亚家族所有成员以及TUB亚家族中的8个基因均随着毛竹笋高度的增加表达量呈现上调趋势,推测这些基因在笋快速生长时期发挥着重要作用; 而TUB亚家族的其他4个基因在笋的生长过程中表达量表现为波动趋势。不同基因随笋的生长而表现出的差异表达的原因还有待于更深入的研究来揭示。过量表达PeTUA3能够影响拟南芥生长,尤其是对根系,转正义基因植株主根明显增长,而反义的主根明显变短。转反义PeTUA3拟南芥的主根在第5天后生长速度明显减缓,这与转反义拟南芥TUA6的表型(Baoetal., 2001) 相类似。另外,进一步对转基因拟南芥中基因表达检测结果表明,正义拟南芥不同组织中PeTUA3的表达量显著提高,尤其根中最高,这与主根生长明显增长的表型相一致。推测PeTUA3在毛竹生长发育过程中也发挥着类似的促进作用,通过促进根系的生长来提高养分吸收而实现快速生长,但对于其在毛竹中的具体功能还需要进一步试验来证明。
4 结论
本研究从毛竹中获得18个微管蛋白基因,包含TUA亚家族成员6个(PeTUA1-PeTUA6)和TUB亚家族成员12个(PeTUB1-PeTUB12),其基因结构存在着一定的差异。毛竹微管蛋白属于比较保守的蛋白,18个微管蛋白共有的保守基序为11个。各微管蛋白基因在毛竹不同组织以及不同发育阶段笋中的表达模式不尽相同,表明各基因功能的发挥具有差异性和时空性。在拟南芥中正义表达PeTUA3能够促进转基因拟南芥的生长,而反义表达PeTUA3则抑制转基因拟南芥的生长,表明PeTUA3对毛竹的快速生长可能具有重要的作用。
