血清前白蛋白与肺癌根治术后并发症的相关性研究
2020-08-12王国安汪斌郭金宝
王国安,汪斌,郭金宝
(重庆医科大学附属第一医院胸心外科,重庆)
0 引言
肺癌是威胁人类健康和生命安全的恶性肿瘤之一,世界范围内每年约有100 万~130 万人死于肺癌。在我国肺癌也成为威胁人类生命的首位恶性肿瘤,每年死亡人数约为50-60 万, 且有逐年增加的趋势[1]。其发病率及死亡率均跃居恶性肿瘤的首位。尽管目前对于肺癌的治疗趋向于走入个体化靶向治疗及分子免疫治疗的时代,但目前仍以“以手术治疗为中心的多学科联合治疗”方式为主导,故手术治疗在肺癌,尤其是非小细胞肺癌的治疗中仍占有不可替代的地位[2],但是手术治疗后所出现的术后并发症却成为影响肺癌根治术治疗效果的主要因素之一。血清前白蛋白(PA)是由肝脏合成的4个相同亚基组成的四聚体,生物半衰期1.9 天(白蛋白17~21 天), 正常值约在172~368mg/L 之间[3]。PA 的主要生理功能是结合、运输维生素A 和甲状腺素,从而参与它们的调节[4]。目前,临床主要用于评估肝功能损害和营养不良,同时也是药物中毒引起肝损害的敏感指标。近年来,国内外研究均显示PA在外科围术期、营养不良、炎症反应时变化明显[5,6]。已有学者指出PA 在腹部手术、消化道手术后并发症的提示方面发挥着积极作用[7]。本研究旨在探究PA 与肺癌术后各并发症之间的相关性,对PA 预测肺癌术后并发症提供理论支持。在临床上,对低PA 水平患者进行重点观察,必要时进行早期临床干预。
1 研究对象与研究方法
1.1 研究对象
收集重庆医科大学附属第一医院胸心外科2014年6月至2019年6月接受肺癌根治术的患者。
1.2 纳入标准与排除标准
纳入标准:重医附一院胸心外科接受肺癌根治术的患者;手术方式均为电视胸腔镜下行单一肺叶切除+淋巴结清扫术;术后第2-5 天完善前白蛋白检查;患者术后病历资料记录、保存完整。
排除标准:术前合并感染的患者;合并糖尿病且血糖控制不佳或其他严重合并症的患者;术前白蛋白<100mg/L 的患者;年龄大于75岁或术前一般状况较差的患者。
1.3 研究方法
通过纳入标准及排除标准筛选患者,查阅相关病历资料,收集各患者术前与术后2-5 天PA 值,同时收集患者年龄、性别、手术部位、FEV1%、吸烟指数、饮酒史、BMI、术中出血量、清扫淋巴结组数、引流时间以及是否合并高血压、糖尿病、心血管疾病、呼吸系统疾病,并统计各患者并发症信息,并完成分组。
1.4 统计学方法
采用SPSS 22.0 进行统计分析,总体样本均数比较采用单因素方差分析(ANOVA),事后并发症组与对照组间的两两比较采用Dunnett-t检验。阳性结果组与对照组PA 之间采用ROC 曲线分析分别计算术后PA 最佳临界值。后对阳性结果组建立logistic 回归分析模型,判断前白蛋白与术后并发症之间相关性大小。
2 结果
2.1 收集数据
共收集符合纳入标准及排除标准患者268例,同时根据并发症及并发症类型分为:并发症组 86例,无并发症组(对照组) 182例。其中并发症组根据并发症类型分为:肺部感染组 40例,胸引量增多组 9例,心率失常组 9例,肺不张(漏气)组 14例,肺栓塞组 2例,静脉血栓组 2例,乳糜胸组 2例。此外,尿路感染、凝血象异常、心跳呼吸骤停、切口感染、脓胸、出血、心衰、呼衰患者各1例(乳糜胸组有1例未检测术前PA,尿路感染、凝血象异常等各组因只有1例样本量无法进行统计学比较,故舍去)。
注:胸引量增多定义为术后连续5 天胸腔闭式引流量≥300mL,但不包括因活动性出血导致胸引量增多的患者。临床中存在部分患者胸引持续偏多,但无感染、乳糜胸等症状,临床中无特殊治疗,延长患者住院时间(甚至部分患者带管出院)、增加患者住院费用、占用医疗资源、影响就医体验,故将胸引量增多列为并发症。
2.2 各并发症组与对照组PA 水平单因素分析
2.2.1 术前PA 比较
各并发症组术前PA 水平与对照组相比较差异均无统计学意义(P>0.0.5),见表1。
2.2.2 术后PA 比较
并发症各组术后第2-5 天PA 水平与对照组比较,其中肺部感染组及胸引量增多组与对照组之间差异有统计学意义(分别为P<0.001、P<0.01),而心率失常、肺漏气、肺栓塞、静脉血栓、乳糜胸各组患者术后PA 与对照组之间差异无统计学意义(P均>0.05),见表2。
2.3 对肺部感染组及胸引量增多组进行ROC 曲线分析
2.3.1 ROC 曲线分析-肺部感染
肺部感染组与对照组术后之间PA 进行ROC 曲线分析:曲线下面积为:0.787,通过约登指数找出PA 最佳临界值为 119.5mg/L,此时,此时该指标预测肺部感染敏感度为:67.5%,特异度为:74.7%。见图1。
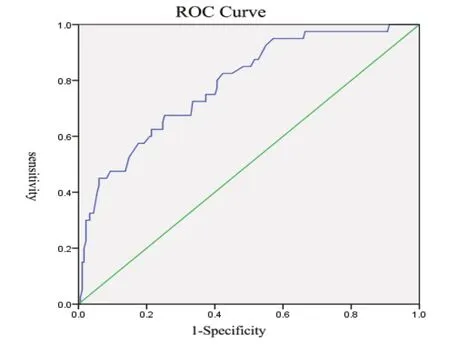
图1 肺部感染与对照组ROC 曲线
2.3.2 ROC 曲线分析-胸引量增多
胸引量增多组与对照组术后之间PA 进行ROC 曲线分析,曲线下面积为0.814,通过曲线坐标及约登指数找出胸引量组与对照组之间PA 最佳临界值为:121.5mg/L。此时该指标预测胸引增多敏感度为:77.8%,特异度为:72.5.%。见图2。
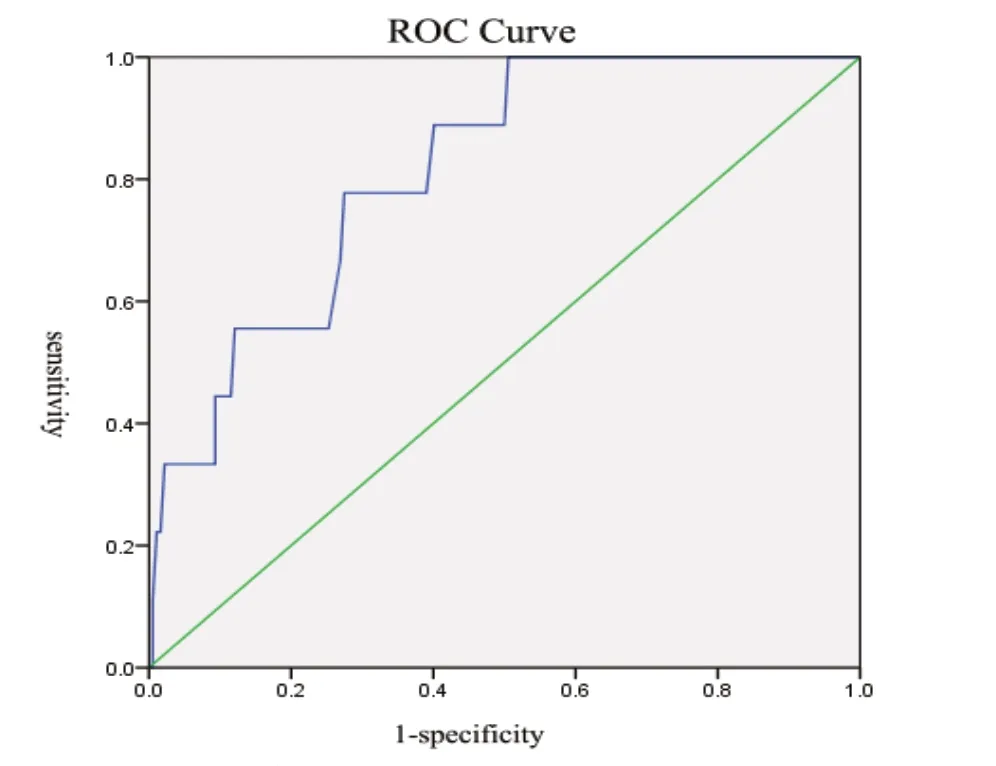
图2 胸引量增多与对照组ROC 曲线
肺部感染组及胸引量增多组与对照组之间PA 最佳临界值分别为119.5mg/L、121.5mg/L,为方便临床应用及记忆,可取整为120mg/L。
2.4 Logistic 回归分析
分别对肺部感染、胸引量增多患者根据其常见危险因素(年龄、性别、手术部位、术前PA、术后PA、FEV1%、吸烟指数、饮酒史、BMI、术中出血量、清扫淋巴结组数、引流时间以及是否合并高血压、糖尿病、心血管疾病、呼吸系统疾病)建立Logistic 回归分析模型。
2.4.1 Logistic 回归分析-肺部感染
对术后肺部感染而言,术后PA<120mg/L、FEV1%<60%、吸烟指数>400 支×年、BMI>24.0Kg/m2、术前合并糖尿病及呼吸系统疾病、更长的引流天数预示着术后更高的肺部感染率。(详见表3)

表1 术前PA 比较

表2 术后PA 比较
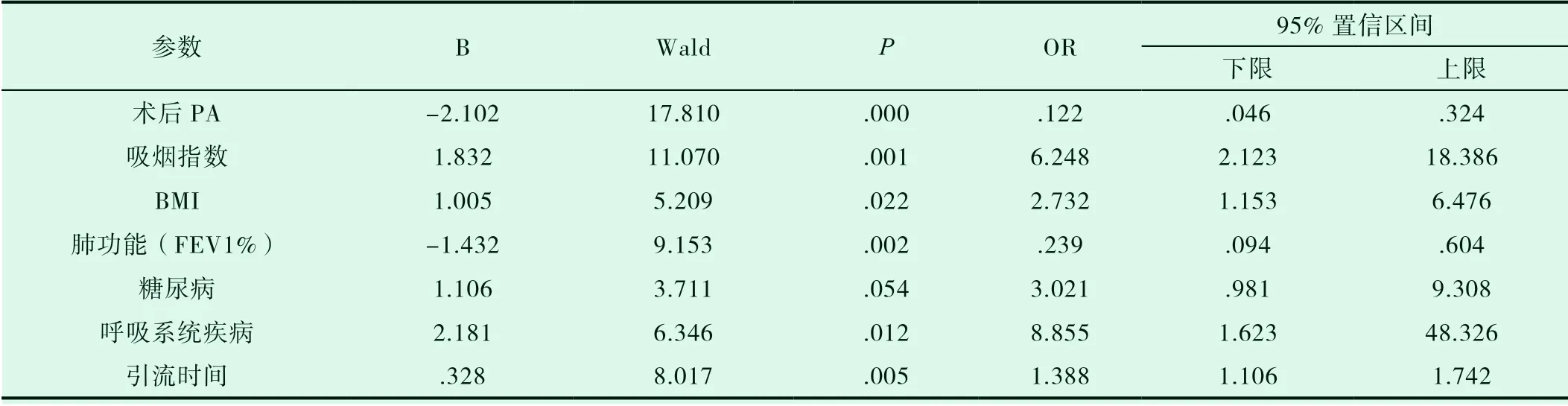
表3 肺部感染的Logistic 回归分析
2.4.2 Logistic 回归分析-胸引量增多
对术后胸引而言,术后PA<120mg/L、清扫更多的淋巴结组数以及更长的引流天数与术后患者胸引量增多密切相关。(详见表4)

表4 胸引量增多的Logistic 回归分析
3 讨论
据《A Cancer Journal for Clinicians》(CA)杂志统计:2018年肺癌占全球癌症总发病率的11.6%、总死亡率的18.4%,均为第一。而在我国肺癌发病率及死亡率均为第一的恶性肿瘤。到目前为止,手术治疗仍为治疗早中期非小细胞肺癌的主要手段,患者术后因手术打击或体液丢失导致多数患者术后前三天前白蛋白迅速下降[8],随着患者营养补充、炎症控制、引流减少等因素,患者前白蛋白缓慢上升。患者术后因禁食、禁饮、出血、体液丢失、术后进食差等因素,营养状态明显变差,因而对大多数患者术后前白蛋白存在一个降低过程,相关研究显示,营养状态是肺癌病人手术后死亡和并发症发生的重要预测因子[9,10]。而PA 半衰期短,在体内合成、代谢快,仅1.9 天,和传统营养指标白蛋白(半衰期约为20 天)相比,其更能反应短期内体内蛋白质代谢状况,是目前国际上评价营养状态和监测营养支持效果的有效常用指标[11,12],当患者营养状态低下时,易导致集体免疫力下降、切口组织增生减缓、胶体渗透压降低等,从而引起肺部感染、切口愈合不良、胸引增多、精神差等情况。同时,当体内前白蛋白处于低水平时,提示体内蛋白缺乏,机体合成免疫球蛋白、免疫因子减少、免疫细胞增殖缓慢等,将导致免疫应答迟缓。同时,前白蛋白本身具有免疫活性,PA 作为由肝脏组织合成的负急性时相反应蛋白,它是一种非特异性的宿主防御性物质,可以清除感染过程中释放于机体循环中的有毒代谢物,通过与细菌内毒素结合,直接参与免疫应答过程,所以在呼吸道感染急性时相反应过程中,PA 能迅速降低,特别在细菌感染疾病中更为明显[13,14]。国外研究显示, 虽然PA 的高低与多个因素有关,但其与炎症反应的相关性最强[15]。此外,PA 能参与甲状腺素和维生素A 的调节,甲状腺可调节机体的物质与能量代谢;维生素A 是指所有具有视黄醇生物活性的化合物,可以提高细胞免疫功能,促进免疫细胞产生抗体,以及促进T 淋巴细胞产生某些淋巴因子,因此PA 可间接促进患者术后机体的愈合及免疫功能。目前已有研究证实前白蛋白在社区获得性肺炎、全身炎症反应综合征、多器官功能衰竭、心力衰竭、急性胰腺炎中血清前白蛋白的作用得到认可,且其水平高低与疾病严重程度呈负相关,对其预后有一定参考价值[16-18]。故而对血清PA持续低水平的患者,其预后较差,死亡率高,应提高警惕。
本研究发现患者术后前白蛋白会出现生理性降低,其中术后肺部感染、胸引量增加患者降低更为明显,而其它并发症组患者与对照组相比术后PA 水平无统计学差异,提示术后低PA 水平更易出现肺部感染及胸引量增加。通过ROC分析可知术后2-5 天中出现前白蛋白低于120mg/L 的患者发生肺部感染、胸引量增加的风险较其他患者更大,通过Logistics 回归分析显示,PA 水平的降低对术后肺部感染及胸引量增多有一定的关联。
综上所述,血清前白蛋能更灵敏的反应机体术后营养水平,同时还具有一定免疫活性,直接或间接参与免疫应答。而患者围术期无论是蛋白质摄入、炎症反应还是体液丢失,都将导致患者术后PA 水平降低,故认为术后低PA水平提示患者发生并发症可能性较大。虽然目前PA 与肺癌术后并发症之间的相互作用机制尚不完全明确,但对于术后前白蛋白水平小于120mg/L 的患者均应进行重点观察,必要时早期进行临床干预。
