芝麻粕植酸的超声波辅助提取工艺优化及其抗氧化活性研究
2020-08-11钱森和胡刘秀薛正莲
钱森和,郑 鹏,周 炎,胡刘秀,王 洲,薛正莲
(1.安徽工程大学 生物与化学工程学院,安徽 芜湖 241000; 2.芜湖张恒春药业有限公司,安徽 芜湖 241000)
植酸(Phytic acid),又名环己醇六磷酸酯,是一种有机磷酸类化合物,是植物种子中磷的主要来源[1]。植酸广泛存在于植物的种子、根和茎中,其中以豆科植物的种子、谷物的麸皮和胚芽中含量最高[2]。植酸呈无色或淡黄色,是一种无味稠状液体,易溶于水、乙醇,不溶于醚等有机溶剂[3]。由于植酸无毒副作用、安全可靠,在食品抗氧化剂、稳定剂、护色剂、保鲜剂等方面应用广泛;在医药工业中可用于治疗糖尿病、肾结石等病症;另外,植酸可以作为肌醇生产的重要原料[4]。
芝麻粕是芝麻制油的副产物,我国是芝麻生产大国,芝麻粕产量较大,而芝麻生产企业大多将芝麻粕作为廉价肥料或基质出售,很大程度上降低了芝麻生产的附加值[5-6]。芝麻粕中不仅含有大量的蛋白质、木脂素、纤维素和维生素类物质,而且还含有丰富的植酸类物质,是提取植酸的良好原料[7-8]。目前,芝麻粕中蛋白质、活性肽、木脂素的提取及其功能研究较多,而芝麻粕中植酸提取的研究鲜有报道[9-10]。因此,本文以芝麻粕为材料,利用单因素试验和响应面试验优化植酸的超声波辅助提取工艺,并对提取的植酸进行还原力及DPPH自由基、羟自由基清除能力测定,以期为芝麻粕中植酸的开发利用提供一定的理论基础。
1 材料与方法
1.1 试验材料
芝麻粕,由水代法制油得到,取自芜湖市同顺和小磨麻油食品厂,其含水量为12.1%、粗灰分含量为12.2%(干基)、粗蛋白质含量为37.8%(干基)、粗脂肪含量为4.1(干基)、植酸含量为3.8%(干基),粉碎后过100目筛。三氯化铁、三氯乙酸、磺基水杨酸、铁氰化钾、DPPH、邻二氮菲、VC、醋酸,分析纯。
TU-1800紫外可见分光光度计,北京普析通用仪器有限责任公司;FC104电子天平,上海精密科学仪器公司;HH-6数显恒温水浴锅,江苏金坛市亿通电子有限公司;PHSJ-3F酸度计,上海雷磁仪器厂;TGL-16型离心机,湖南湘仪实验室仪器开发有限公司。
1.2 试验方法
1.2.1 植酸的提取
称取10 g粉碎过筛的芝麻粕于250 mL具塞三角瓶中,按一定的料液比加入一定质量分数的醋酸溶液,在不同的超声波功率下超声处理不同时间,然后在一定提取温度条件下提取一定时间,随后3 000 r/min离心10 min,测定提取液中植酸含量。不同处理试验重复3次,下同。
1.2.2 提取液中植酸含量的测定
取植酸提取液25 mL,调节pH至1.8~2.5,在水浴上加热至60℃,加10滴10%磺基水杨酸溶液,用0.02 mol/L三氯化铁溶液滴定至紫红色,按下式计算植酸质量。
m=c×V×0.235 7
式中:m为植酸质量,g;c为三氯化铁溶液质量浓度,mol/L;V为滴定耗去的三氯化铁溶液量,mL;0.235 7为换算系数,由每摩尔植酸可络合2.8 mol FeCl3换算得到。
植酸提取率=提取液中植酸质量/(芝麻粕质量×芝麻粕中植酸含量)×100%。
1.2.3 还原力的测定
取植酸提取液0.5 mL于试管中,加入pH为6.6的0.2 mol/L磷酸盐缓冲液和1.0%铁氰化钾溶液各2.5 mL,充分混匀后50℃保温20 min,置于冰浴中冷却,随后加入2.5 mL 10%的三氯乙酸溶液,混合后3 000 r/min离心10 min。取上清液2.5 mL,加入0.1%三氯化铁溶液0.5 mL和蒸馏水2 mL,混匀后静置10 min,测定其在700 nm处的吸光值[11]。
1.2.4 DPPH自由基清除率的测定
取1 mL样品与4 mL 0.02 mmol/L DPPH-无水乙醇溶液混合,混匀后在室温条件下避光放置30 min,混合液于3 000 r/min离心5 min,取上清液,测定517 nm处的吸光值,用体积比1∶1的无水乙醇与水混合液作为参比[12]。
C=[1-(A1-A2)/A0]×100%
式中:C为DPPH自由基清除率;A0为空白对照(DPPH-无水乙醇)的吸光值;A1为加入样品时DPPH(样品+DPPH-无水乙醇)的吸光值;A2为样品(样品+无水乙醇)的吸光值。
1.2.5 羟自由基清除率的测定
取7.5 mmol/L邻二氮菲溶液0.2 mL、7.5 mmol/L FeSO4溶液0.2 mL、pH 7.4 PBS溶液2.0 mL、1.0%H2O20.4 mL、样品溶液0.4 mL、蒸馏水0.8 mL于试管中并充分混匀,置于37℃的恒温水浴60 min后,测定其在536 nm处的吸光值[13]。
COH=(A2-A0)/(A1-A0)×100%
式中:COH为羟自由基的清除率;A0为蒸馏水代替样品测得的吸光值;A1为蒸馏水代替H2O2测得的吸光值;A2为加入样品的吸光值。
1.2.6 数据处理
采用Excel 2010软件进行数据整理和作图,SAS 9.1统计分析软件进行响应面设计及其回归分析。
2 结果与分析
2.1 单因素试验
2.1.1 超声波功率对植酸提取的影响
在醋酸质量分数10%、料液比1∶10、超声波时间15 min、提取温度50℃、提取时间60 min的条件下,考察超声波功率对植酸提取的影响,结果见图1。
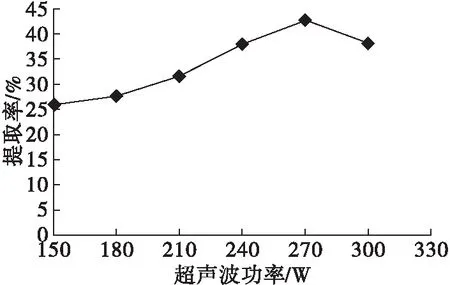
图1 超声波功率对芝麻粕植酸提取率的影响
由图1可知,随着超声波功率的增大,植酸提取率逐渐升高,当超声波功率为270 W时,植酸提取率达到最大值,继续增加超声波功率,植酸提取率反而下降。超声波产生的空化作用能够有效地破坏细胞壁,从而有利于植酸的溶出,因此通过适当功率的超声波处理芝麻粕可以促进植酸的提取。然而,超声波功率过大,超声波的空化作用增强,可能造成植酸的破坏,使得植酸的提取率降低[14]。因此,选择超声波功率为270 W较为适宜。
2.1.2 超声波时间对植酸提取的影响
在醋酸质量分数10%、料液比1∶10、超声波功率270 W、提取温度50℃、提取时间60 min条件下,考察超声波时间对植酸提取的影响,结果见图2。
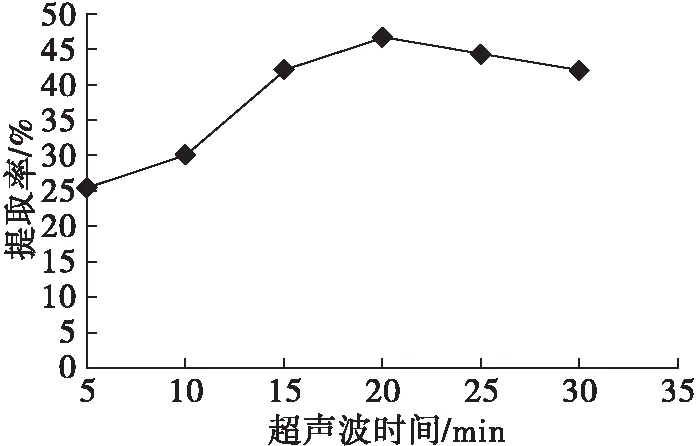
图2 超声波时间对芝麻粕植酸提取率的影响
由图2可知,随着超声波时间的延长,植酸提取率逐渐升高,当超声波时间为20 min时,植酸提取率达最大值,而后随着超声波时间的继续延长,植酸提取率反而下降。这是由于合适的超声波时间,能够有效地破碎细胞壁,使得溶出物增多,植酸提取率升高。而超声波时间过长,可能会导致细胞壁纤维网络结构松散,从而使植酸进入纤维素结构中而不易溶出[15]。综上,选择超声波功率270 W、超声波时间20 min进行后续优化试验。
2.1.3 醋酸质量分数对植酸提取的影响
在超声波功率270 W、超声波时间20 min、料液比1∶10、提取温度50℃、提取时间60 min条件下,考察醋酸质量分数对植酸提取的影响,结果见图3。
由图3可知,醋酸质量分数对植酸提取影响较大。随着醋酸质量分数的增大,植酸提取率逐渐增大,当醋酸质量分数为15%时,植酸提取率达最大值。这可能是由于随着醋酸浓度升高,植酸的络合能力逐渐降低,溶出增多。但提取液的醋酸质量分数过高,导致pH升高,使酸性多糖、蛋白质等酸溶性成分游离出来,又重新与植酸结合成螯合状态,从而使植酸的溶解度下降。因此,选择醋酸质量分数为15%较为适宜。
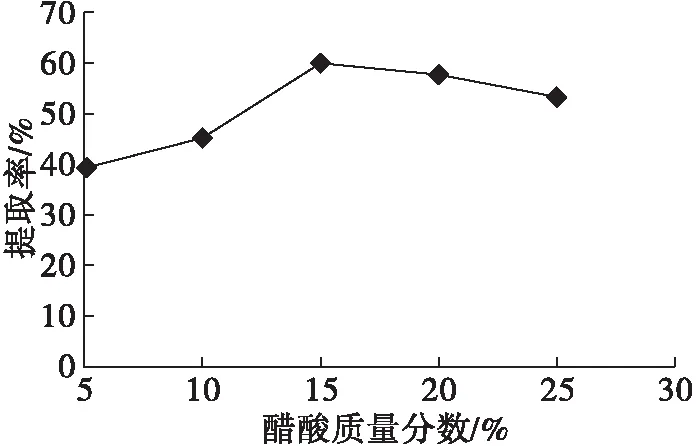
图3 醋酸质量分数对植酸提取率的影响
2.1.4 料液比对植酸提取的影响
在超声波功率270 W、超声波时间20 min、醋酸质量分数10%、提取温度50℃、提取时间60 min的条件下,考察料液比对植酸提取的影响,结果见图4。
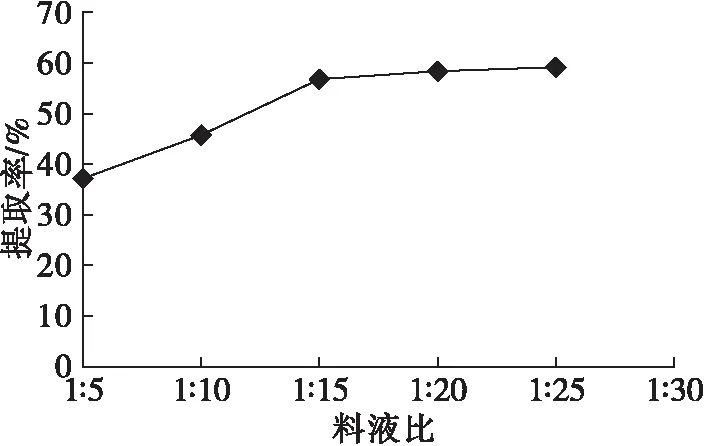
图4 料液比对植酸提取率的影响
由图4可知,植酸提取率随料液比的增加而增加。料液比较小,则芝麻粕不能被完全浸透,不能完全破坏植酸与其他物质的结合,从而影响植酸的提取。若料液比过大,植酸提取率提高,但增加了后续浓缩工序,使得能耗增加。在料液比高于1∶15后,植酸提取率增加不明显,因此选择料液比1∶15较为适宜。
2.1.5 提取温度对植酸提取的影响
在超声波功率270 W、超声波时间20 min、醋酸质量分数10%、料液比1∶10、提取时间60 min的条件下,考察提取温度对植酸提取的影响,结果见图5。
由图5可知:当提取温度低于50℃时,植酸提取率随提取温度的升高而升高,主要是因为分子动能的增大有利于植酸的提取;当提取温度高于50℃时,植酸提取率有所下降,可能是由于芝麻粕中蛋白质等物质的溶出,与具有6个磷酸根独特结构的植酸结合而沉淀,使得植酸提取率下降。因此,较适的提取温度为50℃。
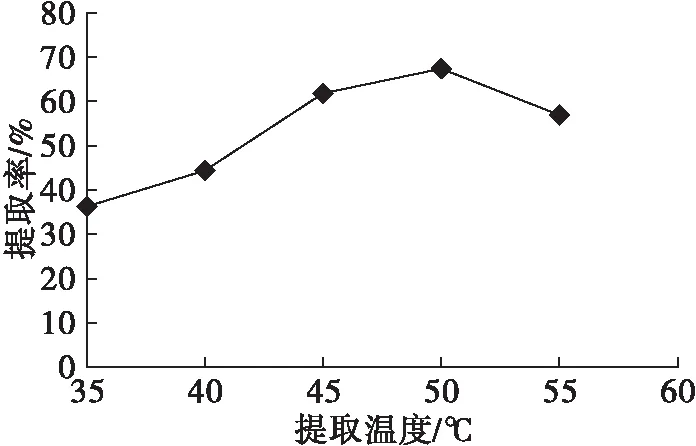
图5 提取温度对植酸提取率的影响
2.1.6 提取时间对植酸提取的影响
在超声波功率270 W、超声波时间20 min、醋酸质量分数10%、料液比1∶10、提取温度50℃的条件下,考察提取时间对植酸提取的影响,结果见图6。
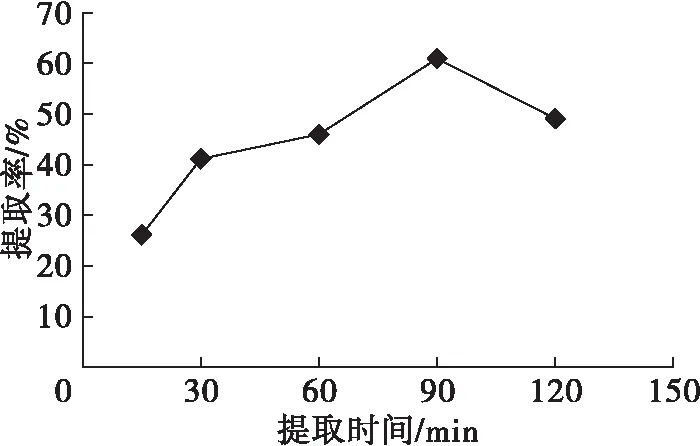
图6 提取时间对植酸提取率的影响
由图6可知,在提取时间为15~90 min范围内,植酸提取率随提取时间的延长而增加,当提取时间长于90 min时,其提取率有所下降。这是由于芝麻粕中的植酸由固相迁移至提取液的过程是一个缓慢达到传质平衡的过程,因而随着提取时间的延长,提取液中植酸含量增大。然而,在一个长时间低pH和较高反应温度条件下致使植酸在一定程度上发生氧化,从而导致提取率有所下降。因此,选择最适提取时间为90 min。
2.2 响应面试验
在单因素试验的基础上,采用Box-Behnken中心组合设计,对影响植酸提取过程中的醋酸质量分数(X1)、料液比(X2)、提取温度(X3)和提取时间(X4)4个因素设计四因素三水平中心组合试验,响应面试验设计及结果见表1,回归模型分析见表2。
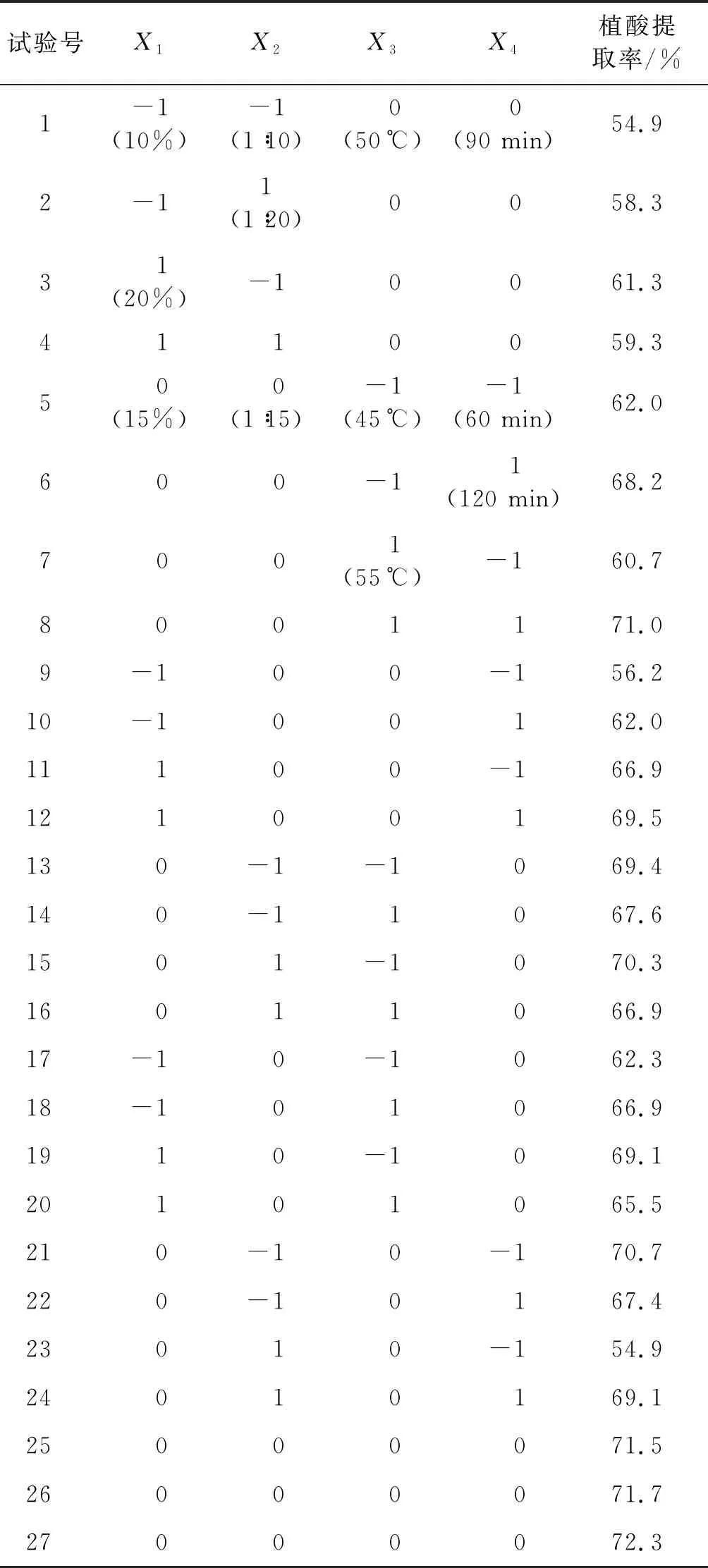
表1 响应面试验设计及结果
从表2可以看出:响应面模型P<0.05,说明该模型达到显著水平;醋酸质量分数、提取时间、料液比与提取时间的交互作用对植酸的提取具有显著影响,醋酸质量分数的二次项、料液比的二次项对植酸的提取具有极显著影响。提取时间对植酸提取率的影响最大,醋酸质量分数次之,而提取温度和料液比的影响较小。模型的复相关系数(R2)为0.90,说明该回归方程可以准确地预测不同提取条件对植酸提取率的影响。
通过回归分析,最优点X1、X2、X3、X4对应的代码分别为0.084 471、0.224 161、0.298 996、0.805 674,其实际值为15.42%、1∶16.12、51.49℃、114.17 min,此时植酸提取率的最大理论拟合值为72.77%。在醋酸质量分数15%、料液比1∶16、提取温度51℃和提取时间115 min的条件下进行验证试验,芝麻粕的植酸提取率为73.24%,与理论拟合值差别不大。
2.3 芝麻粕植酸抗氧化活性
2.3.1 植酸的还原力(见图7)
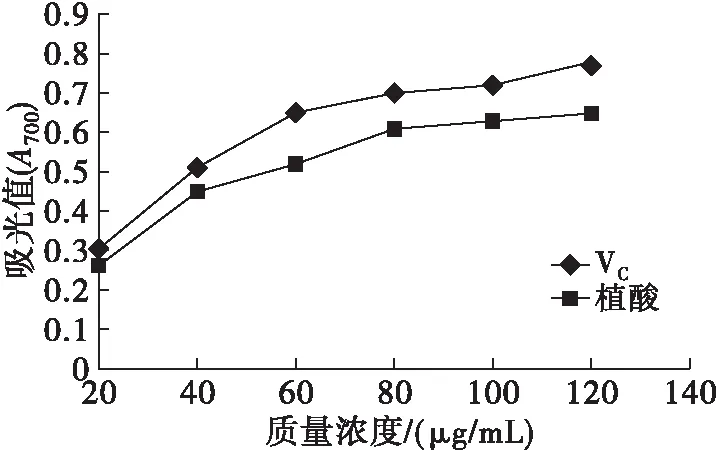
图7 芝麻粕植酸的还原力
由图7可知,芝麻粕植酸的还原力略低于VC,但仍具有一定的还原力。随着芝麻粕植酸质量浓度的增加,其还原力逐渐增强;当植酸质量浓度达到80 μg/mL后,随着其质量浓度的进一步增加,还原力变化不明显。
2.3.2 植酸的DPPH自由基清除能力(见图8)
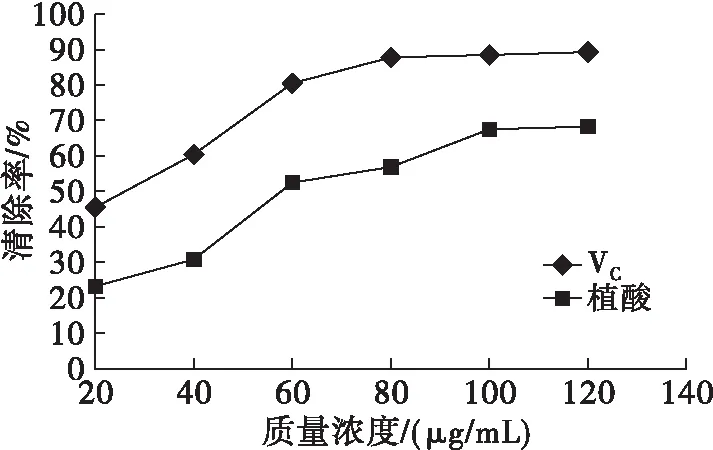
图8 芝麻粕植酸的DPPH自由基清除能力
由图8可知,芝麻粕植酸的DPPH自由基清除能力略低于VC,当质量浓度为120 μg/mL时,VC的DPPH自由基清除率为89.1%,芝麻粕植酸的 DPPH 自由基清除率为68.2%,说明芝麻粕植酸仍具有一定的DPPH自由基清除能力。另外,随着芝麻粕植酸质量浓度的增加,其DPPH自由基清除率逐渐增加,当植酸质量浓度为100 μg/mL时,DPPH自由基清除率基本达到峰值。
2.3.3 植酸的羟自由基清除能力(见图9)
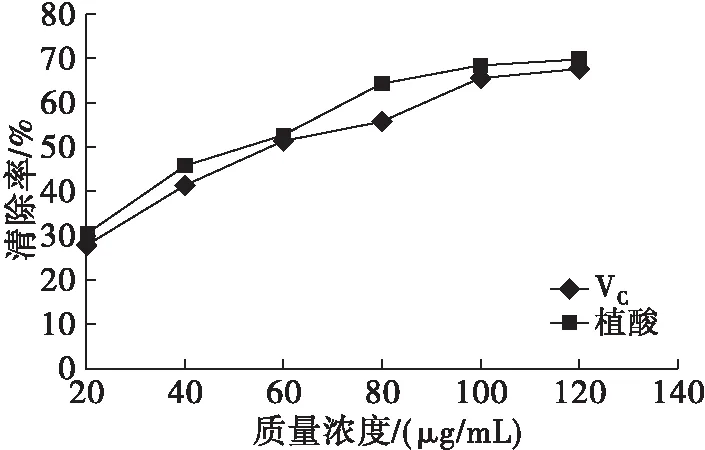
图9 植酸的羟自由基清除能力
由图9可知,芝麻粕植酸的羟自由基清除能力与VC相当,当质量浓度在20~100 μg/mL之间,其羟自由基清除率随着质量浓度的增加而增加,当质量浓度为120 μg/mL时,植酸和VC的羟自由基清除率分别为69.6%和67.8%。
3 结 论
采用超声波辅助醋酸法提取芝麻粕植酸,采用单因素试验和正交试验对提取工艺进行优化,并对所提取植酸的抗氧化活性进行了研究。结果表明,芝麻粕植酸的最佳提取工艺条件为超声波功率270 W、超声波时间20 min、醋酸质量分数15%、料液比1∶16、提取温度51℃、提取时间115 min,在此条件下芝麻粕植酸提取率为73.24%。芝麻粕植酸具有一定抗氧化活性,其最大还原力、DPPH自由基清除率和羟自由基清除率的植酸质量浓度分别为80、100 μg/mL和120 μg/mL,其中当植酸质量浓度为120 μg/mL时,其羟自由基清除率与VC相当。
