纳米HNS、TATB 及LLM⁃105 的RAW264.7 巨噬细胞毒性及其机制
2020-08-10范美坤
唐 灿,黄 兵,刘 柳,范美坤,周 阳
(1. 中国工程物理研究院化工材料研究所,四川 绵阳 621999;2. 西南交通大学地球科学与环境工程学院,四川 成都 611756)
1 引言
含能材料纳米化以后表现出低压长脉冲钝感、高压短脉冲敏感等独特性能,以及在微型点火、起爆装置及冲击片雷管等方面展现出的广阔应用前景,受到了学者的关注[1-3]。但是,纳米含能材料的生物安全问题却鲜有报道。有资料显示,梯恩梯(TNT)、黑索今(RDX)、泰安(PETN)等典型炸药可以引起肝、肾、血液及神经等组织器官毒性效应,并有致癌、致畸、致突变的潜在风险[4]。另外,流行病学调查发现,环境中的超细纳米颗粒一般比微米颗粒对人体健康造成危害更大[5],且尺寸越小,显示出生物毒性的倾向越大[6-7]。
纳米化的TATB、HNS 和2,6⁃二氨基⁃3,5⁃二硝基吡嗪⁃1⁃氧化物(LLM⁃105)是含能材料领域最具有工业化应用潜力的炸药之一,其中超细HNS 已经在常规武器中得到了大量应用[1]。但目前关于TATB、HNS和LLM⁃105 生物毒性报道较少。Jorgenson 等[8]研究了常规粒径TATB 对大鼠和小鼠的急性经口毒性,得出半数致死剂量(LD50)>5 g·kg-1;同时还发现TATB对哺乳动物的皮肤和眼仅具有轻微且短暂的刺激作用。Yu 等[9]研究了LLM⁃105 对小鼠急性经口毒性,发现小鼠的死亡率为10%~20%,其最小致死剂量为10%;对新西兰兔进行皮肤染毒,则未见异常。另外,大量研究已表明,纳米材料的生物效应与常规尺寸材料明显不同,如微米铜粉被认为是无毒的,但纳米铜则可以显著引起哺乳动物(H4LLE 和HepG2)和鱼类(PLHC⁃1 和RTH⁃149)细胞毒性[10]。Chen 等人[6]实验得出纳米氧化锌的细胞毒性随着粒径的增加而降低,20,90,200 nm 的氧化锌对HepG2 细胞的IC50分别为20.7,29.1,160 mg·L-1。Gandamalla 等[7]将 人 肺 细胞A549 暴露于不同粒径二氧化钛纳米颗粒中,发现最小粒径的颗粒引起的细胞毒性最大。以上研究表明材料的毒性与粒径大小密切相关。遗憾的是,目前关于纳米级TATB、HNS 和LLM⁃105 炸药的毒性数据未见报道。
鉴于材料纳米化后不容忽视的生物毒性问题以及纳米炸药的应用潜力,其对环境和人类的影响引起了广泛的关注[11-13]。本研究选取小鼠巨噬细胞系RAW264.7 细胞为受试对象,检测纳米级TATB、HNS和LLM⁃105 暴露后的细胞活性,获得其细胞毒性与其暴露剂量之间的关系;并通过观察细胞形态变化,表征乳酸脱氢酶、过氧化物歧化酶的活力、丙二醛含量的变化等,探究其对细胞的毒性作用机制。
2 实验部分
2.1 试剂与仪器2.1.1 主要试剂
RAW264.7 巨噬细胞购自武汉普诺赛生物科技有限公司;DMEM 高糖培养基(Dulbecco's Modified Ea⁃gle's Medium)、胰酶均购自Hyclone 公司;南美胎牛血清购自CLARK 公司;CCK⁃8 试剂盒购自Biosharp 公司;乳酸脱氢酶、超氧化物歧化酶、丙二醛检测试剂盒均购自南京建成生物工程研究所;纳米级HNS、TATB、LLM⁃105 来自中国工程物理研究院化工材料研究所。
2.1.2 主要仪器
ULTRA55 型场发射扫描电子显微镜(德国赛斯仪器公司);AE31 型倒置生物显微镜(麦克奥迪实业集团有限公司);MCO⁃15AC 型二氧化碳培养箱(三洋电机国际贸易有限公司);压力蒸汽灭菌器(上海宜川仪表厂);spectra max PLUS 384 型酶标仪(美国Molecu⁃lar Devices 公司)。
2.2 实验过程
2.2.1 粒子表征
取TATB、HNS、LLM⁃105 粉体于导电胶上,喷金处理后,扫描电镜观察。
2.2.2 CCK⁃8 法检测细胞活性
取对数生长期的细胞,调整细胞密度为6×104个·mL-1,接种于96 孔板,37 ℃、5% CO2恒温培养,待细胞贴壁后,加入不同浓度培养基配制的HNS、TATB、LLM⁃105悬浮液,同时设置对照组。放入孵箱培养24 h 后,加200 μL 的CCK8 试剂,4 h 后测定450 nm 处的吸光度(D)。细胞存活率计算公式为:
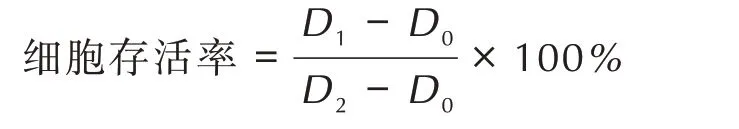
式中,D0为调零组吸光度;D1为实验组吸光度;D2对照组吸光度,单位均为L·(g·cm)-1。
2.2.3 形态学表征
取对数生长期的细胞,按照2.2.2 方法染毒24 h后,采用倒置显微镜和扫描电镜观察细胞形态改变。
2.2.4 细胞培养液上清LDH 活性检测
取对数生长期的细胞,按照2.2.2 方法染毒24 h后,收集细胞上清液,利用LDH 试剂盒测定LDH活力。
2.2.5 细胞氧化应激指标检测
取对数生长期的细胞,按照2.2.2 方法染毒24 h后,收集细胞用于SOD 活力、MDA 含量检测,操作步骤严格按照试剂盒说明书进行。
2.3 统计方法
本实验所测细胞活性及相关酶活性均来自三组平行样品,数据均以“均数±标准差”表示,采用SPSS22.0软件进行数据处理,并用单因素方差分析统计实验数据,P<0.05 表示差异显著;P<0.01 表示差异极显著。
3 结果与讨论
3.1 材料表征
三种纳米级炸药的扫描电镜结果如图1 所示,可见HNS、TATB、LLM⁃105 的平均粒径大小分别是200,60,150~200 nm;形状分别为矩形棒状、圆球形、近球形。

图1 HNS、TATB、LLM⁃105 的扫描电镜图Fig.1 SEM image of HNS,TATB and LLM⁃105 particles
3.2 细胞活性影响
体外细胞毒性实验常用于预测化学材料对生物体的毒性情况[14],常选取一些免疫细胞如巨噬细胞、淋巴细胞、粒细胞等作为受试对象。巨噬细胞具有吞噬、清除异物的功能,在生物体的免疫调节中发挥着重要的防御作用[15-16],因此,研究纳米颗粒对巨噬细胞的毒性效应,对预测纳米颗粒的毒性十分重要。
采用CCK⁃8 法测定了不同浓度下三种纳米级炸药染毒24 h 后的细胞活性,其结果列于表1。图2 给出了细胞活性随三种纳米炸药染毒浓度的演化关系。可以发现,RAW264.7 巨噬细胞活性随三种炸药浓度增加的变化趋势相似,都呈现出明显的剂量⁃效应关系;但三者的毒性作用程度明显不同。其中,LLM⁃105导致细胞活性下降最快,HNS 次之,TATB 最慢。例如,当浓度为5 μg·mL-1时,LLM⁃105 染毒组的细胞存活率为(56.5±3.97)%,而TATB 组的细胞存活率为(93.7±6.66)%;当浓度达到最大的250 μg·mL-1时,TATB 染 毒 组 的 细 胞 存 活 率 为(50.2±1.98)%,是LLM⁃105 组的细胞存活率(9.9±2.9)%的5~6 倍。依据图2 的剂量⁃效应关系,计算得出LLM⁃105、HNS、TATB 对RAW264.7 细 胞24 h 的 半 抑 制 浓 度(IC50)值分别为6.6,49.3,211.3 μg·mL-1,可知三种纳米级炸药对RAW264.7 细胞毒性强弱顺序为LLM⁃105>HNS>TATB。目前最为广泛接受的毒性机制包括 破 坏 细 胞 完 整 性[17]、氧 化 应 激[18-20]、炎 症 反应[19-20]等,因此重点对细胞膜损伤和氧化应激水平进行了讨论。
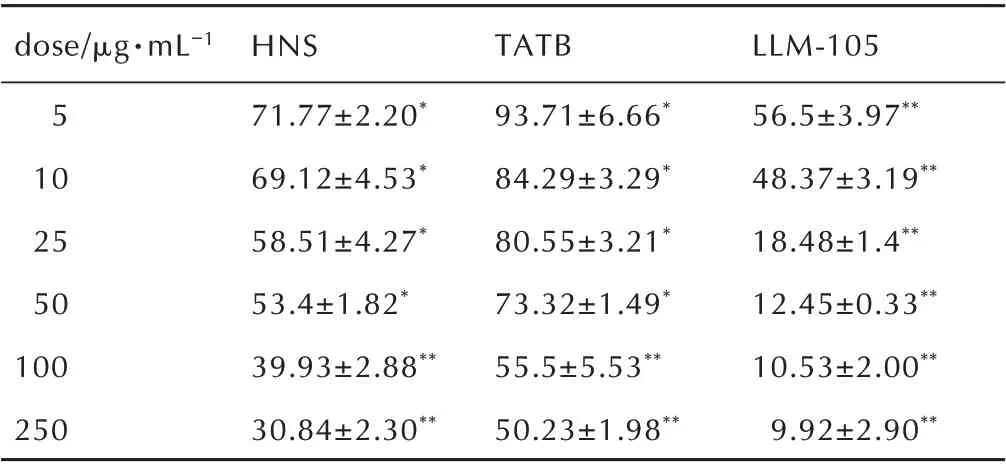
表1 不同剂量水平上三种纳米级炸药对RAW264.7 细胞毒性比较(24 h 染毒,%)Table 1 The cytotoxicity comparison among three kinds of nano⁃scale explosives to RAW264.7 at different doses(24 h exposure,%)
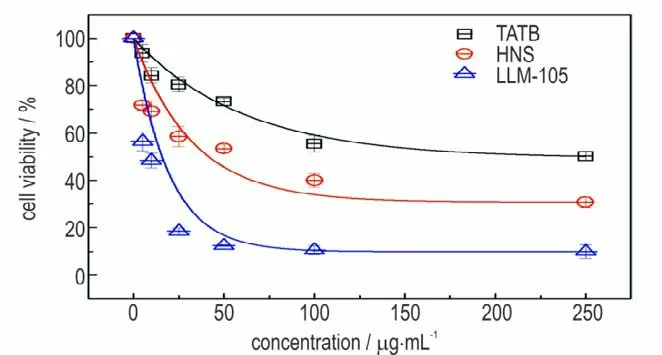
图2 不同染毒剂量三种纳米级炸药对RAW264.7 细胞活力的影响Fig.2 Effects of three kinds of nano⁃scale explosives on RAW264.7 cell viability
3.3 细胞形态学变化
采用倒置显微镜观察RAW264.7 细胞的形态变化,结果如图3 所示。对照组细胞形态呈圆形,有较小的足样突起,细胞体积小,贴壁紧密,细胞密度较大,生长状态良好(图3a)。低浓度(5 μg·mL-1)TATB 与HNS 染毒组与对照组相比,细胞形态无显著差异(图3b 和3e),说明低浓度的TATB 与HNS 对细胞结构功能损害较小,细胞形态变化不明显,这与CCK⁃8 细胞活性结果一致;而LLM⁃105 染毒细胞的数量减少明显(图3h)。当浓度达到10 μg·mL-1时,TATB 和HNS染毒细胞也开始出现细胞密度减小、细胞变长等变化(图3f);LLM⁃105 染毒组部分细胞伪足消失,细胞呈长梭形,细胞数量显著减少(图3i);当浓度达到100 μg·mL-1时,各染毒组细胞皱缩变圆,细胞密度降低,间隙变大。以毒性最大的LLM⁃105 染毒细胞为例,扫描电镜观察了LLM⁃105 最高浓度下RAW264.7 细胞的微观结构,可以清楚地看到细胞破碎及其碎片(图4b),说明细胞膜受损严重。总体来看,细胞形态学观察结果基本上与细胞活性检测结果一致。
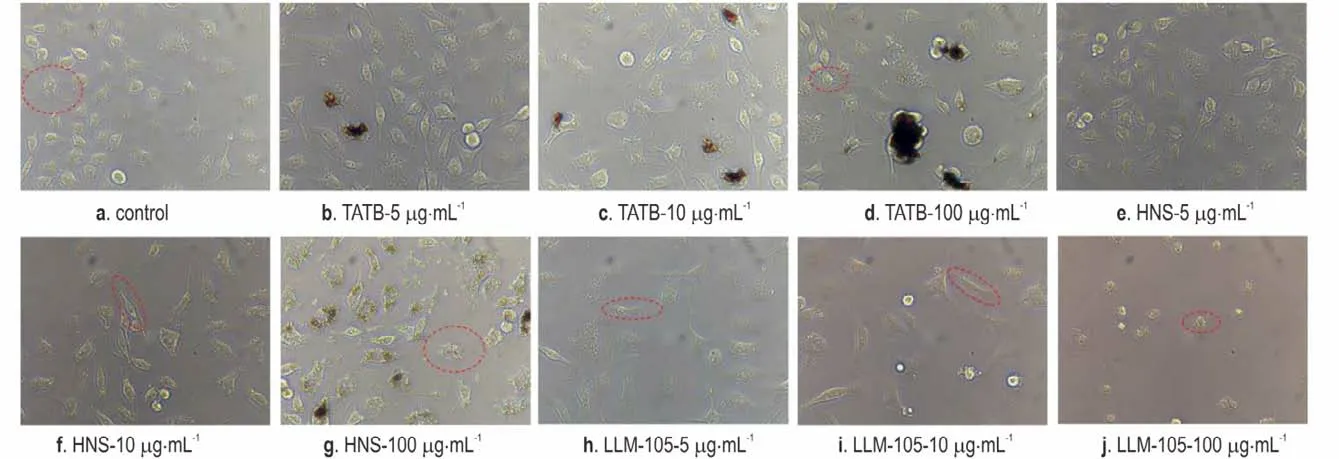
图3 三种纳米级炸药染毒RAW264.7 细胞的形态变化(×400)Fig.3 Morphological changes of RAW264.7 cells infected with three kinds of nano⁃scale explosives(×400)

图4 LLM⁃105 颗粒(250 μg·mL-1)染毒RAW264.7 细胞的形态变化(SEM)(a. 对照组,b. 250 μg·mL-1 LLM⁃105 染毒RAW264.7 细胞组)Fig.4 Morphological changes of RAW264.7 cells infected with nano⁃LLM⁃105 particles(SEM)(a. control group,b. 250 μg·mL-1 LLM⁃105 infected with RAW264.7 cells)
3.4 细胞膜渗透性影响
乳酸脱氢酶(LDH)是一种胞浆酶,当细胞膜受损或通透性增加时可泄漏至细胞外,故细胞培养液上清中LDH 活性的大小可反映细胞膜的损伤程度[21]。本实验测试的LDH 活性随纳米级炸药浓度演化关系如图5 所示。与对照组相比,染毒组的细胞上清液中LDH 活性均随炸药浓度增加而升高,差异有统计学意义(P<0.05)。结果说明,染毒后RAW264.7 细胞膜损伤程度有剂量依赖性,与本实验中细胞活性的检测结果及细胞形态变化相符。实际上,通过损伤细胞膜导致细胞死亡是纳米材料细胞毒性的常见机制。如Kang 等[17]发现碳纳米管是通过直接损伤细胞膜并导致细胞代谢能力下降和核酸外泄引起的细胞死亡。Kim 等[22]发现小鼠前成骨细胞暴露于银纳米颗粒48 h 后,细胞上清液中LDH 活性显著增加。由此可见,受试细胞与纳米材料接触后,细胞膜的完整性遭到破坏是细胞死亡的重要原因。
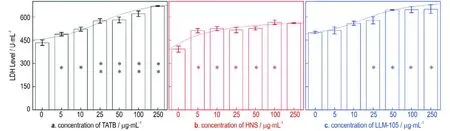
图5 不同染毒剂量三种纳米级炸药对RAW264.7 细胞LDH 活力的影响(*P<0.05,**P<0.01)Fig.5 Effects of three kinds of nano⁃scale explos on RAW264.7 cell LDH activity
3.5 细胞氧化应激水平
活性氧自由基(reactive oxygen species,ROS)的产生及对生物体的毒害作用是迄今最为普遍接受的一种纳米材料致毒机制[23]。过氧化物歧化酶(SOD)是直接参与分解体内ROS 的主要抗氧化酶,可使超氧阴离子自由基歧化为过氧化氢和氧气。SOD 活性的变化通常说明机体内积累了过量的ROS,氧化还原平衡态失衡,诱发了氧化应激效应[24]。过量的ROS 会攻击生物膜上的不饱和脂肪酸,造成氧化损伤,产生丙二醛(MDA)等代谢产物并在细胞内积累[25]。因此通过这两种指标的变化,可以说明细胞内氧化应激水平。Jin[26]等发现随TiO2纳米颗粒浓度的增加,小鼠成纤维细胞中ROS 和LDH 的水平升高,而SOD 的活力下降。Ahamed[27]等发现Bi2O3纳米颗粒能够通过降低抗氧化剂含量(SOD)来调节细胞的氧化还原稳态。也有研究指出细胞毒性与体内诱发氧化应激密切相关,如Zeng[28]等指出氧化应激早期为了处理过量ROS,SOD的合成量会上升,而当抗氧化酶系统没有能力处理过量的ROS 时,SOD 的活力则会下降。
图6 结果显示,经HNS 暴露24 h 后,染毒组的细胞SOD 活力无明显差异,不具备统计学意义;而TATB与LLM⁃105 染毒组与对照相比,各组细胞中SOD 活力随染毒剂量的增加而呈下降趋势,而其中LLM⁃105 细胞中SOD 活力下降更为显著。SOD 活力下则意味着ROS 的清除能力受到抑制,过量的自由基可氧化生物膜的不饱和脂肪酸,使细胞膜结构受到损伤,从而降低细胞活性。正如图7 所示,与对照组相比,LLM⁃105 染毒组可明显引起细胞内MDA 含量的升高,而TATB 和HNS 染毒组引起胞内MDA 含量的变化不明显。LLM⁃105 染毒组细胞MDA 含量的升高,表明细胞内脂质过氧化产物增多,SOD 活力下降可能与自由基的增多使抗氧化酶迅速被消耗有关,这些结果说明LLM⁃105 造成细胞内产生并积累了过量ROS,诱发了氧化应激,进而造成了氧化损伤。TATB 虽然引起SOD活力的下降,但是并未导致MDA 含量的明显增加,说明TATB 对SOD 活力有轻微的抑制作用,未造成显著的氧化损伤。本次实验过程中未检测到HNS 染毒组引起细胞内氧化应激反应,由此可以得出细胞膜完整性的破坏可能是HNS 导致细胞活性下降的主要原因。LLM⁃105对细胞的氧化损伤效应明显强于TATB 和HNS,可能与分子结构中的配位氧有关系,但这需要进一步的验证。
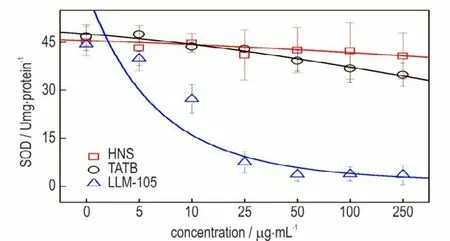
图6 不同染毒剂量三种纳米级炸药对RAW264.7 细胞内SOD 活性的影响Fig.6 Effects of three kinds of nano⁃scale explosives on SOD activity in RAW264.7 cells
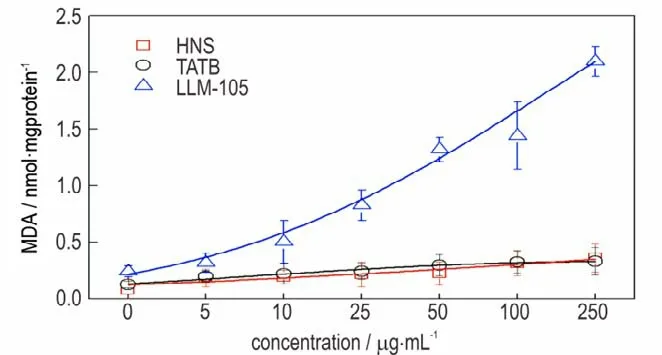
图7 不同染毒剂量三种纳米级炸药对RAW264.7 细胞内MDA 含量的影响Fig.7 Effects of three kinds of nano⁃scale explosives on MDA content in RAW264.7 cells
4 结论与展望
(1)讨 论 了 三 种 纳 米 级 炸 药HNS、TATB、LLM⁃105 对RAW 264.7 细胞的毒性效应,在实验浓度范围和作用时间内,纳米级HNS、TATB、LLM⁃105 对RAW264.7 细胞24 h 染毒的半抑制浓度分别为49.3,211.3,6.6 μg·mL-1,表明三种纳米级炸药具有明显的细胞毒性作用,且呈剂量⁃效应关系。
(2)纳米级HNS、TATB、LLM⁃105 导致细胞毒性的机制主要有两方面,一是直接与细胞相互作用,可改变细胞形态,破坏细胞膜结构完整性,导致细胞死亡;二是纳米TATB 和LLM⁃105 还可以引起细胞内氧化应激反应,进而造成组织的氧化损伤,导致细胞死亡。
(3)仅探讨了纳米级HNS、TATB、LLM⁃105 的细胞尺度上的毒性效应,但纳米材料的毒性评价需要针对同一种模型微生物以及动物,探究其在细胞、微生物和动物水平上的毒性效应;未来的研究应继续开展微生物以及动物水平的体内毒性效应实验研究,以便全面判断三种纳米级炸药的生物毒性。
