YAP信号通路在姜黄素诱导HepG2肝癌细胞系凋亡中的作用
2020-08-08于洪丹张舒文谷学静
于洪丹,张舒文,谷学静
(1.锦州医科大学辽宁省糖尿病感知功能障碍重点实验室;2.锦州医科大学附属第一医院消化内科;3.锦州医科大学人体解剖学教研室,辽宁 锦州 121000)
肝癌是导致全球癌症患者死亡的第三大原发性恶性肿瘤,每年死亡人数超过60万人。早期肝癌患者以手术为首要治疗手段,但是对于中晚期肝癌或者术后化疗患者仍以药物治疗为主[1-3]。植物源性中药以其毒性低,副作用小而成为近年来关注的热点。姜黄素是从姜科、天南星科植物的根茎中提取的重要活性成分之一,在骨髓瘤、胰腺癌、前列腺癌、乳腺癌、肺癌等多种类型肿瘤中表现出抗肿瘤活性[4-5],但姜黄素在肝癌中的作用及确切机制尚需进一步研究[6]。本研究拟观察姜黄素对HepG2肝癌细胞系增殖、凋亡的影响及机制,期望为肝癌的临床治疗提供新的理论依据和治疗参考。
1 材料与方法
1.1 细胞与试剂
人HepG2肝癌细胞系(北纳生物),姜黄素(纯度≥99%,沈阳药科大学药剂学教研室赠送),RPMI-1640 (BIOIND),增强型CCK-8试剂盒(尚宝生物),ROS检测试剂盒(碧云天),Annexin V-FITC/PI细胞凋亡检测试剂盒(索来宝),BCA蛋白浓度检测试剂盒(索来宝),单克隆抗体GAPDH(华美生物),Cleaved caspase-3、细胞色素C(cytochrome C,Cyt C)、Yes相关蛋白(yes-associated protein,YAP)、HRP标记二抗(proteintech)。
1.2 细胞培养与实验分组
HepG2肝癌细胞复苏后置于含10% FBS和1%青-链霉素的RPMI-1640培养基中,在37 ℃,5% CO2培养箱中培养,隔日换液,0.25%胰酶消化、传代,取对数生长期细胞进行相关实验。称取10 mg姜黄素,溶于0.5 mL DMSO,再利用培养基稀释终浓度为5、10、20 μg/mL姜黄素溶液,DMSO 终浓度最高为1‰。对照组为正常培养基,DMSO组为含1‰的DMSO培养基。
1.3 细胞形态学观察及细胞增殖检测
取对数生长期的HepG2肝癌细胞接种于96孔板内,控制细胞数量为2×103个/孔,贴壁后更换含有姜黄素的培养基100 μL,每个浓度5个复孔。24、48 h后倒置显微镜下观察细胞生长状态,观察拍照,再分别加入CCK-8试剂10 μL,继续 培养1 h,于490 nm测定吸光度(A)。计算细胞活力(cell viability)=(A实验组-A空白)/(A对照组-A空白)×100%。
根据细胞形态观察和细胞增殖检测结果,取10 μg/mL的姜黄素培养基培养48 h检测以下各项指标。
1.4 流式细胞法检测细胞凋亡
取对数生长期的HepG2肝癌细胞接种于6孔板内,控制细胞数量为1×106个/孔,贴壁后分组培养48 h,再胰酶消化收集细胞(1×106/mL),预冷的PBS清洗两遍,300 g离心10 min,1 mL Bingding Buffer悬浮后弃上清,0.5 mL Binding Buffer重悬细胞,取100 μL细胞于流式管中(2×105个),加入5 μL Annexin V-FITC,混匀后室温避光孵育10 min,再加入5 μL PI室温避光孵育5 min,加入PBS至500 μL。分别对Annexin V-FITC和PI染料作单阳对照,1 h内用流式细胞仪检测。
1.5 DCFH-DA荧光染色检测细胞ROS水平
取对数生长期的HepG2肝癌细胞接种于6孔板内,控制细胞数量为2×105个/孔,贴壁后分组培养48 h后更换10 μM 的DCFH-DA培养基,继续培养20 min,PBS清洗去掉未装载的探针,激发波长485 nm、发射波长525 nm,细胞成像微孔板检测系统检测细胞ROS水平。
1.6 免疫印迹法(Western blot)检测蛋白表达
取对数生长期的HepG2肝癌细胞接种于6孔板内,控制细胞数量为1×106个/孔,贴壁后分组培养48 h,用RIPA细胞裂解液提取全蛋白,BCA法测定蛋白浓度,与上样缓冲液混合后100 ℃煮沸5 min,配制10%~12%的SDS-PAGE聚丙烯酰胺凝胶进行分离,湿转法转移到PVDF膜上,5% BSA进行封闭,4 ℃孵育一抗Cleaved caspase-3、Cyt C、YAP过夜,TBST清洗3次后室温孵育二抗2 h,增强化学发光法检测,以GAPDH作为内参。
1.7 统计学方法
使用SPSS 19.0软件对实验数据进行统计分析,多组样本之间的比较采用单因素方差分析及两两比较的SNK检验,两组间比较采用两独立样本t检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 姜黄素影响HepG2肝癌细胞系的形态学
显微镜观察细胞形态发现,姜黄素对HepG2肝癌细胞系的形态学影响表现出明显的时间依赖性和剂量依赖性。10 μg/mL姜黄素作用48 h后,贴壁细胞数量明显减少,大量细胞失去原有形态,外形变圆,边缘变亮,与20 μg/mL姜黄素作用24 h或48 h后细胞形态变化类似,见图1。
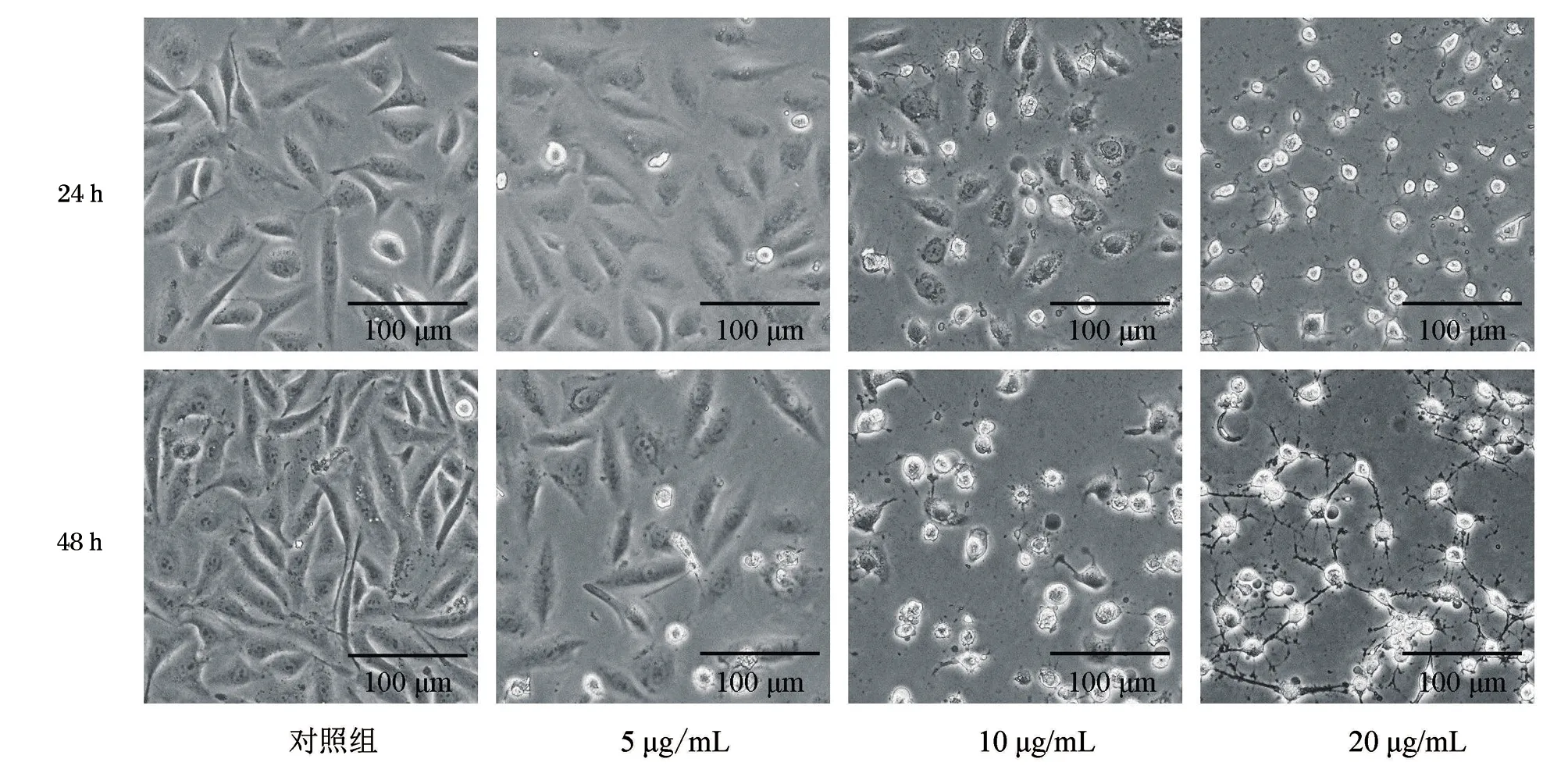
图1 姜黄素对HepG2肝癌细胞形态的影响
2.2 姜黄素抑制HepG2肝癌细胞系的增殖
CCK-8试剂盒检测结果显示,姜黄素对HepG2肝癌细胞系的增殖有明显的抑制作用。与对照组相比,5 μg/mL姜黄素作用24 h和48 h后细胞抑制作用不明显(P>0.05),10 μg/mL和20 μg/mL姜黄素作用24 h和48 h均表现出明显抑制效应(P<0.05)。10 μg/mL和20 μg/mL姜黄素组与5 μg/mL姜黄素组相比,同样具有统计学意义(#P<0.05)。本研究选取10 μg/mL姜黄素处理细胞48 h开展后续实验,见图2。

图2 姜黄素对HepG2肝癌细胞增殖抑制率的影响
2.3 姜黄素诱导HepG2肝癌细胞系的凋亡
流式细胞仪检测结果显示,对照组细胞凋亡比例为10.24%,DMSO组细胞凋亡比例为14.50%,两组相比未见显著变化(P>0.05),而姜黄素组细胞凋亡比例达到26.74 %,明显高于对照组(P<0.05)。结果表明姜黄素能诱导HepG2肝癌细胞系的凋亡,见图3。

其中右上象限代表晚期凋亡,右下象限代表早期凋亡
2.4 姜黄素促进HepG2肝癌细胞系ROS的产生
与对照组相比,姜黄素组细胞绿色荧光明显,DMSO组无明显变化。结果表明姜黄素组细胞ROS水平明显升高,姜黄素能促进肝癌HepG2细胞发生氧化应激,见图4。

图4 姜黄素对HepG2肝癌细胞内活性氧(ROS)水平的影响
2.5 姜黄素对YAP信号通路蛋白表达的影响
与对照组相比,凋亡相关蛋白Cleaved caspase-3、Cyt C表达明显升高,YAP的蛋白表达水平显著下调(P<0.05),DMSO组无显著变化(P>0.05),见图5。
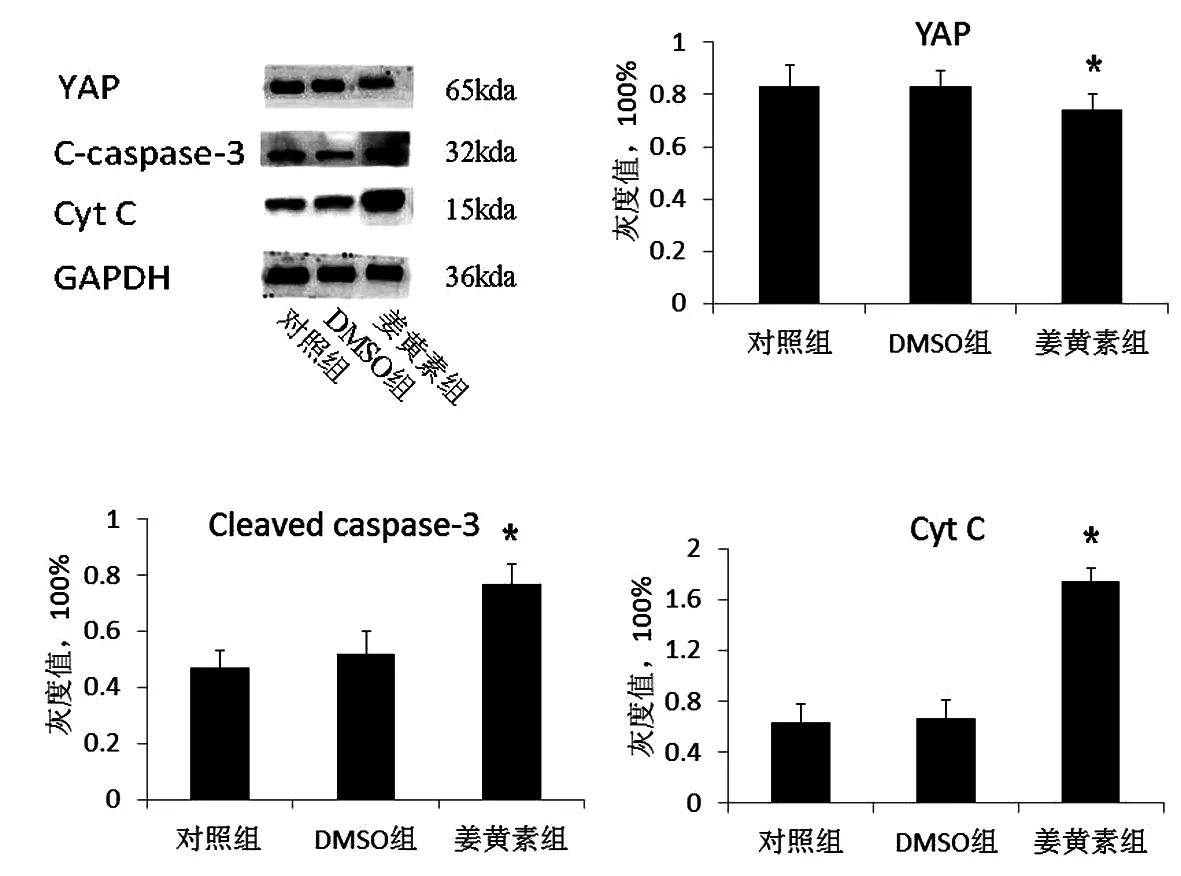
图5 姜黄素对HepG2肝癌细胞相关蛋白表达水平的影响
3 讨 论
姜黄素是姜科植物姜黄根茎中存在的一种亮黄色疏水多酚类化合物,对多发性骨髓瘤、胰腺癌、前列腺癌、乳腺癌、肺癌等多种类型肿瘤均表现出明显的抗肿瘤活性[5,7]1-13。姜黄素可通过多种机制发挥抗肿瘤作用,如调节MAPK信号通路、Notch-1信号通路以及调节NF-κB、COX-2、ROS含量等[8-10]。姜黄素双向调节氧化应激反应,在慢性肾病、痛风性关节炎等疾病中,具有降低线粒体中活性氧类物质、清除自由基的功能[11];而在肿瘤细胞中,姜黄素及其类似物具有促进氧化应激,诱导肿瘤细胞凋亡的功能[12]。本研究中也发现姜黄素能显著增加HepG2肝癌细胞系中ROS水平,促进氧化应激的发生。
YAP是一种重要转录调节因子,对肿瘤细胞的增殖和凋亡起到重要调控作用。研究发现姜黄素可抑制胰腺癌细胞中YAP-Notch信号通路进而抑制癌细胞的增殖[13],同样在膀胱癌和结肠癌中也发现姜黄素可降低YAP信号通路起到抗肿瘤的作用[14]。本研究也发现姜黄素能明显下调HepG2肝癌细胞系中YAP蛋白的表达。YAP可调控的蛋白包括细胞周期相关蛋白、p53凋亡信号相关蛋白、Wnt/β-catenin信号相关蛋白等[15-16]。此外,YAP还可以调控ROS的含量,如YAP能正调控抗氧化基因过氧化氢酶的转录,进而下调ROS水平[17]。与之类似,本研究发现姜黄素抑制HepG2肝癌细胞YAP蛋白的表达,导致ROS在细胞内堆积,发生了明显的氧化应激。
适量的ROS能促进肿瘤细胞增殖,但大量的ROS产生会诱导肿瘤细胞凋亡[18]。高水平的ROS能促进细胞发生氧化应激反应、导致DNA氧化性损伤,激活p53依赖性凋亡信号通路[19]。细胞内ROS的累积还会导致线粒体氧化性损伤,线粒体膜通透性发生改变,引起bcl-2家族促凋亡蛋白Bax上调,抑凋亡蛋白Bcl-2下调,促使线粒体释放细胞色素C (cytochrome C,Cyt C)到胞质中,导致caspase家族的凋亡执行蛋白Caspase 3激活,最终引发细胞的凋亡过程[20]。本研究中,伴随着ROS的堆积,HepG2肝癌细胞系发生了明显的凋亡。因此,姜黄素可能通过诱发氧化应激的机制诱导了HepG2肝癌细胞系凋亡。
综上所述,本研究中姜黄素在HepG2肝癌细胞系中表现出明显的抗肿瘤活性,可抑制HepG2细胞增殖,促进细胞凋亡。其机制可能与姜黄素抑制YAP表达,促进ROS在细胞内堆积,诱发氧化应激反应,进而引发凋亡反应相关。
