宫颈高危HPV持续感染者脱落细胞中LncRNA NEAT1和HOTAIR的表达及临床意义
2020-08-08代爱霞
周 薇 代爱霞
上海市宝山区大场医院(200436)
研究已证实,高危型人乳头瘤病毒(HPV)持续感染与宫颈癌密切相关[1]。80%的妇女一生中会感染HPV,只有少部分患者出现HPV持续感染,甚至出现宫颈上皮病变、宫颈癌等严重病理变化[2]。大部分宫颈癌变原因是HPV持续感染[3]。目前宫颈癌癌前检查主要通过宫颈脱落细胞学检测或联合HPV DNA检测,但单次检测结果不能代表HPV持续感染。长链非编码RNA(LncRNA)是一类RNA分子,参与肿瘤细胞内多种信号过程[4]。HOX转录反义RNA(HOTAIR)是长度为2158nt的LncRNA,与胰腺癌、肝癌、宫颈癌等发生发展相关[5]。LncRNA核富集转录体(NEAT1)在多种恶性肿瘤中表达异常[6]。但关于LncRNA NEAT1和HOTAIR在宫颈HPV持续感染研究鲜有报道。故本研究检测宫颈HPV持续感染患者脱落细胞中LncRNA NEAT1和HOTAIR的表达水平,为临床早期诊断提供理论依据。
1 资料与方法
1.1 一般资料
选取2017年8月-2018年8月本院确诊并治疗的宫颈高危型HPV感染患者56例。纳入标准:①经临床诊断证实为HPV持续感染;②未经任何手术、药物治疗;③能按期随访,具有完整临床资料;④医院伦理委员会批准,患者知情同意。排除标准:①既往无宫颈上皮内瘤、宫颈癌和其他恶性肿瘤;②年龄>60岁。
1.2 标本处理
使用采样刷收集患者宫颈脱落细胞标本,行液基薄层细胞学检查(TCT)和HPV DNA基因型检测。细胞部分用于4%甲醛溶液固定,离心、浓缩后涂片,用于p16、Ki67检测;部分于HPV DNA检测的保存液中保存;部分-80℃冻存。
1.3 HPV DNA基因型检测
取保存液样本500μl离心,提取DNA,PCR扩增体系PCR反应试剂及Tap酶加入试管中,DNA模板1 L,振荡混匀离心行PCR扩增;同时分别扩增HPV18型阳性对照和阴性对照以做参照。采用凯普医用核酸分子快速倒流仪进行导流杂交,酶标显色,检测扩增HPV产物的基因分型。结果判定:阳性点可见蓝紫色的圆点,根据HPV膜条分型分布图判定HPV病毒类型。本研究检测显示14种高危亚型:68、66、58、33、16、18、31、51、39、45、52、59、53、56,5种低危亚型6、11、44、43。
1.4 免疫组织化学检测p16、Ki67
涂片经3% H2O2溶液室温孵育10min,阻滞内源H2O2酶活性,10mmol/L(pH8.0)缓冲液清洗;90℃水浴30min抗原热修复;滴加p16、Ki67单克隆抗体(1:500),4℃孵育过夜,PBS洗3×5min;洗涤后滴加酶标二抗37℃孵育30 min,PBS洗3×5min;滴加DAB显色。p16定位于胞质和胞核,染色棕黄色为阳性;Ki67定位于胞核,胞核棕黄色为阳性。脱落宫颈细胞着色>10%即判定为阳性标本。
1.5 qRT-PCR检测LncRNA NEAT1和HOTAIR
取冻存的细胞标本提取细胞中总RNA,紫外分光光度计检测RNA浓度和纯度,将良好的RNA反转录为cDNA,以cDNA为模板进行qRT-PCR检测LncRNA NEAT1和HOTAIR相对表达量,在冰上配置PCR反应液,反应体系为25 μl:SYBR GreenⅡqPCR Master Mix 12 μl,上下游引物各1 μl,cDNA模板1 μl,ddH2O 10 μl,振荡离心充分混匀PCR反应液;引物由生工生物工程(上海)股份有限公司合成,引物序列见表1。采用3步法设定反应程序为:95℃ 10 min;95℃ 15 s;48℃ 30 s;72℃ 30 s,共40个循环。PCR反应结束后收集数据,对Ct值进行分析,LncRNA NEAT1和HOTAIR以U6为内参基因,采用2-ΔΔCt算法计算LncRNA NEAT1和HOTAIR的相对表达量。

表1 引物信息
1.6 统计学方法
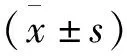
2 结果
2.1 两组患者一般资料比较
根据HPV检测持续感染组26例、转归组30例,两组一般资料比较无差异(P>0.05),见表2。
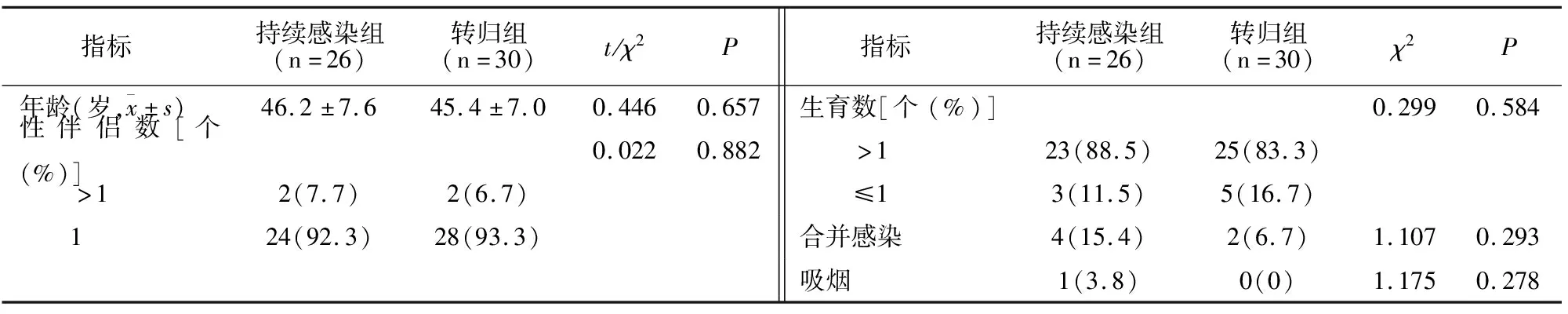
表2 两组患者一般资料比较
2.2 脱落细胞检测指标
宫颈HPV感染患者中脱落细胞LncRNA NEAT1、HOTAIR表达水平持续感染组表达高于转归组(P<0.05)。见图1。免疫组化检测p16、Ki67表达阳性率持续感染组(73.3%、66.7%)高于转归组(19.2%、11.5%)(χ2=16.329、17.490,均P=0.000)。
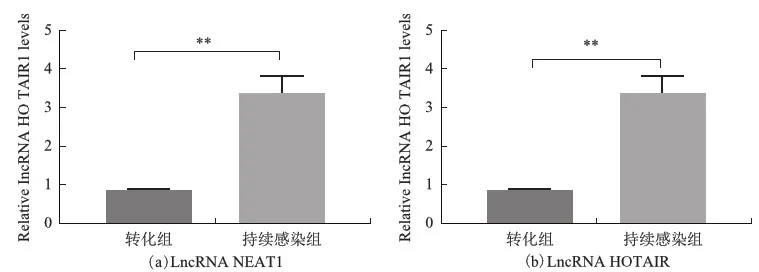
图1 宫颈脱落细胞中相对表达量
2.3 p16、Ki67与LncRNA NEAT1、HOTAIR相关性
Spearman相关性分析显示,LncRNA NEAT1、LncRNA HOTAIR表达与p16、Ki67均呈显著正相关。见表3。
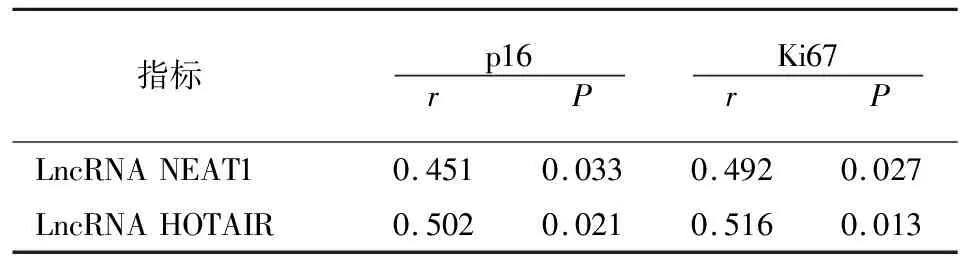
表3 各指标相关性分析
2.4 LncRNA NEAT1和HOTAIR诊断宫颈HPV持续感染价值
ROC曲线分析显示,LncRNA NEAT1诊断宫颈HPV持续感染的特异性为95.7%,敏感性为60.0%;LncRNA HOTAIR诊断宫颈HPV持续感染的特异性为84.6%,敏感性为90.0%。具体见表4、图2。
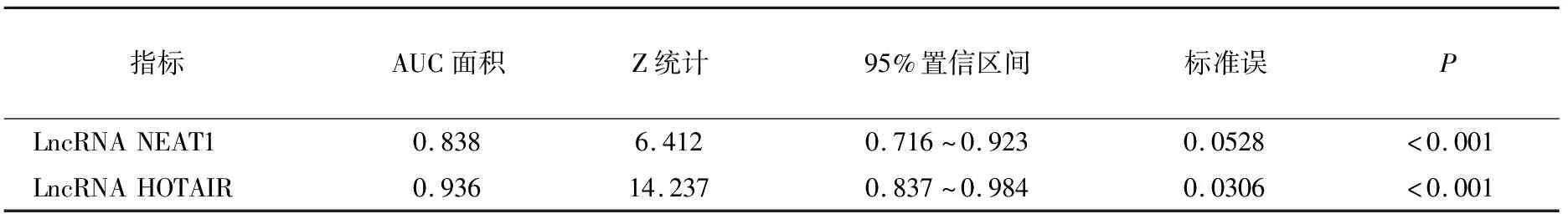
表4 两种指标诊断宫颈HPV持续感染分析
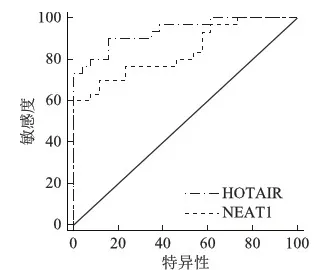
图2 两种指标诊断HPV持续感染AUC曲线分析
3 讨论
宫颈癌患者多数是由癌前病变-子宫颈上皮内瘤逐渐发展而来,发病与HPV持续感染关系密切[7],早期诊断HPV持续感染可降低发生宫颈癌风险。目前对宫颈HPV持续感染主要是宫颈脱落细胞学检测或HPV DNA检测,但单次检测结果难以确定感染状态,选择宫颈HPV持续感染的特异性标识物具有临床意义。
LncRNA在多种肿瘤病理变化中发挥重要作用。一些相关研究显示,LncRNA NEAT1是非编码RNA,属细胞核内旁斑的重要组成部分[8];在乳腺癌患者中异常高表达,且与淋巴结转移和肿瘤大小密切相关[9];在卵巢癌表达高于癌旁组织,且与肿瘤分级、FIGO分期、淋巴结转移等密切相关[10];在宫颈组织表达量随着宫颈病变程度增加而增高,宫颈癌表达高于宫颈炎和宫颈上皮内瘤样病变组织,提示NEAT1参与了从早期炎症到晚期癌变的全过程[11]。高危HPV持续感染与宫颈癌发生关系密切,但NEAT1表达与HPV感染的关系鲜有报道。本研究结果显示,宫颈HPV持续感染组脱落细胞中LncRNA NEAT1水平高于转归组,提示LncRNA NEAT1可能参与了HPV持续感染的过程。有研究报道miRNA-34a在宫颈HPV持续感染组中表达显著升高,可作为HPV感染转归的新指标[12]。而生物信息学分析显示miRNA-34a是LncRNA NEAT1的靶基因,推测LncRNA NEAT1可能通过参与调控miRNA-34a表达参与宫颈HPV持续感染及后续癌变过程。ROC曲线分析显示,LncRNA NEAT1诊断宫颈HPV持续感染的AUC面积是0.838,有望作为宫颈HPV持续感染的潜在早期诊断指标之一。
LncRNA HOTAIR是第一个被发现的反式转录调控LncRNA,通过调节血管内皮生长因子(VEGF)表达影响上皮间质转化,促进宫颈癌的发生发展。薛世民等研究报道,非小细胞癌患者中LncRNA HOTAIR异常高表达,且与患者临床分期及预后等密切相关[13]。Geng等报道干扰肝癌细胞中LncRNA HOTAIR的表达,VEGF和基质金属蛋白酶-9(MMP-9)表达减少,是多种肿瘤早期诊断标志物[14]。本研究显示,宫颈HPV持续感染组LncRNA HOTAIR表达水平高于转归组,提示其可能与HPV持续感染有关。ROC曲线分析显示,LncRNA HOTAIR诊断宫颈HPV持续感染的AUC面积是0.936,有望成为宫颈HPV持续感染的早期预测指标。
p16可通过突变、缺失引起细胞周期紊乱,引发细胞癌变。在多数肿瘤组织中出现基因缺失,表达降低,但在宫颈癌中表达不同[15]。HPV E7蛋白与pRb结合,解除pRb对p16蛋白表达的负调控,引起p16表达升高[16]。p16高表达与宫颈癌临床分期、分化程度密切相关[17]。Ki67可反映宫颈癌细胞增殖情况[18]。当p16、Ki67均高表达时提示机体细胞周期异常,二者常作为宫颈癌早期诊断的敏感性标志物。本研究结果显示p16、Ki67在HPV持续感染组中阳性表达率升高。Spearman相关性分析显示,LncRNA NEAT1、HOTAIR与p16、Ki67呈显著正相关,提示二者可能与宫颈癌前期HPV持续感染有关;LncRNA NEAT1、HOTAIR在HPV持续感染患者中均高表达,而宫颈癌发病大多数与HPV持续感染相关,提示可通过检测宫颈脱落细胞中LncRNA NEAT1、HOTAIR早期预防。
综上所述LncRNA NEAT1、HOTAIR在宫颈HPV持续感染患者脱落细胞中异常高表达,可能成为宫颈HPV持续感染的临床诊断指标,预防宫颈癌变。但本研究样本量不足,仅提供一种思路,还需扩大样本探究其作用机制。
